Десульфатация аккумулятора зарядным устройством своими руками. Как правильно сделать
Десульфатация аккумулятора — это процесс очищения пластин аккумулятора от сульфата свинца, который образуется на них в процессе неправильной зарядки, неверной эксплуатации или просто от старости аккумуляторной батареи. Десульфатацию аккумулятора можно выполнить специальным или обычным зарядным устройством, однако при этом есть особенности алгоритма непосредственно зарядки. Таким образом можно значительно восстановить ресурс АКБ, продлить срок его эксплуатации, а значит, и сэкономить деньги на покупке новой аккумуляторной батареи.
Содержание:
Что такое сульфатация и десульфатация
Перед тем как переходить к обсуждению вопроса о том, каким же образом сделать десульфатацию, необходимо разобраться в том, что же такое сульфатация и ее антипод десульфатация. Итак, сульфатация — процесс, в результате которого на рабочих поверхностях аккумуляторных пластин образуется сернокислый свинец. Это происходит в результате выполнения химических реакций при разряде батареи. Этот самый сульфат свинца образуется и в штатном режиме (при обычных циклах заряда/разряда), однако кристаллы, в виде которых он образуется, имеют небольшую форму и опять растворяются. А вот при нештатных ситуациях кристаллы сульфата свинца могут иметь большие размеры, что вредно для пластин, поскольку пораженные им участки больше не принимают участие в химической реакции по вырабатыванию электрической энергии. Вследствие этого емкость батареи падает, и аккумулятор постепенно приходит в негодность.
Это происходит в результате выполнения химических реакций при разряде батареи. Этот самый сульфат свинца образуется и в штатном режиме (при обычных циклах заряда/разряда), однако кристаллы, в виде которых он образуется, имеют небольшую форму и опять растворяются. А вот при нештатных ситуациях кристаллы сульфата свинца могут иметь большие размеры, что вредно для пластин, поскольку пораженные им участки больше не принимают участие в химической реакции по вырабатыванию электрической энергии. Вследствие этого емкость батареи падает, и аккумулятор постепенно приходит в негодность.
Причины, по которым возникает сульфатация:
- Глубокий разряд. Причем, для разных аккумуляторов достаточно от одного до трех глубоких циклов разряда для приведения батареи в полную негодность.
- Низкие температуры. В таких условиях батареи плохо заряжаются и снижают свою емкость, что становится причиной их разряда со всеми вытекающими последствиями.
- Высокие температуры.
 В жаркую пору процесс сульфатации также ускоряется. Особенно это опасно, если батарея разряжена, даже немного. При этом происходит закупоривание кристаллами поверхностей пластин.
В жаркую пору процесс сульфатации также ускоряется. Особенно это опасно, если батарея разряжена, даже немного. При этом происходит закупоривание кристаллами поверхностей пластин. - Добавление концентрированных электролита или кислоты. С помощью этих составов невозможно растопить появившиеся кристаллы, их добавление лишь усугубит ситуацию.
- Длительное хранение в недозаряженном состоянии. Дело в том, что кристаллы сульфата свинца удаляют в процессе заряда. А если этого самого процесса нет, то и сульфатация идет на пластинах медленно, но верно.
Теперь, когда физическая суть сульфатации ясна, можно переходить к обсуждению вопроса о том, что такое десульфатация, и как правильно ее выполнять. Как указывалось выше, десульфатация — процесс очищения пластин аккумуляторной батареи от имеющегося на их поверхности сульфата свинца. Выполняется это при помощи специального устройства для десульфатации автомобильных аккумуляторов.
Вместе с тем, что сульфат свинца забивает пластины, уменьшая их рабочую поверхность, но он еще и снижает плотность электролита приблизительно до 1,05…1,07 г/см³, хотя возможны различные варианты. Нормальная же плотность электролита в АКБ легкового автомобиля составляет 1,27 г/см³. Большее значение также вредно для батареи.
Нормальная же плотность электролита в АКБ легкового автомобиля составляет 1,27 г/см³. Большее значение также вредно для батареи.
Какие аккумуляторы можно восстанавливать
Прежде чем попытаться выполнить десульфатацию, необходимо убедиться, что конкретная аккумуляторная батарея еще подлежит восстановлению, поскольку есть аккумуляторы в таком состоянии, что об их восстановлении речи быть не может, например, если пластины батареи разрушены физически, а ее банки замыкают между собой. В этом случае участь АКБ предрешена и пролегает только через пункт приема изношенных аккумуляторов (утилизация).
Так, перед выполнением десульфатации АКБ зарядным устройством или другим методом, необходимо проверить, нет ли у аккумуляторной батареи физических повреждений, как внешних, так и внутренних. В частности, не роняли ли батарею, все ли банки целы, не коротят ли они между собой, не имеет корпус повреждений. В этом случае батарею лучше не восстанавливать, поскольку велика вероятность ее аварийной работы.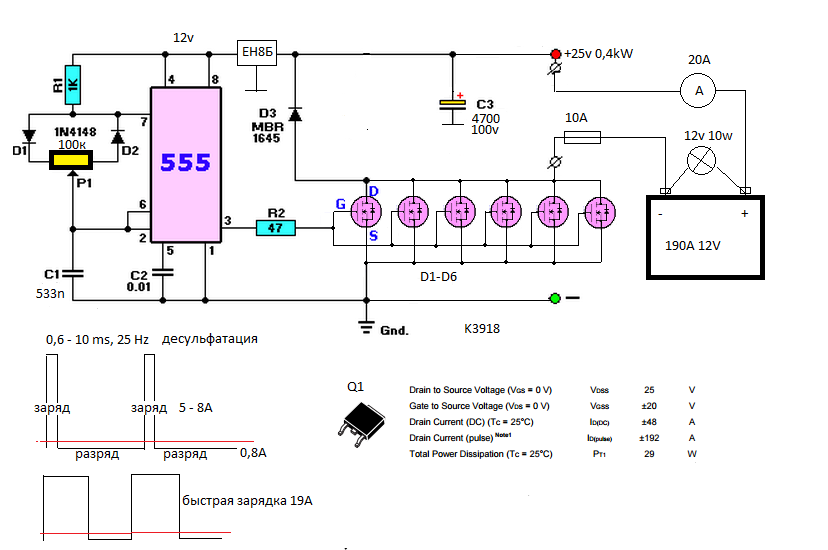
Ниже перечислены признаки аккумуляторов, пораженных сульфатацией. Если имеется налицо хотя бы один из перечисленных признаков, то имеет смысл попытаться восстановить работоспособность батареи.
- Скорость заряда/разряда. Если батарея очень быстро заряжается и также быстро разряжается.
- Скорость закипания в процессе заряжания. Если аккумулятор закипает очень быстро — один из признаков сульфатации.
- Скорость нагрева. Аналогично предыдущему пункту.
- Светлый налет на пластинах. Если после откручивания пробок на банках внутри на пластинах виден светлый налет, то это признак наличия на пластинах сульфата свинца.
- Значение емкости заряженного аккумулятора. Для выполнения этой процедуры необходимо дополнительное оборудование, и, к сожалению, есть оно не у всех. Однако если емкость измерить удалось, то минимальное критическое значение на полностью заряженном аккумуляторе составляет около 30…50% от указанной в его документации (на этикетке на его корпусе).
 Вообще, в соответствии с ГОСТ 959-2002 аккумулятор считается негодным при снижении его емкости до значения 40% емкости от изначально заявленной. Но можно попробовать восстановить батарею.
Вообще, в соответствии с ГОСТ 959-2002 аккумулятор считается негодным при снижении его емкости до значения 40% емкости от изначально заявленной. Но можно попробовать восстановить батарею.
Перечисленные случаи актуальны для аккумуляторных батарей, которые, что называется, «доживают свой век». Однако, если вашего АКБ не подпадает ни под одно из перечисленных описаний, значит, его можно попробова восстановить.
Вспомогательные методы выполнения десульфатации
Перед тем как переходить к рассмотрению выполнения чистки пластин с помощью специальных зарядных устройств можно попытаться выполнить десульфатацию «народными» методами. Правда, они не всем подходят, поэтому решение об их использовании пусть принимает для себя каждый автовладелец самостоятельно.
Физическая чистка
Провести десульфатацию можно даже с помощью обычной физической чистки свинцовых пластин аккумуляторной батареи. На просторах интернета порой можно встретить отчеты «народных умельцев», которые разрезают верхнюю часть корпуса аккумулятора, после чего извлекают оттуда пакеты с пластинами, после чего последние разбираются и физически очищаются от налета сульфата свинца. После такой чистки все собирается в корпус заново.
После такой чистки все собирается в корпус заново.
На самом деле процесс этот очень трудоемкий и рискованный, поскольку всегда существует риск критически повредить не только корпус аккумулятора, но и свинцовые пластины. Кроме этого, электролит/кислота вредны для кожного покрова человека и его дыхательных путей, поэтому эта процедура еще и небезопасна.
Использование специального средства
В частности, речь идет об известном средстве «Трилон Б». Это динатриевая соль этилендиаминтетрауксусной кислоты. Реализуется в виде белого порошка, при комнатной температуре его нужно растворять из расчета 100 граммов средства на литр воды. Его основное назначение — растворить нерастворимые соли металлов, сделав их тем самым жидкими. Нельзя хранить растворенный «Трилон Б» в металлических емкостях, поскольку он вступает с ними в химическую реакцию, результатом которой является их разъедание! Зачастую этот состав применяют в качестве промывочной жидкости для системы охлаждения автомобиля.
На самом деле отзывы, оставленные в интернете различными автовладельцами, которые пользовались средством «Трилон Б», весьма противоречивы. Одним он однозначно помог выполнить десульфатацию своими руками, а другим попросту «добил» аккумулятор. Поэтому решение об использовании данного средства всецело лежит на автовладельце. При этом необходимо понимать, что такое очищающее средство поможет относительно нестарому аккумулятору, у которого и степень сульфатации также невысока. Если же АКБ старый и степень сульфатации значительна — лучше не рисковать, и воспользоваться для восстановления батареи специальными зарядными устройствами.
Если же вы все же решитесь на использование очищающего средства «Трилон Б», то алгоритм его использования будет следующим:
- Заранее приготовить раствор «Трилона Б» в указанной выше пропорции.
- Удалить весь старый электролит со всех банок аккумулятора.
- Пока не высохла внутренняя поверхность банок залить во все банки упомянутый раствор.
 Закрыть банки крышками.
Закрыть банки крышками. - Оставить АКБ на 45…60 минут. При этом происходит растворение кристаллов сульфата свинца. Нередки случаи, когда процесс сопровождался кипением с выделением пара.
- По окончании указанного периода раствор средства необходимо слить из банок аккумулятора и промыть их внутренние поверхности водой. По возможности — несколько раз для закрепления результата.
- Залить в банки аккумулятора электролит с плотностью 1,27 г/см³.
После выполнения этих процедур (если повезет) работоспособность и емкость АКБ восстанавливаются. Однако, если аккумуляторная батарея была сильно изношена, то велика вероятность, что под воздействием данного средства разрушаться и сами свинцовые пластины аккумулятора. А если еще на дне банок были опавшие частички свинца, то при выполнении процедуры промывания они могут замкнуть между собой пластины батареи.
Десульфатация с помощью соды
Вместо описанного выше «Трилона Б» можно использовать раствор пищевой соды. Алгоритм аналогичен описанному выше. Так, необходимо слить электролит из банок аккумулятора. Далее нужно сделать раствор из расчета три чайные ложки соды на 100 миллилитров воды. Обратите внимание, что желательно использовать «мягкую» воду, то есть, с небольшим содержанием солей металлов в ней. Раствор нужно довести до кипения и в горячем состоянии залить в емкости аккумулятора. Оставить его в таком состоянии на 30…40 минут.
Алгоритм аналогичен описанному выше. Так, необходимо слить электролит из банок аккумулятора. Далее нужно сделать раствор из расчета три чайные ложки соды на 100 миллилитров воды. Обратите внимание, что желательно использовать «мягкую» воду, то есть, с небольшим содержанием солей металлов в ней. Раствор нужно довести до кипения и в горячем состоянии залить в емкости аккумулятора. Оставить его в таком состоянии на 30…40 минут.
После этого слить раствор из аккумулятора, и несколько раз промыть его емкости водой. Далее нужно залить новый электролит и зарядить его при помощи внешнего зарядного устройства до уровня полной зарядки.
Десульфатация зарядным устройством
Однако перечисленные выше методы десульфатации не очень распространены в силу их сложности или спорной эффективности. Поэтому для выполнения избавления от кристаллов сульфата свинца обычно пользуются специальными зарядными устройствами. Их особенность состоит в том, что они работают в режиме «заряд/разряд». На самом деле они стоят немалых денег, и за аналогичную сумму можно купить один, а то и два новых аккумулятора. Однако если выполнять данную процедуру на постоянной основе (например, на станции технического обслуживания), то данное устройство может принести пользу автовладельцам в виде очищенного и восстановленного аккумулятора, а владельцам автосервиса дополнительную выгоду.
Однако если выполнять данную процедуру на постоянной основе (например, на станции технического обслуживания), то данное устройство может принести пользу автовладельцам в виде очищенного и восстановленного аккумулятора, а владельцам автосервиса дополнительную выгоду.
В некоторых случаях автолюбители выполняют десульфатацию простым зарядником. Однако это необходимо учитывать, что в этом случае процесс очистки может растянуться на неделю и даже больше в «особо запущенных» случаях. Или попросту собирают схему устройства для десульфатации своими руками.
Десульфатация специальным зарядным устройством
Как указывалось выше, в продаже имеются специальные зарядные устройства, которые в определенном режиме способны выполнять десульфатацию аккумуляторных батарей. Их использование весьма простое, хотя и продолжительное, в частности, может занять несколько дней, в зависимости от степени нароста кристаллов сульфата свинца. Так, необходимо подключить заряжаемый аккумулятор к упомянутому зарядному устройству, учитывая полярность, а на самом приборе необходимо выбрать режим выполнения десульфатации.
Процесс работы прибора прост. На аккумуляторную батарею периодически подается напряжение, заряжая ее, а после этого выполняется ее разряд. Как правило, соотношение токов заряда/разряда выглядит как 10/1 (например, ток заряда составляет 2 Ампера, а ток разряда 0,2 Ампера). Обычно подобные зарядные устройства снабжены соответствующими индикаторами, на которых по окончании процесса выводится информация о том, на сколько была восстановлена аккумуляторная батарея.
Десульфатация АКБ зарядным устройством
Однако десульфатацию пластин АКБ можно выполнить и простым зарядным устройством, которое есть в наличии у большинства автовладельцев (оно должно быть с возможностью регулирования выдаваемых значений напряжения и силы тока). На самом деле существует достаточно много алгоритмов, действуя по которым можно выполнить упомянутый процесс.
Обратите внимание, что процедуру десульфатации в данном случае необходимо выполнять в хорошо проветриваемом помещении (и в случае, если аккумулятор обслуживаемый, и в случае если батарея является необслуживаемой), поскольку в воздух будет выделяться некоторое количество электролита, который вреден для человеческого организма, в частности, для дыхательной системы.
Ниже представлен алгоритм одного из самых простых и действенных процессов по десульфатации с помощью обычного зарядного устройства:
- Проверить уровень электролита (для обслуживаемых аккумуляторных батарей). Он должен полностью покрывать свинцовые пластины. Если его недостаточно, что в АКБ нужно добавить обычной дистиллированной воды (НЕЛЬЗЯ добавлять в него чистый электролит или же концентрат!).
- Аккумулятор должен быть разряжен (приблизительно до 8 Вольт выдаваемого напряжения, плотность электролита составляет около 1,07 г/см³).
- На зарядном устройстве необходимо установить значение зарядного напряжения в диапазоне 14…14,3 Вольта, а значение силы — 0,8…1 Ампер. В таком режиме зарядки аккумулятор необходимо оставить на 8 часов (на ночь).
- После такой процедуры плотность электролита не увеличиться, однако выдаваемое аккумулятором напряжение поднимется на пару Вольт.
- Просто оставить АКБ на сутки, не разряжая его дополнительно.
- Далее нужно опять поставить аккумулятор на 8 часов заряжаться с тем же напряжением, однако значение силы тока увеличить до 2…2,5 Ампер.

- После такой процедуры выдаваемое батареей напряжение увеличиться еще на пару Вольт, а плотность электролита начнет повышаться (приблизительно на 0,1 г/см³).
- Для начала десульфатации теперь необходимо разрядить аккумулятор. Для этого можно взять автомобильную лампу дальнего света или аналогичное по мощности другое устройство. Процесс разрядки должен происходить в течение 6…8 часов. При этом напряжение должно упасть до минимального значения в 9 Вольт. Этот показатель очень важен, и нужно периодически замерять его, чтобы напряжение не упало ниже указанного значения. Плотность электролита при этом будет составлять порядка 1,11…1,13 г/см³.
- После этого нужно повторить весь алгоритм сначала, то есть, вновь начать зарядку аккумуляторной батареи с уровня напряжения 14…14,3 Вольта, а ток — 0,8…1 Ампер. Потом он стоит сутки. Далее следует зарядка током около 2 Ампер. Когда выдаваемое АКБ напряжение будет находиться в пределах 12,7…12,8 Вольта, то плотность электролита должна возрасти приблизительно до 1,15…1,17 г/см³.
 Повторяя таким образом описанные циклы можно добиться плотности электролита 1,27 г/см³, которое является оптимальным значением.
Повторяя таким образом описанные циклы можно добиться плотности электролита 1,27 г/см³, которое является оптимальным значением.
Обратите внимание, что выполнение описанных процедур до получения искомого результата может занять от одной до двух недель, будьте к этому готовы. Данный алгоритм действий не раз показал себя на практике с положительной стороны, и с его помощью были восстановлены сотни аккумуляторов. Так, после выполнения процедуры десульфатации таким образом емкость батареи восстанавливается до 80…90%, чего вполне достаточно для запуска двигателя автомобиля даже в холодное время года.
Существует еще один аналогичный способ. Алгоритм его выполнения следующий:
- Открутить пробки аккумулятора и проконтролировать уровень электролита в нем, а также его плотность. Если она меньше 1,25…1,27 г/см³, то нужно выполнять десульфатацию. Аналогично, если уровень электролита малый — то нужно долить дистиллированной воды так, чтобы пластины были полностью покрыты электролитом.

- Установить значение напряжения на 14…14,3 Вольт, а ток — на 6…10% от емкости аккумулятора (например, если его емкость составляет 55 А·ч, то значение силы тока будет 3…5,5 Ампер).
- Оставить его в таком режиме зарядки на 1…2 часа. При этом стрелка амперметра будет сначала ползти вверх, показывая повышение силы тока, а потом замрет на определенном значении. При этом электролит начнет кипеть. Важно не пропустить этот момент!
- Понизить зарядный ток до значения 2 Ампера и дать аккумулятору еще дозарядиться в течение 8…12 часов.
- После этого оставить его на те же 8…12 часов для самостоятельной разрядки. Таким образом, на один цикл уходит около суток. Далее с помощью ареометра нужно измерить плотность электролита, она должна немного повыситься (приблизительно на 0,1 г/см³).
- Описанные циклы выполнения десульфатации необходимо провести от 4 до 6 раз в зависимости от «запущенности», то есть, степени сульфатации. Сигналом к окончанию выполнения данной процедуры будет момент, когда значение плотности электролита станет 1,25…1,27 г/см³.

Такой метод десульфатации аналогичен предыдущему, и с его помощью также были восстановлены многие аккумуляторы. Соответственно, он рекомендован к использованию всем автолюбителям.
Метод обратной зарядки
Сразу стоит оговориться, что использование этого метода весьма рискованно, поэтому ответственность за его использование пусть каждый автовладелец возьмет на себя лично. В интернете можно найти много противоречивых отзывов о нем. Однако если терять нечего и аккумулятор «не жалко», то можно попробовать восстановить его с помощью метода обратной зарядки.
Для работы вам понадобится мощный источник постоянного электрического тока. Идеальным будет сварочный аппарат (не инверторный, а старого образца), который может выдавать силу тока 80 Ампер и более, а напряжение — до 20 Вольт. Аккумулятор нужно отключить от электросистемы автомобиля и установить на ровную поверхность. На корпусе восстанавливаемого аккумулятора необходимо открутить пробки, и подключить его к источнику тока в обратном порядке, то есть, «минус» к «плюсу», и наоборот», «плюс» к «минусу».
Далее нужно включить это импровизированное зарядное устройство и оставить аккумулятор заряжаться приблизительно на 30 минут. При этом электролит обязательно закипит, однако это не страшно, поскольку в дальнейшем он подлежит замене. В результате таких действий будет выполнена десульфатация пластин аккумулятора, а также АКБ поменяет свою полярность навсегда! Будьте к этому готовы и помните об этом!
Далее закипевший электролит необходимо слить с аккумулятора, и промыть его банки чистой водой. Потом нужно залить туда новый электролит и выполнить полный цикл заряда с помощью обыкновенного стационарного зарядного устройства. Ток зарядки и продолжительность заряжания зависят от типа аккумулятора, а также его емкости (значение тока обычно составляет 10% от значения емкости батареи).
Профилактика сульфатации
Есть несколько простых правил, следуя которым можно добиться профилактики появления такого вредного явления как сульфатация. Первое и основное требование — периодически подзаряжать аккумулятор с помощью зарядного устройства. Особенно это актуально для зимнего периода, когда температура воздуха снижается ниже ноля по Цельсию. Летом можно просто подзаряжать его от генератора, выполняя хотя бы раз в неделю поездки длительностью минимум 30…40 минут.
Особенно это актуально для зимнего периода, когда температура воздуха снижается ниже ноля по Цельсию. Летом можно просто подзаряжать его от генератора, выполняя хотя бы раз в неделю поездки длительностью минимум 30…40 минут.
Следующее правило — регулярно контролируйте уровень электролита в аккумуляторе. Это касается обслуживаемых АКБ. При падении его уровня в него необходимо доливать дистиллированную воду до уровня, когда свинцовые пластины будут полностью покрыты электролитом, и делать еще небольшой запас (для вибрации и поворотов автомобиля в движении). Что касается необслуживаемых аккумуляторов, то там нужно всегда придерживаться алгоритма заряжания (зависит от типа АКБ — гелевые, кальциевые, гибридные и так далее, поскольку одни из них не любят перезаряда, другие — глубокой разрядки). Соответственно, нельзя допускать, чтобы электролит в них выкипел или его уровень упал до критического значения.
Сульфатацию можно предупредить еще на стадии покупки аккумуляторной батареи. В частности, необходимо покупать аккумулятор с емкостью, немного большей, чем она необходима для конкретного автомобиля. Особенно это актуально в двух случаях. Первый — для дизельных двигателей. Второй — когда у машины есть много дополнительного электрооборудования, берущего большое количество электроэнергии (например, мощная аудиосистема, дополнительные осветительные приборы и так далее). В последнем случае необходимо провести дополнительные расчеты касательно того, какую именно мощность будет брать дополнительная аппаратура, и на основании полученных значений покупать новый аккумулятор.
В частности, необходимо покупать аккумулятор с емкостью, немного большей, чем она необходима для конкретного автомобиля. Особенно это актуально в двух случаях. Первый — для дизельных двигателей. Второй — когда у машины есть много дополнительного электрооборудования, берущего большое количество электроэнергии (например, мощная аудиосистема, дополнительные осветительные приборы и так далее). В последнем случае необходимо провести дополнительные расчеты касательно того, какую именно мощность будет брать дополнительная аппаратура, и на основании полученных значений покупать новый аккумулятор.
Однако установка более емкого аккумулятора имеет и свои недостатки. В частности, если генератор не рассчитан на повышенный ток (а в большинстве случаев так и есть), то при езде на машине в городском цикле необходимо периодически дополнительно подзаряжать аккумулятор с помощью внешнего зарядного устройства. Если же машина больше используется для езды на большие расстояния, то вполне достаточно следить за исправностью регулятора напряжения.
Большинство аккумуляторов (разных типов) боятся так называемого глубокого разряда. Некоторым из них достаточно от одного до трех таких ситуаций, чтобы не только получить глубокую сульфатацию, но и полностью выйти из строя. Поэтому не нужно эксплуатировать разряженные батареи. А если АКБ долго стоял на хранении, то перед использованием его нужно обязательно зарядить с помощью внешнего зарядного устройства.
Также необходимо помнить, что каждый аккумулятор имеет свой срок эксплуатации, который может колебаться от 1…2 до 7…9 лет в зависимости от их типа, производителя, условий эксплуатации и так далее. И под конец этого срока появление сульфатации — достаточно распространенное явление, и если от нее не удалось избавиться, значит, батарею пора утилизировать, то есть, сдать в специально предназначенные для этого пункты.
Просто так выбрасывать аккумуляторные батареи всех типов категорически запрещается, поскольку они содержат вредные для экологии вещества!
Заключение
Процесс выполнения десульфатации несложный, и с ним может справиться даже начинающий автолюбитель. Для этого необязательно использовать автоматические зарядные устройства, специально предназначенные для этого. Такие приборы имеет смысл приобретать для специальных автосервисов, где восстановлением аккумуляторов мастера занимаются на постоянной основе. Это обусловлено их высокой ценой. Рядовой же автолюбитель может самостоятельно избавиться от кристаллов сульфата свинца при помощи обыкновенной аккумуляторной зарядки, однако выполняя описанные выше алгоритмы.
Для этого необязательно использовать автоматические зарядные устройства, специально предназначенные для этого. Такие приборы имеет смысл приобретать для специальных автосервисов, где восстановлением аккумуляторов мастера занимаются на постоянной основе. Это обусловлено их высокой ценой. Рядовой же автолюбитель может самостоятельно избавиться от кристаллов сульфата свинца при помощи обыкновенной аккумуляторной зарядки, однако выполняя описанные выше алгоритмы.
И помните, что не все аккумуляторы подлежат восстановлению. Это зависит от их состояния, а также срока и условий эксплуатации. Еще, полезно выполнять нехитрые рекомендации, помогающие не только предотвратить появление сульфатации, но и в целом продлить срок службы аккумуляторной батареи.
Спрашивайте в комментариях. Ответим обязательно!
азбука импульсного заряда / Хабр
Тема импульсного заряда свинцовых аккумуляторов (СА) и состоящих из них кислотных батарей (АКБ) в последние годы набирает актуальность. В продаже появляются инновационные зарядные устройства, публикуются статьи, на специализированных форумах идёт активная исследовательская работа с жаркими спорами на сотни страниц.
В продаже появляются инновационные зарядные устройства, публикуются статьи, на специализированных форумах идёт активная исследовательская работа с жаркими спорами на сотни страниц.
О чём спорим?
Важнейшими эксплуатационными характеристиками АКБ являются ёмкость, токоотдача, срок службы, надёжность. Новые методы заряда и реализующие их устройства призваны служить цели повышения этих характеристик. В чём суть таких методов, и почему они актуализируются именно сейчас, мы и рассмотрим.
В чём сложность?
СА — сложная физико-химическая система, в которой происходят, как минимум, десятки известных процессов, испытывающих взаимовлияние и влияние внешних факторов, прежде всего, электрического воздействия и температуры. Особую сложность добавляет то, что кинетика, то есть динамика скорости развития и распространения, у процессов разная.
На протяжении десятилетий исследователи изучали эти процессы и вырабатывали способы взаимодействия с ними, при помощи имевшегося в их распоряжении оборудования.
Почему этого не придумали раньше?
Но техника и техническая культура не стоят на месте. Появились и стали доступными электронные вычислительные машины (ЭВМ), причём в виде не только персональных компьютеров, но и компактных, недорогих, экономичных микроконтроллеров (МК), представляющих собой микроЭВМ с развитой периферией, выполненную на одном кристалле кремния размером меньше тетрадной клетки, и при этом способную выполнять миллионы операций в секунду. Аналоговая микроэлектроника также не отставала в развитии, предоставив всем желающим компоненты с невиданными ранее характеристиками точности, стабильности, диапазона применений.
Итак, сегодня самое время вернуться к старому доброму изобретению Гастона Планте, вот уже много десятилетий несущему верную службу во множестве отраслей бытовой и профессиональной жизни, — свинцовому аккумулятору, — на предмет поиска более адекватных методов его эксплуатации с их реализацией на современной элементной базе.
Теория двойной сульфатации
Аккумулятор, он же вторичный химический источник тока (ХИТ), осуществляет накопление электрической энергии путём обратимого преобразования химического состава электродов (пластин), для дальнейшего полезного использования. В наипростейшем грубом приближении, называемом теорией двойной сульфатации, процессы заряда и разряда СА могут быть выражены следующей формулой.
PbO2 + Pb + 2H2SO4 = PbSO4 + PbSO4 + H2O
Реакция разряда происходит слева направо, заряда — справа налево. Активная масса (АМ) заряженной плюсовой (положительной) пластины, — ПАМ, — образована оксидом свинца, минусовой (отрицательной), — ОАМ, — губчатым свинцом. Как видим, и ПАМ, и ОАМ при разряде преобразуются в сульфат свинца, при образовании которого расходуется серная кислота и образуется вода.
Концентрация серной кислоты, а соответственно, плотность электролита, снижается при разряде и повышается при заряде. Это азбука свинцовых аккумуляторов. Но далее мы увидим, что одних букв азбуки недостаточно, их ещё надо связать в слова, предложения и текст, годный в качестве руководства к действию.
Это азбука свинцовых аккумуляторов. Но далее мы увидим, что одних букв азбуки недостаточно, их ещё надо связать в слова, предложения и текст, годный в качестве руководства к действию.
Упрощённые химические формулы носят статистический характер и не учитывают множества последовательных и параллельных переходных процессов, а также модификаций участвующих в них веществ, потому должны рассматриваться лишь как вводные данные, и ни в коем случае не как исчерпывающие и закрывающие вопрос ответы.
Структуры и функции
В отличие от школьного экзамена и конкурса эрудитов, на практике необходимы действующие и доступные к повторению способы (функции) и структуры (устройства) для их реализации. Это означает необходимость определиться, (и корректировать по ходу развития темы), с приоритетами: что, в данном приложении, мы учитываем прежде всего, а чем, опять же в данном приложении, можно пренебречь. Иначе получится презентация либо энциклопедия, но никак не прикладная, реализующая функцию структура. Презентации и энциклопедии тоже нужны, но это структуры для других функций.
Презентации и энциклопедии тоже нужны, но это структуры для других функций.
Эта страшная сульфатация
Из рассмотрения самой упрощённой, азбучной формулы, мы уже видим, что сульфатация, да ещё и двойная, — отнюдь не побочный эффект, а самая основа процесса разряда СА, будь то саморазряд или полезный разряд, ради которого АКБ и строится. Каким образом сульфатация становится патологической и губит аккумулятор, и как этого избежать, наш текущий вопрос.
Поляризующее воздействие и зарядный ток
Сульфат свинца — труднорастворимый диэлектрик. Для его растворения, точнее, преобразования в активную массу пластин, необходимо приложить поляризующее воздействие, то есть разность потенциалов, она же электрическое напряжение, а также затратить электрический заряд для его усвоения в химической форме, т.е. пропустить зарядный ток в течение какого-то времени. Таким образом, электрическая энергия будет запасена в химической форме, и совершится заряд СА.
Упрощённо, напряжение (вольты), помноженное на ток (амперы), даёт мощность (вольт*амперы, ватты), ток на время — заряд (кулоны или ампер*часы, по 3600 кулон каждый), мощность на время или заряд на напряжение — энергию (джоули или ватт*часы, также равные 3. 6 килоджоуля, т.к. в часе 60 минут по 60 секунд).
6 килоджоуля, т.к. в часе 60 минут по 60 секунд).
Что такое зарядное устройство
Поляризующее воздействие и зарядный ток образуют зарядное воздействие на АКБ, функция которого осуществляется структурой, называемой зарядным устройством (ЗУ), или встраиваемым контроллером заряда, или эксплуатационным контроллером (драйвером).
Казалось бы, чего проще: приложить напряжение и создать ток. Такое любой источник питания может. Но мы воздействуем на СА — сложную структуру, и для поддержания её полезных функций должны взаимодействовать адекватно, с обратной связью. Иначе воздействие будет разрушать структуру, а её функции деградировать, и это будет нехорошо.
Проводимость-Структура-Прочность
Ёмкость, токоотдача, срок службы, надёжность, с которых мы начинали нашу беседу, являются функциями АКБ. Выполнять функции призвана структура. Для токотдачи нужны высокая проводимость активной массы и токоведущих частей конструкции, причём эта проводимость должна быть сбалансирована для равномерного распределения токов и мощностей, а также контакт АМ с электролитом, позволяющий отдавать максимум полезной ёмкости при заданном токе.
Формовка
Формовкой называется процесс и результат (состояние) подготовки электродов к приёму зарядного и отдаче разрядного тока, соответственно с накоплением и возвращением полезной энергии. Так как накопление и отдача энергии связаны с физико-химическими превращениями активной массы, напрашивается очевидный вывод, что формовка вторичного ХИТ, в отличие от первичного, происходит не единовременно при его производстве и вводе в эксплуатацию, а при каждом заряде.
Сульфаты свинца
Как уже упрощённо говорилось, сульфат свинца — диэлектрик, то есть, имеет высокое удельное сопротивление и низкую электропроводность. При саморазряде и полезном разряде он образуется на поверхности активной массы, изолируя её участки и электрически, и механически, препятствуя доступу к ней электролита. Таким образом он вредит упомянутым критериям проводимости и структуры СА, снижая и полезную ёмкость (энергию), и способность принимать и отдавать ток (мощность).
Таким образом он вредит упомянутым критериям проводимости и структуры СА, снижая и полезную ёмкость (энергию), и способность принимать и отдавать ток (мощность).
Найти общий язык с заклятым другом АКБ сульфатом представляется возможность двумя известными способами. Во-первых, снять его с активной массы возможно путём перенапряжения, или даже электрического пробоя. Последним занимаются энтузиасты экстремальной десульфатации, и эта тема, как и сомнительные, по мнению многих коллег, способы грубого разрушения сульфатной корки сверхтоками, а также химической промывки, выходят за рамки нашей беседы.
Напряжение зарядного воздействия: выше — лучше?
Пока просто отметим, что развивать повышенное напряжение между пластинами СА при заряде (обслуживании) весьма полезно для разрушения сульфата, причём при этом, (если избежать нежелательных побочных эффектов, о них ниже), он не выпадает в осадок (шлам), но возвращает свой, грубо говоря, сульфат-ион в серную кислоту электролита, а свинец, в виде металла или оксида, пластинам, то есть, совершается полезный заряд.
Зарядный ток: больше — лучше??
Во-вторых, оксиды свинца на положительной пластине могут образовываться при заряде АКБ в разных модификациях, из которых известны и важны для нас две, называемые альфа и бета. Альфа-оксид имеет меньшую удельную поверхность, а также изоморфную с сульфатом кристаллическую решётку, что при разряде ведёт к образованию плотного слоя сульфата. Всё это минусы для структуры и проводимости, по сравнению с бета-оксидом. Правда, альфа-модификация механически более прочна, но практика показывает это несущественным.
Итак, желательно заряжать СА таким образом, чтобы способствовать преимущественному формированию бета-оксида свинца, с более развитой поверхностью и отсутствием склонности обрастать плотным слоем сульфата. А способствует этому более высокая плотность зарядного тока.
Отметим: зарядные устройства, значительно снижающие ток к концу заряда, (а таковых большинство), и тем более «подзарядники», компенсирующие саморазряд малым током, формируют альфа-оксид, снижая эксплуатационные характеристики батареи.
Электролит и электролиз
Но мы пока начали разбираться только с пластинами, упомянув о важнейшей составляющей СА, — электролите, — лишь вскользь. Электролит свинцового аккумулятора представляет собой раствор серной кислоты в дистиллированной воде, причём и кислота, и вода, как мы видели в уравнении двойной сульфатации, расходуются и образуются при заряде и разряде. Согласитесь, эта простая уравновешенная система вызывает восхищение. Но только пока она уравновешена.
Если разность потенциалов между пластинами достигнет так называемого водородного перенапряжения, в банке, т.е. ячейке АКБ, начнётся процесс электролиза воды, её разложения на кислород и водород. Этот нехитрый и почти экологически чистый процесс для СА, мягко говоря, вреден крайне и многогранно. Рассмотрим, почему.
Во-первых, это потеря воды, которую в обслуживаемые наливные аккумуляторы приходится доливать, а в так называемые необслуживаемые (maintenance free, MF), особенно гелевые (с загущённым электролитом) и AGM (с абсорбирующими сепараторами из стекловолокна) это сделать несколько проблематично.
Разработчики СА прилагают немало усилий для рекомбинации кислорода и водорода обратно в воду и её возвращения в электролит. Эта функция возложена на структуры в виде клапанов в герметичных, точнее, герметизированных клапанами VRLA, загущение электролита силикагелем в GEL батареях, впитывающие стекломаты AGM, а также специальные пробки-рекуператоры, характерные для стационарных решений. Способность возвращать воду у всех этих решений, кроме, пожалуй, громоздких и недешёвых спецпробок, сильно ограничена, и избыточное давление газов, если оно образовалось, просто стравливается в атмосферу.
Во-вторых, что это за газы? Кислород, в присутствии серной кислоты агрессивно и с выделением теплоты разъедающий свинец, причём не только отрицательных пластин, но и несущих и токоведущих элементов конструкции, и водород, экологичный, но в смеси с кислородом воздуха крайне пожаровзрывоопасный. А при потере воды, к пластинам открывается доступ ещё и атмосферного кислорода.
Если газовыделение из АКБ идёт полным ходом, («кипение» электролита), экологичным данный процесс уже не назвать, так как происходит разбрызгивание и распыление капель серной кислоты, да не чистой, а с пылинками шлама, содержащими, как легко догадаться, соединения свинца, сурьмы и других материалов, употребляемых в качестве присадок при производстве СА.
Как деды аккумуляторы кипятили
«Кипение» перемешивает электролит и разрушает, в частности, слой сульфата на поверхности электродов. Потому в старые дикие времена оно было нормой эксплуатации АКБ. Изношенный верхний слой активной массы отрывался пузырьками газов и оседал в шлам, для которого внизу банок было предусмотрено место, обнажались для работы свежие слои.
Критерии долговечности, экономичности и экологичности при этом страдали, зато аккумуляторы отрабатывали нормированные для них по тем временам характеристики, будучи заряжаемыми и обслуживаемыми простыми средствами. Трансформатор с диодами, хорошо, если есть амперметр и реостат или переключатель обмоток, ареометр с грушей, трубка-уровнемер, воронка да две бутыли, с раствором кислоты и дистиллированной водой, — вот и весь дедовский инструментарий. Вольтметр, нагрузочная вилка — уже роскошь. А в аккумуляторных мастерских батареи разбирали, из исправных пластин сваривали блоки, и собирали вновь.
Плотность электролита: чем выше, тем лучше???
Раз уж упомянули ареометр, или денсиметр, (один или несколько калиброванных поплавков, простейший из них — индикаторный глазок в некоторых АКБ), самое время поговорить о плотности электролита, состоящего, не забываем, из аккумуляторной кислоты и воды. Серная кислота тяжелее воды, потому плотность их смеси тем выше, чем больше её концентрация.
Серная кислота тяжелее воды, потому плотность их смеси тем выше, чем больше её концентрация.
Согласно уже знакомому нам упрощённому уравнению Гладстона и Трайба, по концентрации кислоты, т.е. плотности электролита, можно судить о степени заряженности аккумулятора. Но это не исчерпывающий критерий, ведь потери и доливки воды и кислоты точно так же влияют на плотность, как и процессы заряда-разряда.
Существует формула, связывающая напряжение разомкнутой цепи (НРЦ), оно же электродвижущая сила (ЭДС) без нагрузки, с соотношением количества кислоты и воды в электролите, а также температурой. Формула эта тоже упрощённая, так как не учитывает других свойств СА, части которых мы коснёмся ниже. И приводить её здесь не будем, она есть в книгах, а нашу беседу только перегрузит.
Чем выше концентрация кислоты, а следовательно, ЭДС, тем большую полезную работу способен произвести каждый кулон и ватт-час, ампер-час, отдаваемый батареей, то есть, растёт энергоёмкость. Также, избыток кислоты в электролите повышает его стойкость к замерзанию, потому в автомобилях на зиму принято устанавливать повышенные плотность электролита и напряжение заряда.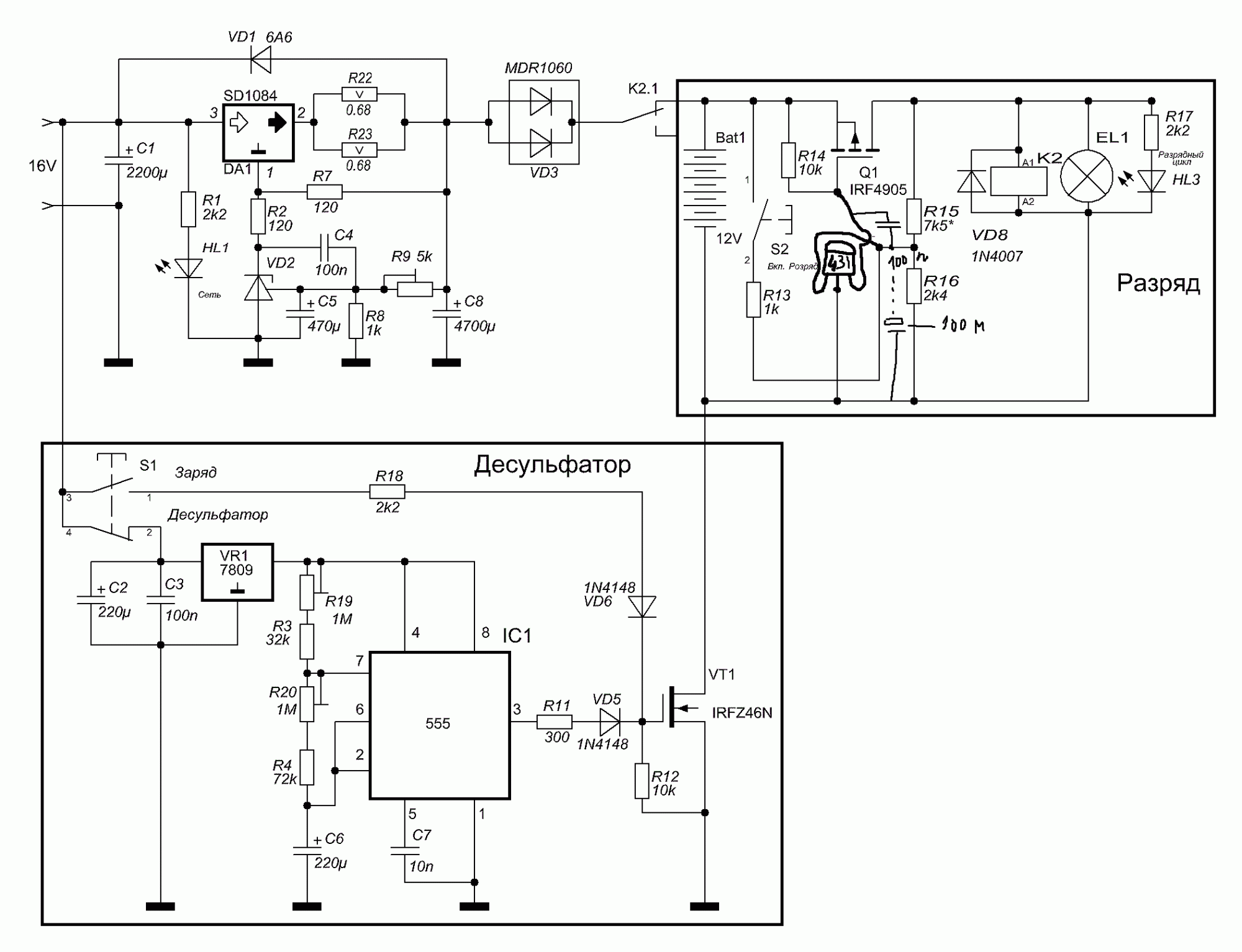
При понижении температуры полезная ёмкость АКБ снижается, при повышении — растёт. Это учитывается при зимних пусках двигателя и серьёзно ограничивает эксплуатацию транспортных средств со свинцовыми тяговыми батареями в холодное время года, ведь в автомобиле с ДВС, как только он заведён, начинает работать генератор, компенсируя разряд, а тяговой АКБ придётся отдавать ток на протяжении всего пути.
Тяговый и буферный режимы
Коль заговорили, продолжим. Режимы работы АКБ подразделяются на тяговый, или циклический (cycle use), когда происходит разряд значительной части ёмкости средним (относительно последней) по величине током, после чего следует заряд, и буферный (standby), когда разряды относительно редки, (резервные батареи бесперебойного питания), и производится тем или иным образом компенсация саморазряда.
К буферному можно отнести и стартерный режим, когда за кратковременным неглубоким разрядом высоким током следует заряд в течение всей поездки автомобиля или мотоцикла. Близок к стартерному режим 15-минутного разряда резервных аккумуляторов компактных источников бесперебойного питания, служащих для безопасного завершения работы с сохранением данных, в отличие от тягового режима АКБ в мощных фонарях и ИБП для поддержания автоматики, связи, медицинского оборудования и др. в течение нескольких часов.
Близок к стартерному режим 15-минутного разряда резервных аккумуляторов компактных источников бесперебойного питания, служащих для безопасного завершения работы с сохранением данных, в отличие от тягового режима АКБ в мощных фонарях и ИБП для поддержания автоматики, связи, медицинского оборудования и др. в течение нескольких часов.
Характерный отличительный признак АКБ, специально предназначенных для 15-минутного разряда, — обозначение мощности в ваттах, отдаваемой одной банкой в этом режиме, маркировкой на корпусе и даже в артикуле батареи. Например, HR12-34W означает, что маленькая батарея «7-амперного» форм-фактора способна отдавать 6*34 = 204 ватта в течение четверти часа! На первый взгляд, это «всего-навсего» 4,25 ампер*часа, но знающих разрядные кривые СА и их природу такая характеристика порадует основательно, и весьма.
Накопители энергии в ветряной, и особенно солнечной энергетике, работают в тяговом, циклическом режиме. Когда энергия поступает, надо её по максимуму усвоить, чтобы затем отдавать, пока солнечные батареи и ветрогенераторы не дают ток. Габариты и масса стационарных накопителей, в отличие от транспортных, не критичны, потому стараются обеспечить по возможности избыточную их ёмкость и неглубокие циклы. Ведь чем глубже разряд, тем выше износ АКБ.
Габариты и масса стационарных накопителей, в отличие от транспортных, не критичны, потому стараются обеспечить по возможности избыточную их ёмкость и неглубокие циклы. Ведь чем глубже разряд, тем выше износ АКБ.
Вред перезаряда и повышенной концентрации кислоты
Если при повышенных температуре, ЭДС и концентрации кислоты аккумулятор выдаёт больше энергии и мощности, почему же его берегут, (должны, по крайней мере), от перегрева, и при наступлении тепла вручную или автоматически корректируют напряжение генератора и плотность электролита вниз?
Дело в том, что повышенная химическая активность кислоты в избыточной концентрации действует на активную массу, несущие и токоведущие части СА разрушительно. Способствует этому и высокая температура. Повышаются саморазряд, сульфатация, коррозия, могущие происходить с выделением тепла и газов.
Тот же самый эффект случается при избыточных напряжении, токе, мощности, энергии зарядного воздействия. Все те лишние кулоны, киловатт-часы и рубли на оплату последних, что не усваиваются активной массой, идут на электролиз воды, нагрев и разрушение батареи, причём в любом случае, хотя и с разной скоростью.
Маленький ток «подзарядника» будет подтачивать вашу АКБ исподтишка, вы даже не заметите нагрева и газовыделения, настолько слабого, что с ним, возможно, справится штатная рекомбинация. Но формовка активной массы из свинца тоководов и несущих конструкций происходить будет. И в результате, — нет, полезная ёмкость не возрастёт, зато рассыпется внутренняя структура.
Снимали когда-нибудь крышки и колпачки клапанов с отказавшей АКБ компьютерного ИБП? Видели, во что превратились токоведущие шины? Это оно самое.
Немного техники безопасности
Серная кислота едкая, водород взрывоопасен. Это надо иметь в виду при эксплуатации СА. Но самую большую опасность представляет активная масса, как «настоящая», так и «паразитная», наработанная коррозией держателей и тоководов. АМ обладает развитой поверхностью и по праву зовётся активной. Даже небольшая её крупица является системным ядом и нейротоксином, способным вызывать увечья (свинцовые параличи), потому категорически запрещается прикасаться к внутренностям АКБ голыми руками, допускать попадания на кожу, слизистые оболочки, внутрь.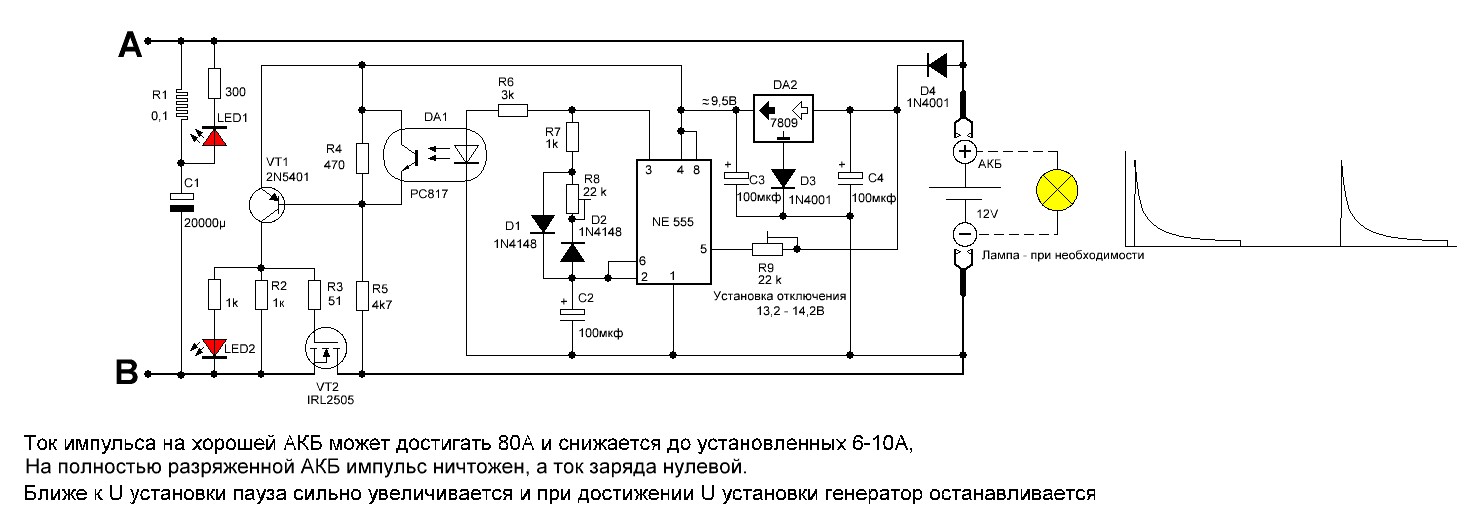 При попадании немедленно смыть большим количеством воды.
При попадании немедленно смыть большим количеством воды.
Теперь знаем об аккумуляторах всё?
Итак, слишком низкие и слишком высокие напряжения, токи, концентрации электролита, температуры для АКБ вредны. Это значит, что для циклического, буферного, стартерного и т.д. режимов работы можно определить оптимальные напряжения, токи, формализованные законы термокомпенсации, реализовать их в зарядном устройстве, реле-регуляторе, контроллере заряда, и мы тем самым повысим ёмкость, токотдачу, срок службы?
Да, значит. Но опять упрощённо. Данные о термокомпенсированных параметрах заряда производители размещают в справочных листках и на корпусах АКБ. Их соблюдение в эксплуатационных контроллерах значительно улучшает практику применения СА, но не является идеалом. Можно, и нужно совершенствоваться дальше.
Взглянем на целостную картину
Подытожим изученное. СА представляет собой два блока пластин с активной массой, имеющей развитую поверхность. Пластины окружены электролитом, — водным раствором серной кислоты, — путём погружения в жидкий раствор, разделения пропитанных последним сепараторами из стекловолокна, или помещения в желеобразный, загущённый силикагелем электролит.
Заряженная ПАМ образована оксидом свинца, ОАМ — свинцом. При разряде та и другая превращаются в диэлектрический и труднорастворимый сульфат свинца с затратой серной кислоты и образованием воды, при заряде — наоборот, с затратой воды и образованием кислоты. Свинец электродов, его оксид и сульфат не переходят в раствор, (по упрощённой теории; на самом деле образуют ионы, которые должны тут же осаждаться в АМ), зато из раствора берутся, и возвращаются ему ионы, а именно гидросульфат-ион и протон (ядро атома водорода).
И вот здесь начинается самое интересное. Ионы для токообразующих реакций должны поступать из электролита в активную массу, активность которой, как помним, обеспечивается структурой с развитой поверхностью, т.е. губкой. AGM-сепаратор — ещё одна впитывающая губка, служащая многим целям, в частности, повышению рекомбинации воды, а гель — вязкая субстанция, перемещения вещества в которой затруднены.
Итак, мы имеем смачивание и капиллярный эффект, как минимум, в двух губках АМ, к которому может добавляться влияние сепаратора и геля. В результате, движения вещества в банке аккумулятора замедлены, и для осуществления заряда и разряда, особенно глубинных слоёв АМ, требуется время, причём разное, зависящее от текущего состояния активной массы и электролита.
В результате, движения вещества в банке аккумулятора замедлены, и для осуществления заряда и разряда, особенно глубинных слоёв АМ, требуется время, причём разное, зависящее от текущего состояния активной массы и электролита.
И это состояние отнюдь не исчерпывается НРЦ, плотностью и температурой! При работе СА электролит расслаивается, различные ионы движутся в электрическом поле с разной скоростью (электроосмос), встречают преграды структуры, а серная кислота ещё и тяжелее воды, за счёт чего стремится под действием силы тяжести опуститься вниз, вытеснив воду вверх!!! В случае геля и AGM этому мешает структура, а вот наливные АКБ страдают гравитационным градиентом плотности электролита в полной мере.
Где в розетке плюс и минус?
Итак, существует ли такое значение тока или напряжения, которое, будучи рассчитанным исходя из НРЦ, плотности электролита, (плотности где?! она неравномерна!), температуры, и приложенным к клеммам СА, обеспечит полный заряд, компенсацию саморазряда и десульфатацию, при этом избежав и медленно убийственного сульфатирующего недозаряда, и электролиза воды, и коррозии структуры?!
Нет, НРЦ, (хоть даже с таблицей замеров ЭДС под разными нагрузками), температура, (которая тоже очень даже бывает неравномерной в массивной неоднородной АКБ), и плотность электролита, хоть «средняя по больнице», хоть измеренная сверху банки или у дна, или обе разом, в статической совокупности не дают исчерпывающих данных о кинетике, динамике химических реакций в банке СА и всей батарее.
Они пригодятся для оценки состояния аккумулятора и принятия решения о его дальнейшем обслуживании, но оптимальных значений тока и напряжения, чтобы выставить на регуляторах зарядного устройства, не дадут. Потому что эти значения меняются в ходе взаимодействующих процессов, происходящих с разными скоростями!
Зато динамика изменения тока и напряжения может рассказать о ходе токообразующих реакций всё. Точнее, всё нужное для управления зарядным током и поляризующим воздействием. Если, конечно, уметь обрабатывать эти данные в реальном времени, (то есть, с нормированными задержками). Для этого и понадобится микроэлектроника, и скорее всего, даже вычислительная машина. К счастью, она бывает, как помним, размером с тетрадную клетку.
Вопрос о том, какое именно электрическое воздействие является потребностью АКБ в данный момент, сродни вопросу, где плюс и минус в розетке. Человек на него ответить не может: пока будет говорить, плюс и минус сменят друг друга 50 раз в секунду. Но для электронного прибора такое быстродействие пара пустяков. И мы можем точно определить фазы напряжения и тока, с нужной привязкой ко времени. Конечно, в СА мы увидим нечто посложней синусоид, сдвинутых друг относительно друга. И увидим уже скоро.
Но для электронного прибора такое быстродействие пара пустяков. И мы можем точно определить фазы напряжения и тока, с нужной привязкой ко времени. Конечно, в СА мы увидим нечто посложней синусоид, сдвинутых друг относительно друга. И увидим уже скоро.
Повторенье — мать ученья. Это упрощёная формулировка третьего закона диалектики, частичного возврата к старому на новом уровне, и мы ею снова воспользуемся.
Имеем две губки активных масс, между которых жидкость, гель или ещё одна губка. Нам нужно, чтобы необходимые ионы для токообразующих реакций достигли каждого слоя губок, причём эти слои частично закупорены сульфатами, требующими перенапряжения для диссоциации, и без этого перенапряжения мы потеряем и ёмкость, и токоотдачу, и долговечность, вследствие хронического недозаряда, ведущего к прогрессирующей сульфатации.
Однако перенапряжение чревато перезарядом с электролизом и коррозией. Как общепринятый в седой древности дозаряд «кипячением» с терморазгоном и полезным, но слишком дорогой ценой, перемешиванием электролита, так и сменившее его снижение тока в конце заряда, смягчающее, но не исключающее вредные побочные явления, и вдобавок ведущее к замазыванию ПАМ орторомбическим оксидом свинца, нельзя считать решениями, адекватными в полной мере.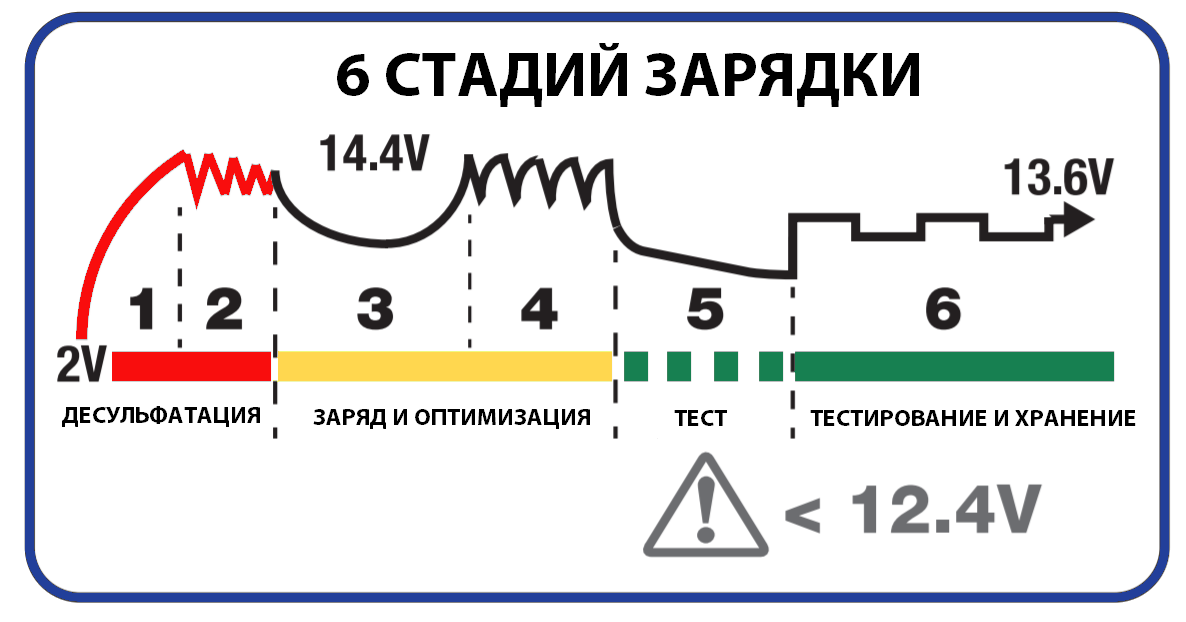
Чем заряжается аккумулятор?
И наконец, после первого знакомства с химией и физикой СА, настаёт время посмотреть на его электрические характеристики, а именно, отклик ХИТ на зарядное воздействие. Только сначала повторим характеристики самого этого воздействия: напряжение, ток, время, заряд, мощность, энергия.
Так как ХИТ имеет электродвижущую силу, то есть создаёт (сам устанавливает) разность потенциалов, естественно предположить, что зарядное воздействие осуществляется током. Действительно, при приложении тока от зарядного источника к клеммам СА, напряжение на последнем начинает расти, (предполагаем, что источник способен развить нужную ЭДС, на то он и зарядный), что и является критерием оценки хода заряда.
В начале пропускания тока, разность потенциалов клемм резко подскакивает на величину падения этого тока на внутреннем сопротивлении СА или батареи. По высоте получающейся ступеньки, зная силу тока, можно вычислить внутреннее сопротивление, что очевидно, и используется в экспресс-тестах. На этом «просто вольтамперная характеристика» заканчивается, и начинается сложный процесс изменения напряжения во времени. Силу тока будем считать постоянной, стабилизированной средствами источника.
На этом «просто вольтамперная характеристика» заканчивается, и начинается сложный процесс изменения напряжения во времени. Силу тока будем считать постоянной, стабилизированной средствами источника.
Дальше на ленте самописца, экране осциллографа с медленной развёрткой или диаграмме с логгера мы увидим суперпозицию (наложение) нескольких откликов на зарядное воздействие, главных из которых два. Очень медленная экспонента собственно полезного заряда АМ, состоящая из суперпозиции разных слоёв, и ещё одна экспонента, гораздо более быстрая, напоминающая заряд конденсатора.
Два подхода к двойному слою
Это и есть конденсатор, точнее, ионистор, иногда называемый паразитным, а чаще ёмкостью двойного электрического слоя. Ёмкость эта сложна, так как в её образовании участвует расслоение электролита, нами уже упоминавшееся. Но для первого приближения к пониманию перспективных путей оптимизации эксплуатационного взаимодействия с СА, достаточно просто уяснить факт её существования.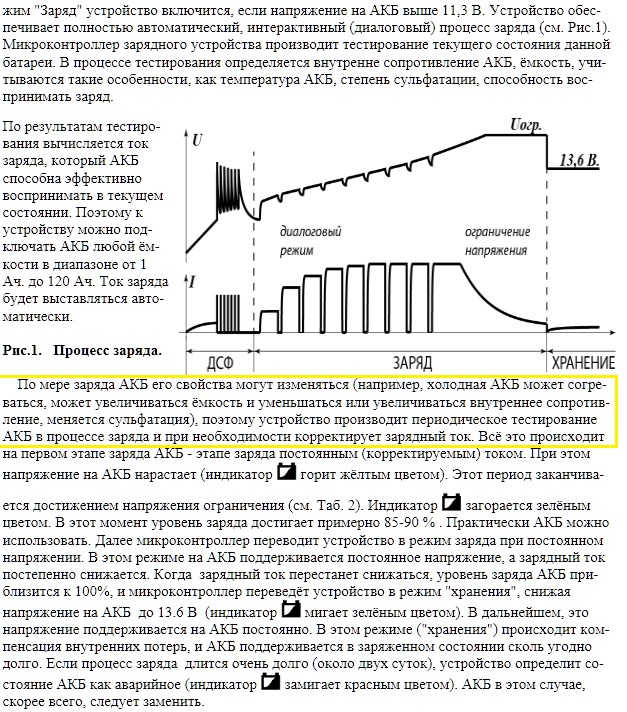
Зарядное воздействие вызывает поляризацию двойного слоя, и отношение к этому у разных теоретиков и практиков разное. Одни считают паразитный ионистор вредным явлением, препятствующим максимально эффективному, с точки зрения скорости, заряду АКБ, и предлагают осуществлять в паузах между импульсами заряда деполяризующее воздействие в виде разрядного импульса.
Воздействие асимметричным (переменным с постоянной составляющей) током, или с применением разрядной нагрузки, включаемой только в паузах или подключенной постоянно, используется для заряда и восстановления свинцово-кислотных батарей уже давно.
При заряде никелевых аккумуляторов асимметричное воздействие настоятельно рекомендуется, а для экспериментального восстановления марганцево-цинковых элементов обязательно необходимо, так как препятствует росту дендритов, характерному для этих ХИТ, и вызывающего их аварийные отказы вследствие короткого замыкания.
Для СА активная деполяризация может обрести смысл в свете актуализации исследования полупроводниковых свойств сульфатированных пластин в поисках новых способов десульфатации и подведения теоретической базы под уже известные в течение многих лет. С другой стороны, разрядное воздействие снижает КПД заряда, а ускорение последнего таким способом может снижать срок службы АКБ, потому применимость подобных методов следует признать ограниченной.
С другой стороны, разрядное воздействие снижает КПД заряда, а ускорение последнего таким способом может снижать срок службы АКБ, потому применимость подобных методов следует признать ограниченной.
Для восстановительного обслуживания и экспресс-заряда при нормированном износе использование принудительной деполяризации двойного слоя может быть одобрено, но не для профилактики и повседневного заряда с приоритетами энергоэффективности и продления жизни АКБ.
Волшебный ионистор
Что произойдёт с ионистором двойного слоя, если просто снять с аккумулятора внешнее зарядно-поляризующее воздействие, разорвав цепь, например, транзисторным ключом? — Он деполяризуется (релаксирует), разряжаясь и отдавая накопленные заряд и энергию активной массе, то есть, совершая полезный заряд СА!
Более того, поляризация двойного слоя зарядными импульсами с последующей релаксационной паузой позволяет создать десульфатирующее перенапряжение, и если импульсы достаточно коротки, газообразование при этом не успеет начаться! Те кислород и водород, что выделились за период перенапряжения, успеют рекомбинировать и вернуться в электролит, вместо участия во вредных и опасных явлениях.
Это и есть принцип релаксационного, импульсного или прерывистого заряда, разрешающий целый клубок диалектических противоречий, например, необходимости и недопустимости перенапряжения. То же и с плотностью тока: амплитуду зарядного импульса можно (и нужно) установить равной двойному току 20-часового разряда, или даже выше, если есть уверенность в алгоритме контроллера.
Закон сохранения энергии?
Здесь вдумчивого читателя одолеют сомнения. Двойной ток 20-часового разряда — это 0.1C
20, тот самый ток, что рекомендован для заряда СА в непрерывном режиме, и заряжает полностью разряженную АКБ за 10-12 часов.
Прерывистый заряд предполагает между импульсами тока паузы для усвоения заряда активной массой, поступления ионов в её глубину, выравнивания в ней плотности электролита. Сколько же тогда ждать завершения заряда? Ведь средний ток, совокупные заряд и энергия, сообщённые аккумулятору зарядным устройством, за, например, час, при прерывании паузами окажутся ниже, чем в случае «нормальной» непрерывной подачи тока той же силы!
Продвинутое релаксационное ЗУ зарядит полностью разряженную исправную АКБ током 0. 1С20 за 8-12 часов, в зависимости от её состояния. То есть, даже быстрее, чем если бы ток не прерывался. Как такое возможно, и можно ли этому верить?
1С20 за 8-12 часов, в зависимости от её состояния. То есть, даже быстрее, чем если бы ток не прерывался. Как такое возможно, и можно ли этому верить?
Дело всё в том, что при классической CC (constant current) зарядке «лишняя» энергия, которую не успевает усвоить активная масса, идёт в нагрев АКБ, электролиз воды, коррозию структуры. А умное ЗУ эти лишние кулоны и джоули просто не подаёт, ожидая готовности ХИТ принять новую порцию заряда, либо снижая параметры модулированного воздействия.
Это не означает КПД 100 «и более» процентов, абсолютного пресечения газообразования и нагрева, гарантии быстрого заряда при любом состоянии батареи. Изношенные, сульфатированные, предаварийные и аварийные АКБ могут немного нагреваться и шуршать пузырями при восстановлении, которое может продлиться долго или очень долго, если с одной или несколькими банками всё совсем плохо. Что совсем не означает лишних затрат времени и денег: ЗУ ведь автоматическое, и электроэнергией распоряжается добросовестно, экономно.
Зато на порядки повышается вероятность успешного восстановления аккумулятора, который в противном случае однозначно пошёл бы в утиль, создавая нагрузку на экологию и экономику, т.е. ваше здоровье и кошелёк, (а ещё точнее, ресурсы свободы плодотворной счастливой жизни). А если беречь АКБ смолоду, получим и повышение, по сравнению с традиционной практикой заряда, её эксплуатационных характеристик, (также являющихся упомянутыми ресурсами).
Так как же реализовать этот импульсный заряд?
На сегодняшний день существует множество способов осуществления импульсного или модулированного зарядного воздействия, управления им с помощью различных обратных связей, устройств для их реализации. Актуальность высока и растёт, идёт постоянное совершенствование, текущими и прекрасными результатами которого можно пользоваться уже сейчас.
Выше мы упомянули о суперпозиции нескольких, (опять упрощённо, число на самом деле не целое), электрических сигнатур в сигнале напряжения с клемм аккумулятора при подаче зарядного импульса. Сигнал в паузе также образован наложением сигнатур токообразующих реакций и побочных явлений в банке СА. А таких банок в самой распространённой 12-вольтовой АКБ целых 6, соединённых последовательно, и подключиться к перемычкам между ними чаще всего невозможно или неудобно.
Добавим к этому наводки помех, прежде всего, из электросети и самого источника питания ЗУ, и мы поймём, что задача аналоговой и цифровой обработки электрического сигнала с клемм АКБ для определения амплитудных и временны́х параметров оптимального зарядного воздействия нетривиальна. Надо знать, что именно искать, и суметь научить этому автомат.
Можно просто приобрести современное зарядно-восстановительное устройство, но даже в этом случае желательно иметь представление о сути его работы, без которого трудно выбрать наиболее подходящий для себя инструмент и пользоваться им по максимуму. А можно поставить собственные эксперименты, на радость и пользу себе и окружающему миру. В любом случае не помешает составить краткую классификацию зарядных методов и устройств.
CC/CV
Constant current, constant voltage — стабилизация или ограничение тока и/или напряжения на заданных уровнях. Может дополняться термокомпенсацией, а также реализацией многоступенчатого заряда, с переключением критериев стабилизации по достижении некоторых условий, таких как: напряжение или ток на клеммах, время с начала заряда, сообщённые АКБ количество электричества или энергия, а в эксплуатационных контроллерах учитывать и предшествовавший разряд АКБ.
Усложнение логики работы таких устройств может (должно) давать лучшие, по сравнению с простой зарядкой от стабилизированного или нестабилизированного блока питания, однако не разрешает в полной мере упомянутых выше диалектических противоречий, не учитывает тонкостей кинетики и не даёт гарантии адекватности зарядного воздействия текущим потребностям АКБ, то есть способности принимать полезный заряд, не говоря уже о десульфатации.
Качели
Если добавить к CC/CV ЗУ критерии окончания и возобновления заряда, например, по напряжению на клеммах, получится один из простейших способов и приборов прерывистого заряда, называемый «качелями», «двухпороговым компаратором» или «компаратором с гистерезисом», в честь основных управляющих элементов. По достижении, например, 14.22 вольта, ЗУ отключает заряд, а при падении НРЦ до, например, 13.1В, возобновляет. Получается релаксационный генератор.
Так должны достигаться и неснижение зарядного тока в конце, компенсация саморазряда при хранении, и оптимизирующий дозаряд глубинных слоёв АМ («добивка ёмкости»), и десульфатирующее перенапряжение, причём со значительным снижением (предотвращением) нагрева, газовыделения и коррозии.
Периодичность качелей может быть от секунд до часов и более, и они нуждаются в ручной или автоматизированной, например, запоминанием достигнутых данной АКБ уровней, подстройке, а также и термокомпенсации. Без чуткого контроля компетентным человеком, (который вынужден следить за процессом), или цифровой обработки электрических сигнатур происходящих в СА процессов, опираясь на одно лишь напряжение или ток, простые качели зачастую не дают того эффекта, который могли бы при лучшем управлении.
Неподходящие для данной конкретной АКБ настройки прерывистого и/или модулированного (см. ниже) заряда могут не замедлить или обратить вспять, а напротив, ускорить, усугубить её деградацию, например, короткое замыкание (КЗ) отдельных банок.
Моргалка
Одной из проблем качелей является слишком быстрое достижение или слишком долгое, (вплоть до бесконечности), ожидание неверно установленного, или переставшего быть верным в ходе процессов, порога, что может вести как к затягиванию обслуживания и недозаряду, так и перезаряду, со всеми вытекающими. Вариант решения этой проблемы — отведение для импульса и паузы определённого времени.
Простейшие устройства прерывистого заряда вообще имеют только таймер (мультивибратор, прерыватель) включения и отключения зарядного тока, и носят название мигалок или моргалок, хотя моргалкой иногда называют любое импульсное ЗУ, в том числе реализующее сложный алгоритм при помощи микроконтроллера.
Использование автомобильного реле поворотов для подачи зарядного воздействия импульсами известно давно, и многим помогло осуществить восстановительный предзаряд аварийно разряженных и сильно засульфатированных АКБ. Это и были первые моргалки.
Модуляция
А вот устройствами модулированного заряда, как ни странно, являются и дедовский выпрямитель, и автомобильный или мотоциклетный генератор, опять же с выпрямителем, дающим несглаженный пульсирующий ток. Чем же прерывистый заряд отличается от модулированного? — Терминологическим критерием. Там, где частоты ниже нескольких герц, говорят о прерывистом заряде, выше — модулированном. Тот и другой относят к импульсным, пульсирующим.
Одно не исключает другого, и в циклах с периодом единицы-сотни секунд импульс зарядного воздействия может представлять собой пачку импульсов более высокой частоты. Это может создавать как дополнительные возможности для дозаряда глубинных слоёв, выравнивания концентрации реактивов и десульфатации, так и сложности, связанные, например, с электромагнитными помехами, влиянием проводов и разъёмов, побочные явления, которые ещё предстоит исследовать и научиться применять или предотвращать. Разные авторы пишут о разных частотах, принимая во внимание кинетику разных процессов, составляющих заряд АМ или влияние на него.
Уже дедовский выпрямитель и генератор авто создают возможности для релаксационных явлений в СА, улучшающих его характеристики в сравнении с насильственной подачей стабилизированного сглаженного тока или, того хуже, удержанием сглаженного напряжения, (причина, по которой в недалёком прошлом некоторые пришли к выводу о непригодности импульсных источников питания, не путать с импульсными ЗУ, для заряда АКБ).
Выводы и перспективы
Исследование реактивных характеристик СА и их откликов на всё совершенствующиеся методы воздействий продолжает открывать перед нами всё расширяющийся и углубляющийся спектр релаксационных, квазирезонансных, резонансных и волновых явлений. Всё это просто захватывающе интересно и приносит полезные плоды.
Сегодня является актуальным, к примеру, изучение явления задержки распространения электричества в свинцовом аккумуляторе, ведущего к часто наблюдаемому многими усиленному износу крайних (электрически) банок и батарей, причём это нельзя списать на одну лишь неравномерность температуры. Пора вырабатывать методы и устройства для обслуживания СА с АМ, легированной углеродными нанотрубками, а также исследовать возможности создания на её основе компактных «сухих» аккумуляторов для лёгких мобильных применений.
В краткой беседе мы так и не коснулись разрядных характеристик, а ведь режимом разряда можно тоже управлять. Предстоит в скором времени испытать возможности рекуперативного торможения с возвратом энергии в тяговую свинцовую батарею, изучить, насколько значительную мощность при продвинутом управлении процессом она способна принять без вреда для себя, а также проверить гипотезу о том, что импульсы зарядного воздействия могут позволить использовать больше полезной ёмкости, скомпенсировав известный эффект снижения последней при повышении тока разряда.
Свинец и серная кислота — наши добрые друзья, если обращаться с ними чутко и добросовестно. Волшебный мир свинцово-кислотных аккумуляторов ждёт своих исследователей, изобретателей и просто всех тех, кому скромные массивные ящички принесут пользу, свободу и радость!
Самодельный десульфатор
Схема для восстановления автомобильного аккумулятора
Всем привет, вы давно просите написать статью про устройство для восстановления автомобильных, свинцово-кислотных аккумуляторов. Наверное любой автолюбитель сталкивался с явлением, когда аккумулятор полежав некоторое время без дела, перестает отдавать номинальную ёмкость.
Крутит стартёр полсекунды затем задыхается, но напряжение на нём нормальное — 12 вольт, в этом случае в народе часто говорят «аккумулятор не держит ток», с этим может столкнулся каждый.
Но почему это происходит?
Автомобильный аккумулятор состоит из свинцовых пластин находящихся в растворе электролита, в данном случае электролитом является серная кислота. Процесс заряда и разряда аккумулятора не что иное, как окислительно-восстановительный процесс. Протекает химическая реакция в ходе которой, свинцовая пластина вступает в реакцию с оксидами на соседней пластине.
В ходе данной реакции образуются сульфаты, которыми со временем обрастают пластины, сульфаты препятствуют протеканию тока, так как являются плохим проводником и со временем аккумулятор теряет ёмкость и не способен отдавать большой ток для работы стартёра.
Если ваш аккумулятор заряжается и разряжается быстрее чем раньше, не имея при этом механических повреждений, скорее всего сульфатация убила его, но отчаиваться не стоит, читаем статью до конца…
Предлагаемое устройство, отныне — «десульфатор» создаёт короткие импульсы высокой амплитуды и чистоты, импульс длится определённое время, затем простой, затем снова импульс.
Такие ударные процессы могут разрушить сульфатную плёнку и в теории это возможно, на практике не все аккумуляторы удаётся восстановить, из-за конструктивных особенностей последних. Но судя по статистике, около 80-85 % старых аккумуляторов подлежат восстановлению. Естественно если причиной неработоспособности является сульфатация, а не обрыв свинцовых пластин или иное механическое повреждение.
Вот такое получится устройство…
Как пользоваться устройством? Данный вариант является зарядно-десульфатирующим устройством, обычный десульфатор питается от аккумулятора, который он десульфатирует и постепенно разряжает его, в этом же случае устройство заряжает аккумулятор короткими всплесками высокого напряжения высокой частоты.
Схему можно использовать и для зарядки низковольтных, свинцовых аккумуляторов с номинальным напряжением в 4-6 вольт, такие ставят в китайские фонарики, в детские электрокары и так далее…
Схема изначально создана для зарядки аккумуляторов малой ёмкости, но её успешно используют и для десульфатации автомобильных аккумуляторов.
Перед тем, как начать процесс заряда с десульфатацией, нужно слегка подзарядить автомобильный аккумулятор. Для начала нужно найти любой источник питания или зарядное устройство с напряжением от 8 до 12 вольт и подключить его на вход десульфатора. Но не напрямую, а через лампу накаливания 12 вольт с мощностью в 21 ватт, чтобы не превысить ток заряда.
К выходу прибора подключается аккумулятор, который нужно восстановить, ну и в принципе всё.
Так, как прибор работает в звуковом диапазоне, вы скорее всего услышите слабый свист, силовые компоненты схемы слегка должны нагреваться.
Осциллографом можно убедиться, что аккумулятор заряжается импульсами тока высокой частоты.
Схема устройства довольно простая…
Простыми словами поясню как работает схема.
Напряжение зарядного устройства через предохранитель и диод поступает на схему десульфатора, для маломощной части схемы, питание подаётся через токоограничивающий резистор R1, затем сглаживается небольшим электролитическим конденсатором.
На микросхеме NE555 собран генератор прямоугольных импульсов, частота этих импульсов около 1 килогерц, коэффициент заполнения 90%, то есть сигнал высокого уровня длится большУю часть времени, именно этот импульс нам нужен для того, чтобы открыть полевой транзистор. Но проблема заключается в том, что при подаче такого импульса на полевой транзистор он большую часть времени будет находиться в открытом состоянии и лишь 10% в закрытом, это приведёт к тому, что транзистор будет прокачивать слишком большой ток и как следствие мы получим сильный нагрев всех силовых элементов и большое потребление тока всей схемы в целом.
Это неэффективно и может навредить аккумулятору. Один из вариантов — это снижение длительности сигнала высокого уровня, тогда транзистор будет открыт на короткое время и всё станет на свои места. Но к сожалению в таком включении конструктивные особенности таймера NE555 не позволяют сделать этого, так как же быть?
Микросхема CD4049 представляет из себя логику, которая содержит в своём составе 6 логических инверторов «не», каждый инвертор имеет один вход и один выход, их задача «отрицание». Если на вход поступает высокий уровень, на выходе получаем обратное, иначе говоря инвертированный или перевёрнутый сигнал.
Полевой транзистор 10 % времени у нас открыт, 90% закрыт, открываясь он замыкает дроссель на массу питания, в дросселе накапливается некоторая назовём это энергией, а когда транзистор закрыт цепь разрывается и за счёт явления самоиндукции, которая свойственна индуктивным нагрузкам, дроссель отдаёт накопленную энергию.
Это кратковременный всплеск напряжения с высокой амплитудой, притом напряжение самоиндукции в разы выше напряжения питания, этот всплеск напряжения выпрямляется и подается на аккумулятор.
Процесс происходит больше тысячи раз в секунду, то есть на аккумулятор подаются кратковременные импульсы высокого напряжения с высокой частотой, именно это и разрушает сульфатную плёнку.
Я подключил на вход схемы накопительный конденсатор и стало ясно, что амплитудное значение выходного напряжения при питания от источника 12 вольт доходит до 70-75 вольт и зависит исключительно от индуктивности накопительного дросселя.
В схеме задействован предохранитель и ещё один выпрямительный диод.
Предохранитель защищает десульфатор при случайных коротких замыканиях на выходе, а диод выполняет несколько функций: во-первых защищает схему, если вы случайно её подключите к зарядному устройству неправильно… и во-вторых защищает зарядное устройство от всевозможных импульсных помех и всплесков напряжения, которые образуются на плате десульфатора.
Я думаю все поняли как это работает.
О компонентах…
Ну с таймером и логикой думаю всё понятно, в моём случае они установлены на панельке для безпаечного монтажа, но вам советую после проверки схемы запаять их напрямую.
Полевой транзистор IRF3205 или любые другие n-канальные с напряжением от 60 до 200 вольт и с током от 30 ампер.
Транзистор советую установить на небольшой радиатор.
Дроссель имеет индуктивность около 200 микрогенри, намотан на кольце из порошкового железа, такие кольца можно найти в компьютерных БП, размеры кольца внешний диаметр-20.5мм, внутренний 12мм и ширина кольца 6.6мм.
Обмотка намотана проводом 1мм, количество витков 60, в моём случае прОвода чуть-чуть не хватило и индуктивность получилась слегка меньше, но работает устройство хорошо. Размеры кольца особо не критичны, главное соблюдать индуктивность и мотать обмотку проводом 1 -1.2 миллиметра.
Конденсатор С1 на 100- 220 микрофарад, очень желательно взять с низким внутренним сопротивлением, так как схема генератора фактически питается от данного конденсатора, а значит он постоянно будет накапливать и отдавать энергию, даже слегка греется во время работы.
Оба диода нужно взять с током в 5-10 ампер, можно обычные, но желательно взять импульсные диоды.
Вот печатная плата, скачать её можно в конце статье.
На самом зарядном, нужно выставить ток не более 2 ампер, иначе сгорит предохранитель на плате десульфатора. Кто-то скажет 2 ампера зарядного тока это мало?
-Да согласен, но не забываем, что у нас в большей степени не зарядка, а десульфатация.
В холостую прибор потребляет от источника питания ток всего в 100 миллиампер, его можно подключить к любому зарядному устройству с напряжением 12-15 вольт, ограничить ток на уровне 2 ампер и всё.
Ограничение можно сделать мощным резистором или лампочкой накаливания соответствующей мощности, подключённой в разрыв плюса питания.
Введите электронную почту и получайте письма с новыми поделками.
Можно использовать и более низковольтные блоки питания с напряжением 8-10 вольт, так как наша схема всё равно повышает начальное питание до нескольких десятков вольт.
Сколько должен длиться процесс десульфатации?
Автор данной схемы говорит, что в течение двух недель регулярной зарядки полностью можно восстановить старый аккумулятор и конечно же без проверки я бы не стал писать эту статью.
В наличии у меня несколько 6 вольтовых аккумуляторов на 10 ампер\часов, которые не были в эксплуатации несколько лет, в течение пяти дней я регулярно заряжал один из этих аккумуляторов десульфатором, затем разряжал.
В самом начале подопытный аккумулятор отдавал ёмкость всего 700-800 миллиампер\часов, не помогла и заливка дистилированной воды, но десульфатор помог..
Спустя 5 дней аккумулятор отдаёт аж 4 ампера из 10, это я думаю очень хороший показатель.
Архив к статье; плата в формате .lay скачать.
Автор; АКА КАСЬЯН
Изучены 2 простых схемы десульфатора батареи
В этой статье мы исследуем 2 простые, но мощные схемы десульфатора батареи, которые можно использовать для эффективного удаления и предотвращения десульфатации в свинцово-кислотных батареях. Первый метод использует импульсы PWM, а второй метод реализует обычный мостовой выпрямитель для того же.
Сульфатирование в свинцово-кислотных аккумуляторах — довольно распространенное явление и большая проблема, потому что процесс полностью снижает эффективность аккумулятора. Считается, что зарядка свинцово-кислотной батареи с помощью метода ШИМ инициирует десульфатацию, помогая восстановить эффективность батареи до определенного уровня.
Что такое сульфатирование в свинцово-кислотных аккумуляторах
Сульфатирование — это процесс, при котором серная кислота, присутствующая в свинцово-кислотных аккумуляторах, со временем реагирует с пластинами с образованием слоев белого порошка, подобного веществу, над пластинами.
Этот слой отложений серьезно ухудшает химические процессы внутри батареи во время зарядки или разрядки, делая батарею неэффективной с ее способностью передавать энергию.
Обычно это происходит, когда аккумулятор не используется в течение длительного времени, а процессы зарядки и разрядки выполняются не очень часто.
К сожалению, не существует эффективного способа решения этой проблемы, однако было исследовано, что застрявшие отложения серы на поврежденной батарее могут быть в некоторой степени разрушены путем воздействия на батарею сильноточных импульсов во время ее зарядки.
Эти сильноточные зарядные импульсы должны быть хорошо оптимизированы с помощью некоторой схемы управления и должны тщательно диагностироваться при реализации процесса.
1) Использование ШИМ
Реализация метода через схему с ШИМ-управлением, вероятно, лучший способ сделать это.
Вот отрывок из википедии, в котором говорится:
«Десульфатация достигается за счет сильноточных импульсов, генерируемых между выводами батареи. Этот метод, также называемый импульсным кондиционированием, разрушает кристаллы сульфата, которые образуются на пластинах батареи. . Короткие сильноточные импульсы, как правило, работают лучше всего. Электронные схемы используются для регулирования импульсов различной ширины и частоты сильноточных импульсов. Их также можно использовать для автоматизации процесса, поскольку для полной десульфатирования батареи требуется длительный период времени. .»
https://en.wikipedia.org/wiki/Talk%3ABattery_regenerator
Обсуждаемая здесь схема зарядного устройства с ШИМ-сигналом может считаться наилучшей конструкцией для проведения описанного выше процесса десульфатации.
Как работает схема Функции
IC 555 сконфигурирован и используется в стандартном режиме управления PWM.
Выходной сигнал IC соответствующим образом усиливается через пару транзисторов, так что он может подавать упомянутые сильноточные импульсы на батарею, которая должна быть десульфатированный.
ШИМ-регулирование может быть установлено на низкий коэффициент «отметки» для реализации процесса десульфатации.
И наоборот, если схема предназначена для использования для зарядки обычных аккумуляторов, ШИМ-управление может быть настроено для генерации импульсов с равными отношениями метка / пространство или в соответствии с желаемыми спецификациями.
Управление ШИМ будет зависеть исключительно от личных предпочтений человека, поэтому должно выполняться правильно в соответствии с инструкциями производителя батарей.
Несоблюдение надлежащих процедур может привести к несчастному случаю со смертельным исходом из-за возможного взрыва аккумулятора.
Уровень входного тока, равный уровню AH аккумулятора, может быть выбран изначально и постепенно уменьшаться, если обнаруживается положительный ответ от аккумулятора.
2) Десульфатирование с помощью схемы трансформатора и мостового выпрямителя
Чтобы сделать этот простейший, но эффективный десульфатор аккумулятора со схемой зарядного устройства, вам просто потребуется трансформатор подходящего номинала и мостовой выпрямитель. Конструкция не только обессеривает аккумулятор, но и предотвращает появление этой проблемы в новых аккумуляторах и одновременно заряжает их до желаемого уровня.
В начале этого поста мы узнали, как десульфатировать, используя концепцию ШИМ, однако более глубокое исследование показывает, что процесс десульфатации батареи не обязательно требует прецизионной схемы ШИМ, просто источник питания должен колебаться с определенной заданной скоростью, и этого достаточно, чтобы запустить процесс десульфатации (в большинстве случаев) … при условии, что батарея все еще находится в диапазоне отверждения и не находится за пределами состояния восстановления.
Итак, что вам нужно, чтобы сделать эту сверхпростую схему десульфатора батареи, которая также будет заряжать данную батарею и, кроме того, обладать способностью предотвращать развитие проблемы сульфатирования в новых батареях?
Трансформатор подходящего номинала, мостовой выпрямитель и амперметр — все, что нужно для этой цели.
Номинальное напряжение трансформатора должно быть примерно на 25% выше номинального напряжения батареи, то есть для батареи 12 В на клеммах батареи может подаваться напряжение от 15 до 16 В.
Ток может быть приблизительно равен номиналу Ач батареи для тех, которые необходимо восстановить и которые сильно сульфатированы, для хороших аккумуляторов зарядный ток может составлять примерно 1/10 или 2/10 их номинала Ач. Мостовой выпрямитель должен быть рассчитан в соответствии с указанными или рассчитанными уровнями заряда.
Схема десульфатора с использованием мостового выпрямителя
Принцип работы мостового выпрямителя в качестве десульфатора
На приведенной выше диаграмме показаны минимальные требования к предлагаемому десульфатору батареи со схемой зарядного устройства.
Мы можем увидеть наиболее стандартную или, скорее, грубую настройку источника питания переменного тока в постоянный, где трансформатор понижает сетевое напряжение до 15 В переменного тока для указанной батареи 12 В.
Прежде чем достигнуть клемм аккумулятора, 15 В переменного тока проходит процесс выпрямления через подключенный мостовой выпрямительный модуль и преобразуется в двухполупериодный 15 В постоянного тока.
При питании от сети 220 В частота перед мостом будет 50 Гц (стандартная спецификация сети), а после выпрямления предполагается, что она станет двойной по сравнению с 100 Гц. Для входа 110 В переменного тока это будет около 120 Гц.
Это происходит потому, что мостовая сеть инвертирует нижние полупериоды понижающего переменного тока и комбинирует их с верхними полупериодами, чтобы в итоге получить пульсирующий постоянный ток 100 или 120 Гц.
Именно этот пульсирующий постоянный ток становится ответственным за встряхивание или сбивание сульфатных отложений на внутренних пластинах конкретной батареи.
Для хорошей батареи это импульсное зарядное устройство с частотой 100 Гц гарантирует, что сульфатирование перестает происходить в первую очередь, и, таким образом, помогает держать пластины относительно свободными от этой проблемы.
Вы также можете увидеть амперметр, подключенный последовательно к входу питания, он обеспечивает прямую индикацию потребления тока батареей и обеспечивает «живое обновление» процедуры зарядки, а также то, может ли происходить что-нибудь положительное.
Для хороших аккумуляторов это предоставит информацию от начала до конца, касающуюся процесса зарядки, то есть первоначально стрелка измерителя будет указывать заданную скорость зарядки аккумулятора, и можно ожидать, что постепенно она опустится до нулевой отметки, и это когда необходимо отключить зарядное устройство.
Можно использовать более изощренный подход для включения автоматического отключения после полной зарядки аккумулятора с помощью схемы автоматического отключения полного заряда аккумулятора на базе операционных усилителей (вторая диаграмма)
О Swagatam
Я инженер-электронщик (dipIETE), любитель, изобретатель, разработчик схем / плат, производитель. Я также являюсь основателем веб-сайта: https://www.homemade-circuits.com/, где я люблю делиться своими инновационными идеями и руководствами по схемам.
Если у вас есть какие-либо вопросы, связанные со схемами, вы можете взаимодействовать с ними через комментарии, я буду очень рад помочь!
— HomemadeTools.net
ОПИСАНИЕ:
Самодельный десульфатор, изготовленный по опубликованной принципиальной схеме.
Новые сообщения на форуме
- Подвеска с шагающей балкой — GIF от Frank S on 2020-08-20 22:42:09
- Титановый молоток — видео от IAMSatisfied on 2020-08-20 22:29:14
- Зажимы для установки плинтуса — GIF от Altair on 2020-08-20 21:51:01
- Машина для плетения — видео от N00b Machinist на 2020-08-20 21:48:54
- Пластиковое ведро для предотвращения заклинивания от madokie on 2020-08-20 21:23:24
- Таблицы эквивалентов и сравнения Carbide Insert от Canyonman44, 2020-08-20 20:27:47
- Клавиатура для просмотра интернета для слепых — GIF от Altair on 2020-08-20 20:27:02
- Расчет радиуса кругового сегмента Duke_of_URL 2020-08-20 20:24:33
- Камера возрождения канарейки угольной шахты — фото McDesign 2020-08-20 20:11:14
- Клара Линдблом в рекламе энергетического напитка — GIF от Frank S 2020-08-20 19:45:37
Родственные самодельные инструменты:
.Аккумуляторный десульфатор | Hackaday
Hack a Day фаворит [Майки Склар] вернулся с новым проектом. Mini-D — это аккумуляторный десульфатор. Если свинцово-кислотная батарея на 12 В работает с напряжением ниже 12,3 В, на свинцовых пластинах начнут формироваться кристаллы серы. Этот рост кристаллов увеличивает внутреннее сопротивление и в конечном итоге делает батарею непригодной для использования. Десульфатор батареи посылает высокочастотные импульсы через батарею, чтобы создать резонанс, который разрушит кристаллы.Для автомобильного аккумулятора весом 60 фунтов для полного обессеривания потребуется примерно три недели. Вы можете найти схемы и десяток строк кода для ATmega169 на его сайте. Ниже представлено видео, в котором он объясняет устройство и другие методы, такие как нагрузочное тестирование.
.Как правильно заряжать аккумулятор? Зарядка аккумулятора | Заряд аккумуляторной батареи герметичной необслуживаемой
Правильная зарядка аккумулятора
Одним из наиболее важных условий корректной работы, хорошей отдачи и длительного срока службы аккумуляторной батареи является её правильный заряд. Это касается абсолютно всех аккумуляторов: будь то мощные промышленные большой емкости, либо же крошечные батарейки в Ваших мобильных. К сожалению, далеко не все пользователи знают, что есть правильная зарядка аккумулятора. Данная статья призвана помочь людям в этом вопросе и быть «руководством пользователя» при столкновении с задачей должным образом зарядить АКБ (аккумуляторную батарею).
Существует множество различных видов электрических аккумуляторов – для каждого из них характерны свои правила и особенности заряда. Все они подробно описаны в инструкциях по эксплуатации, обязательным образом поставляемых продавцом (по крайней мере мы так делаем всегда) вместе с аккумуляторной продукцией. Однако, бороздить инструкцию в поиске нужной информации не всегда удобно, да и не всегда, согласитесь, есть к тому желание. Посему, в данной статье мы обрисуем общие правила по правильной зарядке наиболее популярных и часто используемых в бытовых условиях аккумуляторов – свинцово-кислотных необслуживаемых герметичных АКБ (чаще всего это аккумуляторы для ИБП, аккумуляторы для электромобилей, электромоторов, для лодок, эхолотов, для сигнализации и связи и проч.) – AGM и гелевых аккумуляторов. Эти правила кое в чем справедливы и для автомобильных стартерных (обслуживаемых) АКБ, хоть процесс заряда таких аккумуляторов и имеет некоторые особенности.
Как заряжать аккумулятор?
Итак, давайте разберемся, что представляет из себя правильный заряд аккумуляторной батареи. Для начала хотим обратить внимание на одно общее правило, касающееся ВСЕХ БЕЗ ИСКЛЮЧЕНИЯ видов аккумуляторов, известных науке: чем меньше раз разряжается аккумулятор и чем менее глубоким является каждый отдельно взятый его разряд, тем большим будет срок его службы. Все мифы о том, что аккумулятор (какой бы он ни был!), нужно каждый раз полностью разряжать, а затем полностью заряжать, и только так он прослужит максимально долго, а также утверждения «знатоков», что, мол, надо обязательно периодически разряжать аккумулятор, иначе он испортится – полная чушь! Если Вам предлагают купить аккумулятор и при этом рассказывают подобные «истории» – держитесь от таких продавцов и их продукции подальше. Для низкокачественных батарей, производимых из «грязного» вторсырья, отсутствие периодической «встряски» в виде разряда-заряда может действительно быть причиной быстрого выхода из строя (из-за того, что пластины данных АКБ чрезмерно загрязнены, и без «встрясок» данная «грязь» быстро обволакивает поверхность пластин и мешает нормальному прохождению процесса электролиза). Но для качественных аккумуляторов наиболее излюбленным является именно режим постоянного (буферного) подзаряда, при котором практически отсутствуют разряды, а сама АКБ постоянно пребывает под правильным напряжением.
Здесь надо учитывать также эффект памяти некоторых аккумуляторных батарей — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток только до «запомненной границы». Никель-металл-гидридный (Ni-MH), Никель-кадмиевый (NiCd), Серебряно-цинковый аккумулятор.
Переходим ближе к делу. Чтобы правильно заряжать аккумулятор нужно понимать, в каком режиме он у Вас эксплуатируется.
Что такое буферный режим работы
Самый яркий пример буферного режима работы аккумулятора – ИБП (источник бесперебойного питания, он же UPS). В ИБП аккумуляторная батарея находится на постоянной подзарядке и отдает энергию лишь тогда, когда пропадает электричество в сети, а как только оно появляется, аккумулятор тут же подзаряжается. Это самый щадящий режим работы и именно в буферном режиме, как мы уже говорили, аккумуляторы служат дольше всего (например, наши батареи EverExceed серии ST, производимые по технологии AGM нового поколения, имеют срок службы в буферном режиме при Т=20оС – 12 лет).
Что такое циклический режим работы
Пример циклического режима использования АКБ – поломоечная машина, детский электромобиль в парке аттракционов, либо же система автономного электропитания с использованием альтернативных источников энергии (солнечных батарей, ветряков и т.д.). Аккумуляторы в этих приложениях разряжают-заряжают как минимум 1 раз в сутки. Такой режим является наиболее суровым, и срок службы АКБ тут уже исчисляется не годами, а количеством циклов разряд-заряда (ну и их глубины, естественно). Упомянутые ранее аккумуляторы EverExceed серии ST могут обеспечить до 600 циклов глубокого 100% разряда (обычные же AGM-аккумуляторы – не более 280). Всегда очень удивляет, когда в приложениях с явно циклическим характером работы (те же системы электропитания на солнечных батареях, либо мобильные кофемашины) некоторые «умельцы» предлагают использование стартерных автомобильных аккумуляторов (аргумент – их дешевизна!). Уведомляем всех, кто столкнулся с подобным предложением: стартерные АКБ имеют тонкие пластины, они рассчитаны лишь на запуск двигателя и дальнейшую подзарядку от генератора, в циклическом же режиме с глубокими разрядами они не прослужат и пары месяцев – их пластины «посыпятся» и на этом эксперемент с «дешевым аналогом» будет завершен.
Как правильно заряжать аккумулятор в буферном режиме:
Всем известно, что номинальное напряжение одного элемента в свинцово-кислотных АКБ = 2 Вольта (отметим, что на практике оно обычно никогда не равняется строго 2 В, но для простоты применяется именно такое число). В быту наиболее часто используются аккумуляторные батареи напряжением 6 Вольт (3 элемента) и 12 Вольт (6 элементов).
В буферном режиме напряжение заряда следует выставить на уровне 2,27 – 2,30 Вольт на элемент (то есть для 12-вольтового аккумулятора это 13,6 – 13,8 В, а для 6-вольтового – 6,8 – 6,9 В). Это подходит как для AGM, так и для гелевых батарей.
Ток заряда должен быть ограничен в величину, равную 30% от номинальной 10-часовой емкости аккумулятора, выраженную в Амперах (для гелевых аккумуляторов – 20%). Например, для батареи с емкостью С10=100 Ач ограничение тока заряда должно составлять 30 А (для гелевых АКБ – 20 А).
Как правильно заряжать аккумулятор в циклическом режиме:
Напряжение заряда:
2,4 – 2,45 В/эл. (14,4 – 14,7 В на 12-вольтовую батарею или 7,2 – 7,35 В на 6-вольтовую) – для AGM-аккумуляторов;
2,35 В/эл (14,1 В на 12-вольтовую батарею или 7,05 В на 6-вольтовую) – для гелевых аккумуляторов.
Ток заряда:
20% от С10 (для батареи емкостью 100 Ач – это 20 А).
Сколько должен длиться заряд батареи
Продолжительность заряда зависит от изначальной заряженности (разряженности) батареи. Поначалу идет быстрый заряд (бустерный), но по мере насыщения потребляемый ток снижается, доходя до минимума при достижении полной заряженности АКБ. Критерий полной заряженности – падение тока, который принимает аккумулятор, до 2 – 3 мА на каждый Ач емкости батареи (при буферном заряде). Например, для той же С10=100 Ач батареи падение тока зарядки до 200 – 300 мА будет означать, что батарея почти полностью заряжена. Чтобы довести уровень заряда АКБ до 100%, следует продолжать зарядку таким милли-током еще около 1 часа. Обычно, полностью разряженная батарея заряжается за 10 часов в циклическом режиме или за 30-48 часов в буферном.
Следует учесть, что для полной зарядки аккумуляторной батареи ей следует сообщить примерно на 20% энергии больше, чем следует из понятия “номинальная емкость”. Это, как говорится, законы природы, и они едины для всех свинцово-кислотных да и других батарей, независимо от вида и производителя. Образно говоря, если батарею не «перенасытить», в ней не завершатся должные электрохимические процессы и дальнейшая отдача будет меньше.
Производить зарядку аккумуляторных батарей желательно при температуре окружающей среды 20 – 25оС.
При меньшей температуре заряжать необходимо более длительное время. Зарядка аккумулятора при температуре менее 0оС становится крайне нежелательной (ибо почти безрезультатна). Желательно также наличие функции термокомпенсации (изменения напряжения заряда в зависимости от температуры окружающей среды) на Вашем зарядном устройстве.
Таблица с основными параметрами правильной зарядки аккумуляторной батареи
| БУФЕРНЫЙ РЕЖИМ | ЦИКЛИЧЕСКИЙ РЕЖИМ |
Напряжение заряда | Для 12-в АКБ: 13,6-13,8 В Для 6-в АКБ: 6,8-6,9 В | Для 12-в АКБ: 14,4-14,7 В Для 6-в АКБ: 7,2-7,35 В |
Ток заряда (не более!) | 30% от емкости C10 (для гелевых АКБ – 20%) | 20% от емкости C10 |
Предположительность заряда | 30-48 часов | 10-12 часов |
Критерий заряженности | Падение потребляемого тока до 2-3 мА/Ач + еще 1 час заряда таким током. | Падение потребляемого тока до 8-10 мА/Ач + еще 1 час заряда таким током |
Также даем ответ на вопрос пользователья по поводу режимов заряда «BULK», «ABSORBTION» и «FLOAT«, присутствующих в некоторых ЗУ с интеллектуальной системой заряда:
- В режиме BULK идет зарядка постоянным током, при этом напряжение на аккумуляторе постоянно растет до значения 2,4-2,45 В/эл;
- В режиме ABSORPTION достигается максимальное напряжение, которое поддерживается постоянным, в то время как ток зарядки падает;
- В режиме FLOAT напряжение плавно снижается до буферного (2,27В/эл.), ток остается минимальным. Это есть режим СОДЕРЖАНИЯ аккумулятора.
Выравнивающий заряд применяется, когда есть значительный разброс по напряжению на аккумуляторах (элементах или моноблоках) – более +/- 1%. Но такое бывает редко, по крайней мере для приличных АКБ. Кроме того, если батарея хоть изредка включается на разряд, а потом на заряд, то разброс в какой-то степени сглаживается. Если разброса нету – то и выравнивающий заряд производить нет смысла.
Более подробная информация по правильному заряду конкретных видов аккумуляторных батарей содержится в инструкциях по эксплуатации.
Пульсар Лимитед – Энергия для Лучшей Жизни!
nva1773/Car-Battery-Charger: Зарядное устройство для кислотных аккумуляторов с функцией десульфатации.
Зарядное устройство для кислотных аккумуляторов с функцией десульфатации.
Папки и файлы:
Firmware файл с прошивкой микроконтроллера.
Hard Электронные схемы и печатные платы для PCAD, а также файлы для печати в формате pdf.
Pictures Фото сделанные по мере изготовления устройства.
Soft Проект для MPLAB IDE V8, написан на СИ и скомпилирован с помощью MPLAB C18 V3.
README.md Этот файл.
Описание:
Зарядное устройство предназначено для заряда свинцово-кислотных аккумуляторов с напряжением 12В.
Функция восстановления батареи (десульфатирования) реализована подачей заряда-разряда в импульсном режиме, в соотношении тока 10:1 с временным интервалом 1:2.
Устройство обеспечивает плавную регулировку зарядного тока, снабжено индикаторами напряжения на батарее и тока зарядки.
Так же имеется защита от коротких замыканий на выходных зажимах и неправильной полярности подключения к батарее.
Характеристики:
- питание от сети 220В/50Гц
- заряд свинцово-кислотных АКБ с напряжением 12V
- индикация напряжения на батарее
- индикация зарядного тока
- плавная регулировка зарядного тока от 1 до 5А
- стабилизация зарядного тока
- защита от переполюсовки и внешних коротких замыканий
Наладка:
В режиме наладки можно проверить работоспособность узлов устройства, произвести их калибровку и настройку параметров.
Особенности:
- для активации функции наладки установите перемычку JP1 на плате управления
- перебор параметров производится кратковременным нажатие кнопки SA1
- сохранение параметра в EEPROM — нажатие и удержание кнопки SA1 более 3 секунд
- в верхнем индикаторе отображается параметр, в нижнем его номер
Параметры:
Проверка цепей измерения напряжения.
Цепи заряда и разряда отключены.
На клеммы падаем тестовое напряжение и резистором RV2 подстроить значение по образцовому прибору.
Проверка цепей измерения уставки тока заряда, резистор RV1.
Цепи заряда и разряда отключены.
В зависимости от положение резистора RV1 на индикаторе отображается значение от 1 до 41.
Т.е. имеем 40 шагов на весь диапазон регулятора.
Калибровка минимального тока заряда.
Цепь заряда включена, разряд отключен.
Подключаем к клеммам аккумулятор или реостат (например 6 Ом / 5 А) последовательно с образцовым амперметром.
Резистором RV3 необходимо подстроить коэффициент операционного уселителя, чтобы показания тока соответсвовали образцовому амперметру.
Резистором RV1 устанавливаем 1А, нажимаем и удерживаем более 3 секунд кнопку SA1. При этом в EEPROM запоминается минимальный угол управления тиристором.
Калибровка максимального тока заряда.
Цепь заряда включена, разряд отключен.
Подключаем к клеммам аккумулятор или реостат последовательно с образцовым амперметром.
Резистором RV1 устанавливаем 5А, нажимаем и удерживаем более 3 секунд кнопку SA1. При этом в EEPROM запоминается максимальный угол управления тиристором.
Проверка тока заряда.
Цепь заряда включена, разряд отключен.
Подключаем к клеммам аккумулятор или реостат.
Если пункты 4 и 5 произведены правильно, то в зависимости от положения ручки резистора RV1, ток должен изменяться от 1А до 5А.
Проверка цепей разряда.
Цепь заряда отключена, разряд включен.
Подключаем к клемма последовательно амперметр и источник напряжения (12В) или аккумулятор.
Вращая ручку резистора RV1 должны на амперметре наблюдать значения от -100 до -500 мА, т.е. 1:10 от тока заряда.
Для выхода из режима наладки необходимо снять перемычку JP1.
Эксплуатация:
Подключите устройство к сети. Подайте питание выключателем SB1.
Ручкой регулятора установите необходимый ток заряда.
Если аккумулятор не подключен или перепутана полярности, то на индикаторах будет отображается прочерк (—).
Подключите аккумулятор к клеммам. Если аккумулятор разряжен процесс заряда начнется автоматически.
Когда напряжение достигнит 14,2В — заряд прекратится, на нижнем индикаторе будут отображается прочерки.
При снижении напряжения до 12,5В (саморазряд аккумулятора) процесс заряда повторится.
Процесс создания устройства можно посмотреть на этом форуме.
Сульфат — gaz.wiki
Сульфат или сульфат ион представляет собой многоатомный анион с эмпирической формулой SO2-
4. Соли, производные кислот и пероксиды сульфатов широко используются в промышленности. Сульфаты широко используются в повседневной жизни. Сульфаты являются солями из серной кислоты и многие из них получают из этой кислоты.
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Сульфат | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.108.048 | ||
| Номер ЕС | |||
| UNII | |||
| |||
| Характеристики | |||
| ТАК2- 4 | |||
| Молярная масса | 96,06 г · моль -1 | ||
| Конъюгированная кислота | Сероводород | ||
| Ссылки на инфобоксы | |||
«Сульфат» — это написание, рекомендованное ИЮПАК , но «сульфат» традиционно использовался в британском английском .
Сульфат-анион состоит из центрального атома серы, окруженного четырьмя эквивалентными атомами кислорода в тетраэдрическом расположении. Симметрия такая же, как у метана. Атом серы находится в степени окисления +6, в то время как четыре атома кислорода находятся в состоянии -2. Сульфат — ион несет общий заряд -2 , и это сопряженное основание из бисульфата (или сульфат водорода) иона, HSO—
4, которая, в свою очередь, является сопряженной базой H
2ТАК
4, серная кислота . Органические сложные эфиры сульфатов , такие как диметилсульфат , представляют собой ковалентные соединения и сложные эфиры серной кислоты. Тетраэдрическая молекулярная геометрия иона сульфата является таким, как предсказано теорией VSEPR .
Первое описание связи в современных терминах было сделано Гилбертом Льюисом в его новаторской статье 1916 года, где он описал связь в терминах электронных октетов вокруг каждого атома, то есть отсутствия двойных связей и формального заряда +2 на атоме серы. [1] [а]
Позже Линус Полинг использовал теорию валентных связей, чтобы предположить, что наиболее значимые резонансные канонические связи имеют две пи-связи, включающие d-орбитали. Его аргументация заключалась в том, что таким образом снижается заряд серы в соответствии с его принципом электронейтральности . [2] Длина связи S-O, равная 149 пм, короче, чем длина связи в серной кислоте, составляющая 157 пм для S-OH. Двойная связь была принята Полингом для учета короткой связи S-O. Использование Полингом d-орбиталей вызвало дискуссию об относительной важности пи-связи и полярности связи ( электростатического притяжения ) в возникновении укорочения связи S-O. Результатом явился широкий консенсус в отношении того, что d-орбитали играют роль, но не так важны, как полагал Полинг. [3] [4]
Широко распространенное описание, включающее связь pπ — dπ, было первоначально предложено Дурвардом Уильямом Джоном Круикшенком . В этой модели полностью занятые p-орбитали на кислороде перекрываются с пустыми d-орбиталями серы (в основном d z 2 и d x 2 — y 2 ). [5] Однако в этом описании, несмотря на наличие некоторого π-характера для связей S-O, связь имеет значительный ионный характер. Для серной кислоты вычислительный анализ (с естественными связующими орбиталями ) подтверждает четкий положительный заряд серы (теоретически +2,45) и низкую 3D-занятость. Следовательно, представление с четырьмя одинарными связями является оптимальной структурой Льюиса, а не с двумя двойными связями (таким образом, модель Льюиса, а не модель Полинга). [6] В этой модели структура подчиняется правилу октетов, а распределение заряда согласуется с электроотрицательностью атомов. Несоответствие между длиной связи S-O в сульфат-ионе и длиной связи S-OH в серной кислоте объясняется передачей p-орбитальных электронов с концевых связей S = O в серной кислоте на разрыхляющие орбитали S-OH, их ослабление приводит к увеличению длины связи последнего.
Однако представление Полинга о связывании сульфата и других соединений основной группы с кислородом все еще является обычным способом представления связывания во многих учебниках. [5] [7] Кажущееся противоречие может быть устранено, если понять, что ковалентные двойные связи в структуре Льюиса в действительности представляют собой связи, которые сильно поляризованы более чем на 90% по отношению к атому кислорода. С другой стороны, в структуре с дипольной связью заряд локализован в виде неподеленной пары на кислороде. [6]
Способы получения сульфатов металлов включают: [7]
- Zn + H 2 SO 4 → ZnSO 4 + H 2
- Cu (OH) 2 + H 2 SO 4 → CuSO 4 + 2 H 2 O
- CdCO 3 + H 2 SO 4 → CdSO 4 + H 2 O + CO 2
Существует множество примеров ионных сульфатов, многие из которых хорошо растворимы в воде . Исключения включают в себя сульфат кальция , сульфат стронция , сульфат свинца (II) и сульфат бария , который плохо растворимы. Сульфат радия — самый нерастворимый из известных сульфатов. Производное бария полезно при гравиметрическом анализе сульфата: если добавить раствор большинства солей бария, например хлорида бария , к раствору, содержащему ионы сульфата, сульфат бария выпадет в осадок из раствора в виде беловатого порошка. Это обычный лабораторный тест для определения присутствия сульфат-анионов.
Сульфат-ион может действовать как лиганд, присоединяющийся либо одним кислородом (монодентат), либо двумя атомами кислорода как хелат или мостик. [7] Примером может служить комплекс [ Co ( en ) 2 (SO 4 )] + Br — [7] или комплекс нейтрального металла Pt SO 4 ( P (C 6 H 5 ) 3 ) 2, в котором сульфат-ион действует как бидентатный лиганд. Связи металл – кислород в сульфатных комплексах могут иметь значительный ковалентный характер.
Сульфаты широко используются в промышленности. Основные соединения включают:
- Гипс , природная минеральная форма гидратированного сульфата кальция , используется для производства гипса . Строительная отрасль использует около 100 миллионов тонн в год.
- Сульфат меди , распространенный альгицид , более стабильная форма ( CuSO 4 ) используется в гальванических элементах в качестве электролита.
- Сульфат железа (II) , распространенная форма железа в минеральных добавках для людей, животных и почва для растений.
- Сульфат магния (широко известный как английская соль ), используемый в лечебных ваннах.
- Сульфат свинца (II) , образующийся на обеих пластинах при разряде свинцово-кислотной батареи.
- Лауретсульфат натрия или SLES, обычное моющее средство в составах шампуней.
- Полигалит , гидратированный сульфат K 2 Ca 2 Mg, используемый в качестве удобрения .
Сульфатредуцирующие бактерии , некоторые анаэробные микроорганизмы, например, живущие в донных отложениях или вблизи глубоководных термальных источников, используют восстановление сульфатов в сочетании с окислением органических соединений или водорода в качестве источника энергии для хемосинтеза.
Некоторые сульфаты были известны алхимикам. Соли купороса, от латинского vitreolum , стекловидный, были названы так потому, что они были одними из первых известных прозрачных кристаллов. [8] Зеленый купорос представляет собой гептагидрат сульфата железа (II), FeSO 4 · 7H 2 O; голубой купорос представляет собой пентагидрат сульфата меди (II), CuSO 4 · 5H 2 O, а белый купорос представляет собой гептагидрат сульфата цинка, ZnSO 4 · 7H 2 O. Квасцы , двойной сульфат калия и алюминия с формулой K 2 Al 2 (SO 4 ) 4 · 24H 2 O, использованный в развитии химической промышленности.
Сульфаты образуются в виде микроскопических частиц ( аэрозолей ) в результате сжигания ископаемого топлива и биомассы . Они повышают кислотность атмосферы и образуют кислотные дожди . В анаэробных сульфатредуцирующих бактерий Desulfovibrio desulfuricans и D. вульгарные может удалить черный сульфат корки , которые часто тускнеет зданий. [9]
Основное прямое воздействие сульфатов на климат заключается в рассеянии света, эффективно увеличивающем альбедо Земли . Этот эффект достаточно хорошо изучен и приводит к похолоданию из-за отрицательного радиационного воздействия на величину около 0,4 Вт / м 2 по сравнению с доиндустриальными значениями [10], частично компенсируя больший (около 2,4 Вт / м 2 ) эффект потепления парниковых газов. . Эффект сильно неоднороден в пространстве и является самым большим после крупных промышленных зон. [11]
Первый косвенный эффект также известен как эффект Туми . Сульфатные аэрозоли могут действовать как ядра конденсации облаков, что приводит к большему количеству более мелких капель воды. Многие более мелкие капли могут рассеивать свет более эффективно, чем несколько более крупных капель. Второй косвенный эффект — это дальнейшие побочные эффекты увеличения количества ядер конденсации в облаке. Предлагается, чтобы они включали в себя подавление мороси, увеличенную высоту облаков [12] [ требуется полная ссылка ] для облегчения образования облаков при низкой влажности и более продолжительном сроке службы облаков. [13] [ требуется полная ссылка ] Сульфат может также привести к изменениям в распределении частиц по размерам, что может повлиять на радиационные свойства облаков способами, которые до конца не изучены. Химические эффекты, такие как растворение растворимых газов и малорастворимых веществ, снижение поверхностного натяжения органическими веществами и изменения коэффициента аккомодации, также включены во второй косвенный эффект. [14]
Косвенные эффекты, вероятно, имеют охлаждающий эффект, возможно, до 2 Вт / м 2 , хотя погрешность очень велика. [15] [ требуется полная ссылка ] Таким образом, сульфаты участвуют в глобальном затемнении . Сульфат также вносит основной вклад в стратосферный аэрозоль, образующийся в результате окисления диоксида серы, попадающего в стратосферу импульсивными вулканами, такими как извержение горы Пинатубо в 1991 году на Филиппинах . Этот аэрозоль оказывает охлаждающее воздействие на климат в течение 1-2 лет жизни в стратосфере.
| Имена | |
|---|---|
| Название ИЮПАК Сероводород | |
| Другие названия Бисульфат | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.108.048 |
| 2121 | |
| |
| Характеристики | |
| HSO— 4 | |
| Молярная масса | 97,071 г / моль |
| Температура плавления | 270,47 ° С (518,85 ° F, 543,62 К) |
| Точка кипения | 623,89 ° С (1155,00 ° F, 897,04 К) |
| Давление газа | 0,00791 Па (5,93E-005 мм рт. Ст.) |
| Конъюгированная кислота | Серная кислота |
| Основание конъюгата | Сульфат |
| Ссылки на инфобоксы | |
Сопряженное основание из серной кислоты (H 2 SO 4 ) -a плотные, бесцветный, жирный, коррозионная жидкость-это кислый сульфат — ион ( HSO—
4), также называемый бисульфат- ионом. [b] Серная кислота классифицируется как сильная кислота; в водных растворах он полностью ионизируется с образованием ионов гидроксония (H 3 O + ) и гидросульфата ( HSO—
4). Другими словами, серная кислота ведет себя как кислота Бренстеда – Лоури и депротонируется . Бисульфат имеет молярную массу 97,078 г / моль. Он имеет валентность 1. Пример соли, содержащей HSO.—
4группа — бисульфат натрия , NaHSO 4 . Арчер, Дэвид. Понимание прогноза . п. 77. Рисунок 10.2.
нитратное дыхание — это… Что такое нитратное дыхание?
- нитратное дыхание
- нитратное дыхание
(Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.)
.
- нитрагин
- нитратредуктаза
Смотреть что такое «нитратное дыхание» в других словарях:
Дыхание анаэробное — биологическое окисление, при котором акцептором электронов (окислителем) служит кислород ионов неорганических веществ (например, SO 4и NO3 соответственно сульфатное и нитратное дыхание). Дыхание анаэробное осуществляется сульфатредуцирующими и… … Экологический словарь
Дыхание анаэробное — энергетический процесс окисления микроорганизмами органических веществ в анаэробных условиях, при котором конечными акцепторами электронов являются нитраты, нитриты (см. денитрификация и нитратное дыхание), сульфаты (см. десульфатация) … Толковый словарь по почвоведению
дыхание нитратное — см. денитрификация. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
дыхание анаэробное — способ получения энергии микроорганизмами в бескислородных условиях, при котором осуществляется фосфорилирование в дыхательной цепи, но в качестве терминального акцептора электронов (водорода) микроорганизмы используют нитрат–ион, сульфат–ион, S0 … Словарь микробиологии
Дыхание нитратное — разновидность дыхания анаэробного, осуществляемого некоторыми микроорганизмами. Заключается в окислении органических веществ с помощью кислорода нитратов. При этом нитраты восстанавливаются до нитритов, газообразных форм азота (см.… … Толковый словарь по почвоведению
Анаэробное дыхание — Анаэробное дыхание биохимический процесс окисления органических субстратов или молекулярного водорода с использованием в дыхательной ЭТЦ в качестве конечного акцептора электронов вместо O2 других окислителей неорганической или органической… … Википедия
анаэробное дыхание — см. дыхание анаэробное. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) Анаэробное дыхание совокупность анаэробных экзотермических процессов разложения органических веществ, при котором акцептором отнятого от… … Словарь микробиологии
денитрификация — микробиол. процесс восстановления окисленных соединений азота (нитратов, нитритов) до газообразных продуктов (обычно до N2, иногда до N2O, редко до N0). Происходит в результате жизнедеятельности бактерий родов Pseudomonas, Bacillus, Paracoccus и… … Словарь микробиологии
нитратредуктаза — молибденсодержащий фермент, катализирующий восстановление нитрата до нитрита в процессе ассимиляции нитрата (ассимиляционной нитрат–редукции) растениями, грибами, бактериями. Фермент находится в цитоплазме клетки, его синтез индуцируется в том… … Словарь микробиологии
нитратредукция — восстановление нитратов до аммиака или N2 в процессе жизнедеятельности организмов. Ассимиляционная Н. осуществляется прокариотами, эукариотами в процессе усвоения нитрата в качестве источника азота для синтеза азотсодержащих клеточных компонентов … Словарь микробиологии
Изучены 2 простые схемы десульфатора батареи
В этой статье мы исследуем 2 простые, но мощные схемы десульфатора батареи, которые можно использовать для эффективного удаления и предотвращения десульфатации в свинцово-кислотных батареях. Первый метод использует импульсы ШИМ, а второй метод реализует обычный мостовой выпрямитель для того же.
Сульфатирование в свинцово-кислотных аккумуляторах является довольно распространенным явлением и представляет собой большую проблему, поскольку этот процесс полностью снижает эффективность аккумулятора.Считается, что зарядка свинцово-кислотной батареи с помощью метода ШИМ инициирует десульфатацию, помогая восстановить эффективность батареи до некоторых уровней.
Что такое сульфатирование в свинцово-кислотных аккумуляторах
Сульфатирование — это процесс, при котором серная кислота, присутствующая в свинцово-кислотных аккумуляторах, со временем реагирует с пластинами с образованием слоев белого порошка, подобного веществу, над пластинами.
Этот слой отложений серьезно ухудшает химические процессы внутри батареи во время зарядки или разрядки, делая батарею неэффективной с ее способностью передавать энергию.
Обычно это происходит, когда аккумулятор не используется в течение длительного времени, а процессы зарядки и разрядки выполняются не очень часто.
К сожалению, не существует эффективного способа решения этой проблемы, однако было исследовано, что застрявшие отложения серы на поврежденной батарее могут быть в некоторой степени разрушены путем воздействия на батарею сильноточных импульсов во время ее зарядки.
Эти сильноточные зарядные импульсы должны быть хорошо оптимизированы с помощью некоторой схемы управления и должны тщательно диагностироваться при реализации процесса.
1) Использование ШИМ
Реализация метода через схему с ШИМ-управлением, вероятно, лучший способ сделать это.
Вот отрывок из википедии, в котором говорится:
«Десульфатация достигается за счет сильноточных импульсов, возникающих между выводами батареи. Этот метод, также называемый импульсным кондиционированием, разрушает кристаллы сульфата, которые образуются на пластинах батареи. • Короткие сильноточные импульсы, как правило, работают лучше всего. Электронные схемы используются для регулирования импульсов различной длительности и частоты сильноточных импульсов.Их также можно использовать для автоматизации процесса, поскольку для полной десульфатации батареи требуется много времени ».
https://en.wikipedia.org/wiki/Talk%3ABattery_regenerator
Схема батареи с ШИМ Обсуждаемое здесь зарядное устройство можно рассматривать как лучшую конструкцию для выполнения вышеупомянутого процесса десульфатации.
Как работает схема
IC 555 конфигурируется и используется в стандартном режиме управления PWM.
Выходной сигнал IC соответствующим образом усиливается через пару транзисторов, так что он может подавать упомянутые сильноточные импульсы на батарею, которую необходимо десульфатировать.
ШИМ-регулирование может быть установлено на низкий коэффициент «отметки» для реализации процесса десульфатации.
И наоборот, если схема предназначена для использования для зарядки обычных аккумуляторов, ШИМ-регулятор может быть настроен для генерации импульсов с равными соотношениями метка / пространство или согласно желаемым спецификациям.
Управление ШИМ будет зависеть исключительно от личных предпочтений человека, поэтому должно выполняться правильно в соответствии с инструкциями производителя батарей.
Несоблюдение соответствующих процедур может привести к несчастному случаю со смертельным исходом из-за возможного взрыва аккумулятора.
Уровень входного тока, равный уровню AH батареи, может быть выбран изначально и постепенно уменьшаться, если обнаруживается положительный ответ от батареи.
2) Десульфатирование с помощью схемы трансформатора и мостового выпрямителя
Чтобы сделать этот простейший, но эффективный десульфатор аккумуляторной батареи со схемой зарядного устройства, вам просто потребуются трансформатор подходящего номинала и мостовой выпрямитель. Конструкция не только обессеривает аккумулятор, но и предотвращает возникновение этой проблемы в новых аккумуляторах и одновременно заряжает их до желаемого уровня.
В начале этого поста мы узнали, как десульфатировать, используя концепцию ШИМ, однако более глубокое исследование показывает, что процесс десульфатации батареи не обязательно требует точной схемы ШИМ, просто источник питания должен колебаться с определенной заданной скоростью, и этого достаточно, чтобы запустить процесс десульфатации (в большинстве случаев) … при условии, что батарея все еще находится в диапазоне отверждения и не выходит за пределы состояния восстановления.
Итак, что вам нужно, чтобы сделать эту сверхпростую схему десульфатора батареи, которая также будет заряжать данную батарею и, кроме того, обладать способностью предотвращать развитие проблемы сульфатирования в новых батареях?
Трансформатор подходящего номинала, мостовой выпрямитель и амперметр — все, что нужно для этой цели.
Номинальное напряжение трансформатора должно быть примерно на 25% выше номинального напряжения батареи, то есть для батареи 12 В на клеммах батареи может подаваться напряжение от 15 до 16 В.
Ток может быть приблизительно равен номиналу Ач батареи для тех, которые необходимо восстановить и которые сильно сульфатированы, для хороших аккумуляторов ток зарядки может составлять примерно 1/10 или 2/10 их номинала Ач. Мостовой выпрямитель должен быть рассчитан в соответствии с указанными или рассчитанными уровнями заряда.
Схема десульфатора с использованием мостового выпрямителя
Принцип работы мостового выпрямителя в качестве десульфатора
На приведенной выше диаграмме показаны минимальные требования к предлагаемому десульфатору батареи со схемой зарядного устройства.
Мы можем увидеть наиболее стандартную или, скорее, грубую настройку источника питания переменного тока в постоянный, где трансформатор понижает сетевое напряжение до 15 В переменного тока для указанной батареи на 12 В.
Прежде чем достичь клемм аккумулятора, 15 В переменного тока проходит процесс выпрямления через подключенный мостовой выпрямительный модуль и преобразуется в двухполупериодный 15 В постоянного тока.
При питании от сети 220 В частота перед мостом будет 50 Гц (стандартная спецификация сети), а после выпрямления предполагается, что она станет вдвое больше, чем при 100 Гц. Для входа 110 В переменного тока это будет около 120 Гц.
Это происходит из-за того, что мостовая сеть инвертирует нижние полупериоды пониженного переменного тока и объединяет их с верхними полупериодами, чтобы в итоге получить пульсирующий постоянный ток 100 или 120 Гц.
Именно этот пульсирующий постоянный ток становится ответственным за встряхивание или сбивание сульфатных отложений на внутренних пластинах конкретной батареи.
Для хорошей батареи это импульсное зарядное устройство с частотой 100 Гц гарантирует, что сульфатирование прекращается в первую очередь, и, таким образом, помогает удерживать пластины относительно свободными от этой проблемы.
Вы также можете увидеть амперметр, подключенный последовательно к входу питания, он обеспечивает прямую индикацию потребления тока батареей и обеспечивает «живое обновление» процедуры зарядки, а также то, может ли происходить что-либо положительное.
Для хороших аккумуляторов это предоставит информацию от начала до конца, касающуюся процесса зарядки, то есть первоначально стрелка измерителя будет указывать указанную скорость зарядки аккумулятора, и можно ожидать, что постепенно она опустится до нулевой отметки, и это когда необходимо отключить зарядное устройство.
Можно использовать более сложный подход для включения автоматического отключения после полной зарядки аккумулятора с помощью схемы автоматического отключения полного заряда аккумулятора на базе операционных усилителей (вторая диаграмма)
десульфатация: значение, происхождение, определение — WordSense Словарь
десульфатация (английский)
Альтернативные формы
Происхождение и история
От de- + сульфатированияСуществительное
десульфатирование ( пл. десульфатирование )- Удаление сульфата
Родственные слова и фразы
Практические примеры
Автоматически сгенерированные примеры:
« Сульфатирование и десульфатирование . »
Свинцово-кислотный аккумулятор — Википедия
« В зависимости от размера аккумулятора процесс десульфатации может занять от 48 от часов до недель для завершения. «
Регенератор батареи — Википедия
» Этот эффект сульфатирования в несульфатированных и переходных зонах также отличается от QSulfs, которые катализируют десульфатацию исключительно в S-доменах. «
SULF1 — Википедия
Записи с» десульфатацией «
десульфатации : десульфатирование (английский) Существительное десульфатирование Множественное число десульфатации
десульфатация : десульфатация (английский) Существительное десульфатация Альтернативная форма десульфатации (мн.
Поделиться
Примечания, добавленные пользователями
Для этой записи нет примечаний, добавленных пользователями.
Добавить примечание
Добавить примечание к записи «десульфатация».Напишите подсказку или пример и помогите улучшить наш словарь. Не просите о помощи, не задавайте вопросов и не жалуйтесь. HTML-теги и ссылки не допускаются.
Все, что нарушает эти правила, будет немедленно удалено.
Next
desulfations (английский) Существительное десульфатация Множественная десульфатация
десульфатогирудин (английский) Существительное десульфатогирудин (бесчисленное множество) desirudin
desulfhydrase (английский) Существительное десульфгидраза (мн.десульфгидразы) …
десульфгидразы (английский) Существительное десульфгидразы Множественное число десульфгидразы
десульфиназа (английский) Существительное десульфиназа (мн. десульфиназы) (фермент) …
десульфиназы (английский) Существительное десульфиназы Множественное число десульфиназы
desulfitobacteria (английский) Существительное десульфитобактерии Множество …
desulfitobacterium (английский) Происхождение и история От названия рода. Существительное …
desulfoferrodoxin (английский) Существительное десульфоферродоксин (бесчисленное множество) (белок) …
desulfoglucosinolate (английский) Существительное десульфоглюкозинолат (пл ….
десульфоглюкозинолаты (английский) Существительное десульфоглюкозинолаты Множественное число …
desulfonate (английский) Происхождение и история де- + сульфонат Глагол …
Аккумуляторная батарея для восстановления сульфатации
Аккумуляторная сульфатная регенерация Л. Дэвид Ропер
http: // www.roperld.com/personal/roperldavid.htm
Январь 2008
Цель данной статьи — упростить поиск информации о сульфатировании свинцово-кислотных аккумуляторов.
.
кристаллы сульфатирования PbSO 4
«На разработку процесса сульфатирования ушли недели или месяцы. Процесс десульфатации займет примерно столько же времени. Не ожидайте, что аккумулятор будет подвергнут десульфатированию сегодня, а завтра вернется в самолет.Я оставил батареи в этой системе на месяц, прежде чем был доволен конечным результатом ». Ref
«Импульсная технология ( настроена на молекулярную частоту кристалла серы 3,26 МГц . … точка, в которой химические связи, которые удерживают молекулы вместе, образуя кристалл, могут быть разорваны.) Позволяет пользователю электронное растворение сульфатирования обратно в раствор электролита, не выводя аккумулятор из эксплуатации. Самое главное, что при регулярном использовании Pulse Technology помогают держать свинцовые пластины свободными и чистыми от кристаллов сульфата, позволяя ему работать беспрепятственно на полную мощность вместимость.В этом процессе выделяется мало тепла или не происходит его вообще (для «выкипания» кислоты), и он никоим образом не может повредить саму батарею. … Не каждая батарея является кандидатом на повторное кондиционирование из-за механического повреждения, вызванного вибрацией или загрязнением, которое привело к «закороченным» элементам. Если 12-вольтная батарея имеет напряжение покоя не менее 10,5 В и ни одна из 6 ячеек не закорочена, десульфатация ее пластин может быть выполнена. … Часто к тому времени, когда авиационная батарея не проходит испытание под нагрузкой из-за сульфатирования, пластины батареи сильно эродируются, и материалы пластин опускаются на дно батареи.Это происходит потому, что пластины изготавливаются с высокой пористостью (как кусок швейцарского сыра), чтобы максимизировать площадь поверхности и обеспечивать максимальный разряд тока в течение короткого периода времени, например. запуск двигателя вашего самолета). Это позволяет сконструировать компактную батарею с кратковременной высокой нагрузочной способностью. Сульфат проникает в поры пластин и по мере перехода к кристаллическому состоянию значительно расширяется. Рост кристаллов заставляет пластинчатый материал1 отламываться почти так же, как образование льда в трещине в горной породе вызывает отламывание кусков породы…. Десульфация — это не ночной процесс. Чем больше площадь пластины и / или чем больше присутствует сульфатирование, тем больше времени требуется для ее удаления, просто. … Типичный процесс десульфатирования может занять несколько недель (или больше) для более крупных батарей, при одновременном использовании нескольких батарей и для батарей с сильным сульфатированием. Вот почему многие пользователи покупают более одного устройства, чтобы эффективно обрабатывать / кондиционировать более одной батареи в любой момент времени. Повторное кондиционирование десульфатации рекомендуется каждые несколько месяцев в зависимости от температуры батареи, периодов простоя и т. Д.»Ссылка
(PDF) Десульфатация свинцово-кислотных аккумуляторов высокочастотным импульсом
Десульфатация свинцово-кислотных аккумуляторов
высокочастотными импульсами
Вуттибхат Джамратнау
Кафедра электроники и компьютерных технологий
Факультет промышленных технологий
Лоэй Раджаб University, Loei 42000 Таиланд
Резюме. Свинцово-кислотные батареи
широко используются в промышленности из-за их высокой эффективности и низкой стоимости.Одним из основных недостатков свинцово-кислотных аккумуляторов
является сульфатирование, которое снижает эффективность
аккумуляторов. Сульфат приводит к более высокому внутреннему сопротивлению
и снижению емкости. В данной статье представлена десульфатация свинцовых кислотных аккумуляторов
с использованием высокочастотного импульса. Результаты показали
, что после того, как свинцово-кислотная батарея была заряжена высокочастотным импульсом
, батарея имела более низкое внутреннее сопротивление.Напряжение полностью заряженной батареи
и ток холодного пуска были выше,
, что привело к лучшей производительности батареи.
Ключевые слова: компонент; свинцово-кислотная батарея; десульфатор; управление зарядным устройством
I. ВВЕДЕНИЕ
Экологическая проблема является серьезной проблемой, с которой в настоящее время сталкивается мир
, например, глобальное потепление или стихийные бедствия
. Люди больше обеспокоены и осознают важность окружающей среды
для их жизни.В результате, как и многие экологические проекты
, зеленая энергия также была принята во внимание [1].
Солнечная электроэнергия — пример зеленой энергии. Использование солнечной энергии
для производства электроэнергии в настоящее время популярно
, потому что это чистое и экологически безопасное оборудование. Однако ограничение
солнечной электроэнергии является ее нестабильным производством, потому что
энергия не может производиться в ночное время. Следовательно,
для непрерывного и стабильного использования солнечной энергии необходимо
для накопления энергии, то есть батареи.Батареи популярны с солнечными элементами
, в основном свинцово-кислотными батареями из-за их высокой эффективности
, низкой стоимости и способности обеспечивать высокие импульсные токи,
, что означает, что элементы имеют относительно большую мощность —
весовое соотношение. Тем не менее, основной проблемой, которая может возникнуть в свинцово-кислотных аккумуляторах
, является сульфат, который возникает из-за неправильной зарядки и разрядки
. Сульфат приводит к снижению эффективности
батарей, более высокому внутреннему сопротивлению, небольшой доле нормального тока разряда
, увеличению времени зарядки, неполной зарядке
, повышению температуры батареи и т. Д.Существует
различных методов десульфатации, например, химический процесс
, отвечающий за функцию свинцово-кислотных аккумуляторов, имеет
нескольких конкурирующих химических процессов, протекающих в элементе. Наиболее знакомый и желательный процесс
— это производство электрического тока
за счет ионного обмена в кислотных электролитохимических и электрических методах
[2,3,4].
Эта статья была нацелена на разработку десульфатации свинцово-кислотных аккумуляторов
с помощью высокочастотного импульса, при котором высокочастотные напряжения посылали в аккумулятор
.Частота напряжений была равна
, что резонансная частота молекулы сульфата вызывала колебания
в молекулах сульфатной соли, заставляя молекулы сульфата
возвращаться в раствор сернокислого электролита.
II. СВИНЦОВО-КИСЛОТНАЯ БАТАРЕЯ
A. Принцип работы свинцово-кислотных аккумуляторов [2]
Принцип работы, по сути, представляет собой химическую реакцию.
Показано:
𝑃𝑏𝑂 + 2𝐻𝑆𝑂 + 𝑃𝑏 ⇌ 2 + 2
Когда аккумулятор находится в разряженном состоянии, активные материалы
положительного электрода, диоксид свинца, будут преобразованы в сульфат свинца
.Точно так же отрицательный электрод, который состоит из свинца
, также будет преобразован в сульфат свинца. Электролит, серная кислота
, будет израсходован при взаимодействии с активными материалами
. Уравнения электродных реакций положительного электрода
и отрицательного электрода в разряженном состоянии показаны ниже
.
Положительный: 𝑃𝑂 + 4𝐻 + 2𝑒⇌ 𝑃𝑏 + 2𝐻𝑂
Отрицательный: 𝑃𝑏 ⇌ 𝑃𝑏 + 2𝑒
Когда аккумулятор находится в состоянии зарядки, сульфат свинца будет
. преобразованы обратно в активные материалы.
Положительный: 𝑃𝑏𝑆𝑂 + 2𝐻𝑂 ⇌ 𝑃𝑏𝑂 + 𝐻𝑆𝑂
+ 3𝐻 + 2𝑒
Отрицательный: 𝑃𝑏𝑆𝑂 + 𝐻⇌ 𝑃𝑏 + 𝐻𝑆𝑂
Теоретически свинцово-кислотный батарея может использоваться в течение очень длительного времени
, если уравнение химической реакции, показанное в уравнении (1), может полностью протекать. Показано, что химическая реакция
, протекающая в свинцово-кислотных аккумуляторах, в какой-то мере обратима. Как результат
, сульфат свинца будет постепенно кристаллизоваться и осаждаться на
электродах.Это явление известно как сульфатирование. Это
обычно приводит к короткому сроку службы свинцово-кислотных аккумуляторов [5].
B. Сульфатирование [6]
Когда свинцово-кислотные батареи подвергаются недостаточной
зарядке во время нормальной работы, они препятствуют перезарядке;
сульфатных отложений в конечном итоге расширяются, растрескивая пластины, а
разрушают аккумулятор. В конце концов, настолько большая часть аккумуляторной пластины
не может подавать ток, что емкость аккумулятора составляет
978-1-4673-9749-0 / 16/31 доллар США.00 © 2016 IEEE
Определение десульфатации и синонимы десульфатации (английский)
Из Википедии
Десульфатация — это процесс обращения вспять процесса сульфатирования, который происходит в свинцово-кислотной батарее с течением времени. Десульфатация восстанавливает, по крайней мере частично, способность аккумулятора удерживать заряд в течение срока службы аккумулятора, первоначально вызванного сульфатацией (см. Сульфатирование). В конце концов эта проблема возрастает до тех пор, пока аккумулятор не теряет значительную способность работать должным образом.
Десульфатация — один из основных способов решения некоторых из наиболее сложных проблем, связанных с сульфатированием. Десульфатация достигается за счет сильноточных импульсов, возникающих между выводами батареи. Этот метод, также называемый импульсным кондиционированием, разрушает кристаллы сульфата, которые образуются на пластинах батареи.
Сульфатирование — это естественный процесс, который происходит во всех свинцово-кислотных аккумуляторах, но может происходить значительно быстрее при неправильном сочетании температуры, плохой технике зарядки, длительном неиспользовании аккумулятора и т. Д.
Методы десульфатирования
Температура влияет как на десульфатирование, так и на сульфатирование, увеличивая скорость изменения каждого из них. Например, батарея с более высокой температурой быстрее десульфатируется или сульфатируется. Существуют ограничения, и слишком большое количество тепла может повредить аккумулятор (см. «Необратимые повреждения» ниже).
Оборудование, такое как таймер 555, устройство STAMP и микроконтроллеры, можно использовать для регулирования импульсов разной длительности и частоты этих сильноточных импульсов. Их также можно использовать для автоматизации процесса, поскольку для полной десульфатирования батареи требуется длительный период времени.
Как правило, лучше всего работают короткие сильноточные импульсы.
Постоянное повреждение
Несколько невосстановимых симптомов батареи включают:
- Потеря свинцового материала на пластинах
- Пластины физически погнуты из-за экстремальных температур и чрезмерной зарядки
Заряженные батареи с напряжением покоя ниже 8 В весьма подозрительны. быть неисправимым.
Признаки
Батареи, которые не использовались долгое время, могут быть основными кадидатами для десульфатации.Длительные периоды простоя приводят к тому, что аккумулятор подвергается сульфатированию. Некоторые типичные случаи, когда свинцово-кислотные батареи используются недостаточно часто, — это самолеты, лодки (особенно парусные лодки), старые автомобили и домашние энергосистемы с батареями, которые используются недостаточно.
Батареи с заметным сульфатированием могут иметь следующие признаки:
- высокое внутреннее сопротивление
- низкое напряжение питания
Если возможно, иногда можно увидеть белый налет на пластинах (например, батареи с прозрачными корпусами).
Power
Обычно требуется диод для защиты выводов зарядного устройства от неправильного подключения проводов. Некоторые методы зарядки могут помочь в предотвращении, например выравнивающая зарядка и регулярные циклы разрядки и зарядки. Для правильной зарядки рекомендуется следовать инструкциям производителя аккумулятора.
SLI против Deep Cycle
SLI аккумуляторы (то есть автомобильные аккумуляторы) имеют меньший износ, потому что они используются чаще, чем аккумуляторы глубокого разряда.Батареи глубокого цикла, как правило, требуют большего обессеривания, могут страдать от перезарядки и могут находиться в очень большом банке, что приводит к неравномерной зарядке и разрядке.
Ссылки
- Десульфатор свинцово-кислотных аккумуляторов (Home Power # 77 июнь / июль 2000 г.) [1]
- Сульфатирование пластин аккумулятора (MagnaLabs) [2]
- Десульфатирование аккумуляторов [3]
- Свинцово-кислотные аккумуляторы [4]
- Десульфатация батареи — Проекты [5]
- Источник постоянного тока! (Апрель 2002 г.) [6]
- Некоторые технические подробности о свинцово-кислотных аккумуляторах [7]
Химическая структура и биоактивность сульфатированных полисахаридов из морских водорослей
Abstract
Сульфатированные полисахариды и их олигосахаридные производные с более низкой молекулярной массой из морских макроводорослей имеют было показано, что они обладают разнообразной биологической активностью.В настоящем документе рассматривается недавний прогресс в исследованиях структурной химии и биоактивности этих биоматериалов морских водорослей. В частности, он предоставит обновленную информацию о структурной химии основных сульфатированных полисахаридов, синтезируемых морскими водорослями, включая галактаны (например, агараны и каррагинаны), ульваны и фуканы. Затем будет проведен обзор последних данных об антикоагулянтной / антитромботической, противовирусной, иммуновоспалительной, антилипидемической и антиоксидантной активности сульфатированных полисахаридов и их потенциале для терапевтического применения.
Ключевые слова: сульфатированный полисахарид, морские макроводоросли, углеводная структура, биоактивность, олигосахариды
1. Введение
Многие виды морских водорослей (морские макроводоросли) используются в пищу, и они также нашли применение в традиционной медицине из-за того, что воспринимаются польза для здоровья. Морские водоросли являются богатыми источниками сульфатированных полисахаридов, в том числе некоторых из них, которые стали ценными добавками в пищевой промышленности из-за их реологических свойств в качестве гелеобразующих и загустителей (например,g., каррагинан). Вдобавок признано, что сульфатированные полисахариды обладают рядом биологических активностей, включая антикоагулянтную, противовирусную и иммуновоспалительную активность, которые могут найти значение для нутрицевтических / функциональных пищевых продуктов, косметических / космецевтических и фармацевтических применений.
В этом обзоре мы рассмотрим текущий прогресс в исследованиях сульфатированных полисахаридов, касающихся их структурного разнообразия, биоактивности и механизмов действия. В литературе содержится обширная информация о структуре и биоактивности морских сульфатированных полисахаридов, которые не могут быть полностью рассмотрены в этом кратком обзоре.Есть несколько отличных обзоров, в которых читатель может найти дополнительную информацию по различным аспектам этой темы [1,2,3,4,5,6,7,8,9].
2. Структурное разнообразие сульфатированных полисахаридов водорослей
2.1. Каррагинаны и агараны из красных водорослей
Галактаны красных морских водорослей имеют большое коммерческое значение, поскольку они широко используются в пищевой промышленности из-за их реологических свойств в качестве гелеобразователей и загустителей. Эти сульфатированные полисахариды в первую очередь классифицируются как агараны и каррагинаны на основе их стереохимии, в частности, галактаны с 4-связанными остатками α-галактозы L-серии называются агаранами, а группы D-серии — каррагенами [10].Таким образом, каррагинаны представляют собой высокомолекулярные сульфатированные D-галактаны, состоящие из повторяющихся дисахаридных единиц с чередующимися 3-связанными β-D-галактопиранозными (G-единицами) и 4-связанными α-галактопиранозами (D-единицы) или 3,6-ангидро- α-галактопираноза (AnGal-единицы).
Каррагинаны обычно классифицируют в соответствии с их структурными характеристиками, включая характер сульфатирования и наличие или отсутствие AnGal на D-единицах. Существует не менее 15 различных структур каррагинана [2]. Наиболее промышленно значимыми каррагинанами являются формы κ, ι и λ, структура которых проиллюстрирована на рис.Основным источником κ-каррагинана являются красные водоросли Kappaphycus alvarezii [11]. Его структура представлена чередующимися 3-связанными β-D-галактозо-4-сульфатными и 4-связанными звеньями AnGal [12]. Ι-каррагинаны имеют дополнительную сульфатную группу на C2 (O) остатка AnGal, что дает два сульфата на повторяющееся звено дисахарида. Funami et al. исследовал ι-каррагинан, экстрагированный из Eucheuma spinosum , с помощью атомно-силовой микроскопии и предположил, что ι-каррагинаны были более гомогенными и гибкими, чем κ-каррагинаны [13].Λ-каррагинаны имеют три сульфатные группы на дисахаридную единицу с третьей сульфатной группой этой формы в положении C6 4-связанного остатка, но на 4-связанных остатках отсутствует 3,6-ангидридный мостик. Лямбда-каррагинан получают из видов родов Gigartina и Chondrus [14].
Альтернативные формы каррагинана могут быть получены путем химической модификации. Например, образование ангидридного мостика в λ-каррагенане может быть вызвано модификацией щелочью с образованием θ-каррагинана ().Экстракция λ-каррагинана из сортированных вручную тетраспорофитов Gigartina skottsbergii и последующая обработка экстракта щелочным боргидридом приводили к превращению 4-связанных остатков в форму 3,6-ангидридного кольца с образованием θ-каррагенана без детектирования. загрязнение κ- или ι-каррагинанами [15].
Природные каррагинаны обычно встречаются в виде смесей различных типов гибридов, таких как κ / β-гибриды [16], κ / ι-гибриды [17,18,19,20], κ / μ-гибриды [21] или ν / ι-гибриды [22].Кроме того, составляющие ацеталь метил- или пировиноградной кислоты и присутствие небольшого количества других сахаров могут усложнять структуру [23].
Рис. 1
Повторяющиеся дисахаридные единицы различных типов каррагинана и их преобразование обработкой щелочью.
Одним из наиболее изученных агаранов является порфиран [24], полученный из Porphyra, видов красных водорослей, включая Porphyra capensis [25] и P. haitanensis [26,27].Типичный порфиран демонстрирует линейную основу из чередующихся 3-связанных звеньев β-D-галактозы и 4-связанных звеньев α-L-галактозо-6-сульфата или 3,6-ангидро-α-L-галактозы. Сульфатированные агараны аналогичной линейной формы синтезируются видами Polysiphonia , такими как P. strictissima , P. abscissoides [28], P. nigrescens [29] и P. atterima [30] . Обычная основная цепь агарана может быть прервана различными O -связанными заменами в дополнение к сульфату, включая метильные и ксилозильные группы, что увеличивает структурное разнообразие.Например, Prado et al. недавно сообщил, что сульфатированный агаран из P. nigrescens сильно замещен на С-6 β-D-галактозы сульфатом, но также присутствовали остатки метилового эфира и β-D-ксилозы [29]. Агаран из Acanthophora spicifera сильно сульфатирован в положении C-2 β-D-галактозных единиц, при этом некоторые из остатков являются 4,6-пирувилированными [31]. Этот агаран также содержит небольшое количество остатков ксилозы и сульфатированной ксилозы [31,32].
Помимо каррагинанов и агаранов, существуют также сульфатированные полисахариды красных морских водорослей, которые имеют 4-связанные сахара D- и L-галактозы, распределенные в одних и тех же молекулах полисахаридов, так называемые DL-гибриды и другие с различными замещениями с участием сульфатных групп. , кетали пировиноградной кислоты и метоксильные группы [33].Действительно, нативные полисахариды редко бывают в своей однородной или «идеальной» форме. Например, мы недавно сообщили о существовании каррагинан-подобного сульфатированного галактана из Furcellaria lumbricalis , состоящего из единиц κ / β-каррагинана, несульфатированных единиц галактана, а также более мелких единиц, содержащих 3- O -метилгалактозу. [16]. Другим примером неидеальных сульфатированных галактанов являются ксилогалактаны, впервые описанные в красных морских водорослях Corallina officinalis и названные кораллинаном [34] , , которые представляют собой агараны, которые имеют β-D-ксилозильные группы, присоединенные в положении O -6. единиц D-галактозы [35,36,37].
Следует отметить, что красные водоросли также производят другие типы сульфатированных полисахаридов, включая те, в основе которых лежит манноза [38,39]. Например, Mandal et al. описал ксиломаннан из Scinaia hatei , состоящий в основном из каркаса α- (1 → 3) -связанных остатков D-маннозы, замещенных у C-6, C-4 и C-2 остатками β-D-ксилозила [39 ].
2.2. Сульфатированные полисахариды из зеленых водорослей
Ulvan — это основной водорастворимый полисахарид, обнаруженный в зеленых водорослях порядка Ulvales ( Ulva и Enteromorpha sp.), который содержит сульфат, рамнозу, ксилозу, идуроновую и глюкуроновую кислоты в качестве основных компонентов [40,41]. Согласно обзору Lahaye и Robic, структура ульвана демонстрирует большую сложность и вариабельность, о чем свидетельствуют многочисленные повторяющиеся структурные единицы олигосахаридов, идентифицированные в нативных и химически модифицированных препаратах ульвана [3]. Сообщается, что основными повторяющимися дисахаридными единицами являются типы 3-сульфатов ульванобиуроновой кислоты, содержащие глюкуроновую или идуроновую кислоту (). Кроме того, сообщалось о минорных повторяющихся единицах, которые содержат сульфатированную ксилозу, заменяющую уроновую кислоту или глюкуроновую кислоту в качестве ответвления на O -2 рамноза-3-сульфата [40,42].
Рисунок 2
Основные повторяющиеся дисахаридные единицы ульвана. A. [→ 4) -β-D-Glc p — (1 → 4) -α-L-Rha p 3S- (1 →] n ; B. [→ 4) -α-L -Ido p — (1 → 4) -α-L-Rha p 3S- (1 →] n .
Хотя наиболее распространенным источником сульфатированных галактанов являются красные макроводоросли, некоторые зеленые водоросли, особенно Виды Codium являются важным источником сульфатированных галактанов [43,44,45]. Сульфатированные галактаны из зеленых водорослей имеют тенденцию быть более сложными и неоднородными по структуре, чем их аналоги из красных водорослей.Например, C. fragile и C. cylindricum содержат сульфатированный арабиногалактан и сульфатированный глюкогалактан соответственно [43,46]. Билан и др. сообщил о сильно разветвленном сульфатированном галактане из C. yezoense , который содержит линейную основу из 3-связанных остатков β-D-галактопиранозы, содержащих короткие олигосахариды, ответвляющиеся через (1 → 6) связи [47]. Сульфатные группы были обнаружены в основном у С-4 и в незначительных количествах — у С-6. Сообщалось о полисахаридах, содержащих сульфатированные галактаны из других зеленых морских водорослей, включая Caulerpa и Ulva [48,49], но галактаны являются второстепенными компонентами.
Множество других форм сульфатированных полисахаридов синтезируются зелеными водорослями [41,50,51,52,53]. Это включает, например, водорастворимый гетерогликуронан из Enteromorpha compressa , состоящий из (1 → 2,4) -связанной рамнозы, (1 → 4) -связанной ксилозы и (1 → 4) -связанных единиц глюкуроновой кислоты. [52]. Сульфатные группы, если они присутствовали, были расположены у С-3 рамнозы и С-2 ксилозы. Недавно было показано, что сульфат рамнана из Monostroma nitidum состоит в основном из α-1,3-связанных и α-1,2-связанных остатков рамнозы [51].
2.3. Фукозосодержащие сульфатированные полисахариды бурых водорослей
Фуканы представляют собой сульфатированные полисахариды, которые состоят из основной цепи фукозы. Одним из наиболее изученных фуканов из бурых водорослей является фукоидан, который впервые был выделен Килиным в 1913 г. [54]. Фукоидан из Fucus vesiculosus коммерчески доступен в течение десятилетий (Sigma-Aldrich Chemical Company, Сент-Луис, Миссури, США). Ранние исследования его структуры показали, что он содержит в основном (1 → 2) связанные 4- O -сульфатированные остатки фукопиранозы [55].Однако впоследствии сообщалось, что 3-связанная фукоза с 4-сульфатированными группами присутствует на некоторых остатках фукозы [56]. Кроме того, было определено, что он содержит ответвления через каждые 2-3 остатка фукозы. Эти ранние структуры фукоидана из F. vesiculosus проиллюстрированы на. Впоследствии Chevolot и его коллеги сообщили, что фукоидан из F. vesiculosus и Ascophyllum nodosum содержит преобладающий дисахаридный мотив, содержащий сульфат в положении 2 3-связанной фукозы и сульфатные группы в положениях 2 и 3 4-связанной фукозы [57].
Рисунок 3
Структура фукоидана, полученного из F. vesiculosus Персивалем ( A ) [55] и Патанкаром ( B ) [56].
Фуканы могут различаться по структуре у разных видов водорослей и могут различаться даже в пределах одного и того же вида. Из-за неоднородности структур морских водорослей, различные условия экстракции, используемые исследователями, могут привести к выделению различных форм фукана [4]. Фуканы были разделены на две группы [58]. В одну группу входят фуканы из Laminaria saccharina , L.digitata , Analipus japonicus , Cladosiphon okamuranus и Chorda filum , центральные цепи которых состоят из (1 → 3) -связанных остатков α-L-фукопиранозы. Вторая группа включала фуканы, выделенные из видов Ascophyllum nodosum и Fucus , центральные цепи которых составлены из повторяющихся (1 → 3) — и (1 → 4) -связанных остатков α-L-фукопиранозы. Однако многие исследования выявили более сложные фуканы, некоторые из которых имеют разветвленную структуру.Было показано, что фукоидан, выделенный из Turbinaria conoides , является очень сложным, с 33-34% концов, 27-28% связанных и 21-22% разветвленных в (1 → 3) -связанной основной цепи [59]. Типичные структуры фукана показаны на.
Таблица 1
Репрезентативные структуры фуканов из бурых водорослей.
| Виды | Структуры фукоидана | Каталожный номер |
|---|---|---|
| Analipus japonicus | 3 (4Fuc 1 p (1 p ) → 3) -α-L-Fuc p (2 / 4SO 3 —) остатки | Bilan et al., 2007 [60] |
| Ascophyllum nodosum | → 3) -α-L-Fuc p (2SO 3 — ) — (1 → 4) -α-L-Fuc p (2,3-diSO 3 — ) — (1 → | Chevolot и др. , 2001 [57] |
| A. nodosum | (1 → 3) -α -L-Fuc p и несколько (1 → 4) -α-L-Fuc p с (1 → 3) -α-L- (2 и / или 4 Fuc p ) | Marais и др., , 2001 [61] |
| Нить хорды | — [→ 3) -α-L-Fuc p — (1-] 3 → 3) -α-L-Fuc p (2Fuc p ) — (1 → | Чижов и др., 1999 [62] |
| Fucus distichus L. | → 3) -α-L-Fuc p — (2,4-diSO 3 — ) — (1 → 4) -α-L-Fuc p — (2SO 3 — ) — (1 → | Билан и др. , 2004 [63] |
| F. evanescens | → 3) -α-L-Fuc p (2SO 3 —) — (1 → 4) -α-L-Fuc p (2SO 3 —) — (1 → | Билан и другие., 2002 [64] |
| F. serratus L | → 3) -α-L-Fuc p (2R 1 , 4R 2 ) — (1 → 4) -α- L-Fuc p (2SO 3 — ) — (1 → | Билан и др. , 2006 [65] |
| (~ 50%): R 1 = SO 3 — , R 2 = H | ||
| (~ 50%): R 1 = H, R 2 = α-L-Fuc p — (1 → 4) -α- L-Fuc p (2SO 3 —) — (1 → 3) -α-L-Fuc p (2SO 3 —) — (1 → | ||
| Laminaria saccharina | → 3) -α-L-Fuc p (4SO 3 —) — (1 → и дополнительно → 3) -α-L-Fuc p (4SO 3 — или 2Fuc p ) — (1 → | Usov et al., 1998 [66] |
| Stoechospermum marginatum | → 3) -α-L-Fuc p (2 / 4SO 3 — ) — (1 → и | Adhikari 905 . , 2006 [67] |
| → 4) -α-L-Fuc p (2SO 3 — ) — (1 → |
Многие фуканы бурых водорослей содержат небольшие количества другие моносахариды, включая глюкозу [68], галактозу [69], маннозу [70,71,72], ксилозу [69,73], уроновые кислоты [68,74], а также ацетильные группы [75].
3. Подходы к структурному анализу сульфатированных полисахаридов водорослей
3.1. Десульфатирование и метилирование для анализа структуры
Анализ структуры сульфатированных полисахаридов требует определения присоединенных сложных эфиров сульфатов вдоль их основных цепей и типов гликозидных связей. Метилирование используется для определения связей между монсахаридами. Путем сравнения метилирования природных полисахаридов с метилированием их десульфатированных аналогов можно определить положения сульфатных групп.Таким образом, гидролиз перметилированных десульфатированных полисахаридов дает частично метилированные моносахариды, которые после ацетилирования разделяются и идентифицируются с помощью газовой хроматографии / масс-спектров [76].
Для точного определения структуры требуется десульфатация полисахарида без расщепления связей цепи полисахарида. Часто используется процедура сольволитической десульфатирования, при которой полисахарид в виде соли пиридиния нагревают в диметилсульфоксиде [47,77,78]. Десульфатирование фукоидана метилсульфоксид-пиридином происходит быстро и полностью, что приводит к более высоким выходам при небольшом разложении.Однако метод с использованием хлортриметилсилана (ХТМС) для обработки солей пиридиния более подходит для десульфатирования сульфатированных галактанов как семейства агаранов, так и каррагинанов [79]. Другие подходы к десульфатированию, которые использовались, включают метанольный хлористый водород [80], силилирующие реагенты [81] и пиромеллитовую кислоту [82]. Химическая десульфатация относительно неспецифична и обычно приводит к значительной потере материала пробы. Использование сульфатаз представляет собой более специфический подход к десульфатированию и может быть полезным в структурных исследованиях, однако такие ферментативные подходы, по-видимому, не являются частым методом выбора [7,83].Причина этого неясна, но может быть связана с отсутствием коммерчески доступных ферментов требуемой специфичности.
Типичная процедура метилирования проста и включает обработку образца десульфатированного полисахарида метилиодидом в присутствии твердого основания, обычно гидроксида натрия, в метилсульфоксиде, и процедуру можно повторить для получения полного метилирования [51,62,77, 84,85].
3.2. Структурный анализ с использованием ЯМР и MS
Мощным инструментом для выяснения структуры сульфатированных полисахаридов является ЯМР-спектроскопия, которая может предоставить структурные детали, такие как компоненты моносахаридов, связи, аномерные конфигурации и положения разветвлений или сульфатий.Это можно сделать, комбинируя различные методы 1D и 2D-ЯМР. ЯМР широко используется в структурном анализе галактанов красных водорослей и ульванов зеленых водорослей [3,86]. Частично это было связано с относительно высокой долей повторяющихся последовательностей (идентичный характер сульфатирования) в этих полисахаридах, что делает их пригодными для анализа с помощью 13 C-ЯМР. Например, Гонсалвес и его коллеги описали структурное выяснение с помощью ЯМР позиционных изомеров сульфатированных олигосахаридов, полученных из агаранов и каррагинанов [87].Это повлекло за собой частичный восстановительный гидролиз с образованием олигосахаридов из повторяющихся галактанов с последующим разделением анионообменной и гель-фильтрационной хроматографией перед 1D и 2D ЯМР анализом.
Также были предприняты попытки выяснить структуру фуканов с помощью ЯМР. Усов и др. с помощью 1D-ЯМР обнаружил, что сульфатированные фуканы из Saccharina latissima (ранее Laminaria saccharina ) представляют собой 1 → 3 связанную α-L-фукопиранозу с сульфатной группой у C4 и разветвленные у C2 [66].Совсем недавно они подтвердили сложную структуру этого фукоидана более детальным структурным исследованием с помощью 2D-ЯМР [88]. Эти исследования также выявили наличие трех дополнительных типов сульфатированных полисахаридов, фукогалактана, фукоглюкуронаннана и фукоглюкуронана, которые, по-видимому, присутствуют в незначительных количествах при их получении.
Масс-спектрометрия (МС) полезна при структурном анализе полисахаридов, поскольку она генерирует точные данные о молекулярной массе олигосахаридов, а также может предоставить информацию о последовательности.По сравнению с другими аналитическими методами, масс-спектрометрические методы имеют ряд преимуществ, включая низкий расход образца (например, количество пикомолей) и короткое время анализа. Хотя анализ сульфатированных полисахаридов с помощью МС может быть проблематичным из-за лабильного характера сульфатных групп, подходы, основанные на ионизации электрораспылением и матричной лазерной десорбции / ионизации (MALDI), все чаще разрабатываются для характеристики сульфатированных олигосахаридов [89, 90, 91 , 92]. ESI-CID-MS / MS с отрицательными ионами использовали для характеристики олигосахаридных фрагментов, полученных в результате мягкого гидролиза κ-каррагинана, который выявил высокоупорядоченные дисахаридные повторы, ведущие к полной серии олигосахаридов с исключительно нечетными номерами [92].Аналогичным образом, фукановые олигосахариды из A. nodosum , включая высокосульфатированный пентасахарид, были успешно проанализированы с помощью ESI-MS с отрицательными ионами [89].
3.3. Чрезмерное сульфирование полисахаридов водорослей
Модификация структуры сульфатированных полисахаридов, такая как десульфатирование, избыточное сульфатирование, ацетилирование и бензоилирование, позволит разработать новые и, возможно, более эффективные производные природных полисахаридов [93,94,95]. Например, бензоилированные производные нативного ульвана из Ulva pertusa обладают повышенными антиоксидантными свойствами [94].Конечно, наиболее частой структурной модификацией сульфатных полисахаридов является избыточное сульфатирование из-за обычно сильной положительной корреляции между их содержанием сульфатов и биологической активностью (обсуждается далее в разделе 4). Был разработан ряд методов сверхсульфатирования полисахаридов, таких как обработка серной кислотой, триоксид серы-пиридин, хлорсульфоновая кислота-пиридин, диметилформамид и триоксид серы-диметиламин [96,97,98,99,100,101,102].
3.4. Модификация размера молекул сульфатированных водорослей полисахаридов
Полисахариды сульфатированных водорослей с более низкой молекулярной массой могут быть получены химическими, физическими или ферментативными способами для получения олигосахаридов с более разнообразной биоактивностью.Например, линейные или разветвленные сульфатированные галактаны и фуканы могут быть отщеплены мягким кислотным гидролизом [99,102] или радикальным процессом, включающим окислительно-восстановительную систему пероксид водорода-медь [98,101]. Химические методы просты в применении, но не обладают специфичностью. Незначительные изменения температуры или кислотности могут привести к вариациям в размерах олигосахаридов и характерах сульфатирования, в то время как сильная кислота может изменить характер сульфатирования или разрушить полисахаридную цепь [97]. Ферментативное разложение сульфатированных полисахаридов может быть достигнуто путем выбора ферментов, таких как гидролазы, фукоиданазы (EC 3.2.1.44), α-L-фукозидазы (EC 3.2.1.51) и галактозидазы [96,103] для нацеливания на гликозидные связи при сохранении сульфатных групп [100]. Фукоиданазы и галактозидазы были идентифицированы у морских беспозвоночных и микроорганизмов [83,104,105,106,107,108]. Некоторые виды биоактивности низкомолекулярных олигосахаридов, полученных из сульфатированных полисахаридов водорослей, выделены в.
Таблица 2
Биологическая активность выбранных низкомолекулярных олигосахаридов, полученных из сульфатированных полисахаридов водорослей.
| Методы модификации | Источник | Области применения | Ссылка |
|---|---|---|---|
| Химический | Ascophyllum | Ascophyllum 9069 Antcrombum 9069 , 2003 [109] | |
| Botryocladia occidentalis | Противоядная активность | Toyama et al., 2010 [110] | |
| Furcellaria lumbricalis | Иммуностимулирующая активность | Yang et al. , 2011 [16] | |
| Solieria chordalis | Иммуностимулирующая активность | Bondu et al. , 2010 [111] | |
| Enzymatic | Chondrus ocellatus | Противоопухолевая активность | Mou et al. , 2003 [112] |
| Nemacystus decipieus | Антикоагулянтная активность | Kitamura et al., 1992 [113] | |
| Pelvetia canaliculata | Противовирусная активность | Klarzynski et al. , 2003 [114] | |
| Undaria pinnatifida | Антикоагулянтная активность | Kim et al. , 2010 [115] |
4. Биоактивность и взаимосвязь между структурой и активностью
Из-за трудностей в идентификации химической структуры сульфатированных полисахаридов водорослей связь между их структурой и биологической активностью до конца не изучена.Один из исследовательских подходов к установлению взаимосвязей между структурой и функцией заключался в том, чтобы делать выводы на основе информации, полученной в результате исследований сульфатированных полисахаридов беспозвоночных, которые имеют регулярную структуру и поэтому их легче изучать. Например, Перейра и его коллеги сравнили разветвленные фуканы из бурых водорослей с более простыми линейными версиями, полученными из морского огурца и морских ежей [116]. Было показано, что антикоагулянтная активность фуканов морских водорослей зависит от их молекулярной массы, степени сульфатирования и распределения сульфатных групп в повторяющихся единицах.Интересно, что фуканы водорослей, как было обнаружено, ингибируют коагуляцию посредством прямого ингибирования тромбина, тогда как фуканы беспозвоночных ингибируют фермент опосредованно, требуя антитромбина и кофактора гепарина II.
В этом разделе мы выделим ключевые биологические активности, о которых сообщалось для сульфатированных полисахаридов водорослей, текущие знания об их способе действия и структурные требования, необходимые для проявления этих эффектов.
4.1. Антикоагулянтная и антитромботическая активность
Вероятно, наиболее широко признанная и изученная биоактивность морских сульфатированных полисахаридов — это гепариноподобная антикоагулянтная активность, проявляемая фукоиданами и другими фуканами бурых морских водорослей. Впервые об этом сообщили для фукоидана, выделенного из F. vesiculosus , Спрингер и его коллеги, обнаружившие ингибирование образования фибринового сгустка и антитромбиновой активности [117,118]. С тех пор исследования фуканов из различных морских водорослей выявили антикоагулянтную и антитромботическую активность и обсуждаются в нескольких недавних обзорах [1,4,6].
Основа этих действий до конца не изучена, но ряд исследований предполагает наличие нескольких механизмов действия, включая прямое и непрямое ингибирование тромбина через активацию ингибиторов тромбина (например, антитромбина и кофактора гепарина II) [116,119,120,121]. Недавно Кумаши и его коллеги сообщили, что фуканы из 10 бурых водорослей увеличивают время свертывания плазмы крови человека; однако только пять из этих фуканов обладали значительной активностью против тромбин-индуцированной агрегации тромбоцитов [122].Хотя результаты последнего анализа наводят на мысль о прямом действии определенных фуканов на тромбин, авторы отметили, что нельзя исключать мешающее действие связывания тромбина с его рецепторами на тромбоцитах.
Общие структурные особенности фуканов, которые важны для их антикоагулянтной активности, включают сахарный состав, молекулярную массу, уровень сульфатирования и положение сульфатных групп на сахарном остове [70,123,124,125]. Например, Нишино и его коллеги обнаружили, что более высокое содержание фукозы и сульфатных групп совпало с более высокой антикоагулянтной активностью во фракциях сульфатированных полисахаридов из E.куроме [70]. Они также показали, что антикоагулянтная активность фуканов положительно коррелировала с содержанием сульфата и что только фуканы с отношением сульфатных остатков к общему количеству сахаров больше единицы обладали значительной активностью [93,123]. Фуканы с более высокой молекулярной массой (например, 27 и 58 кДа) показали большую антикоагулянтную активность, чем фуканы с более низкой молекулярной массой (~ 10 кДа) [126]. Взаимосвязь между молекулярной массой сульфатированных полисахаридов и их антикоагулянтной активностью также была рассмотрена Помином и его коллегами, которые сообщили, что линейный сульфатированный фукан требует значительно более длинных цепей, чем гликозаминогликаны млекопитающих для достижения антикоагулянтной активности [125].Селективное расщепление для уменьшения размера молекулы фукана лишь на небольшое количество резко снижает его влияние на инактивацию тромбина, опосредованную кофактором гепарина II. Фуканы с более низкой молекулярной массой, по-видимому, связываются с кофактором гепарина II, но, в отличие от нативного (полноразмерного) фукана, неспособны эффективно способствовать взаимодействию кофактора гепарина II с тромбином [125]. Chevolot et al. сообщил о важности расположения сульфатных групп на остатках сахара для антикоагулянтной активности [57,62].Изучая фукоидан из A. nodosum , они обнаружили, что для антикоагулянтной активности необходимы 2- O -сульфатированные и 2,3- O дисульфатированные остатки фукозы, тогда как сульфатирование в положении O -4 не оказалось необходимым.
Было доказано, что морские сульфатированные полисахариды, отличные от фуканов, обладают антикоагулянтной активностью. Сообщения включают сульфатированный галактан и ульваноподобные сульфатированные полисахариды, полученные из зеленых водорослей, в частности из видов Codium и Ulva [44,45,49,127,128].Например, Mao et al. описал сульфатированный полисахарид из U. conglobata с высоким содержанием рамнозы и 35% сложного сульфатного эфира, который продлевает время свертывания за счет того, что, по-видимому, является прямым ингибированием тромбина и модулированием кофактора гепарина II [49]. Hayakawa et al. протестировал сульфатированные полисахариды из 23 видов зеленых водорослей на антикоагулянтную активность и обнаружил сульфатированный полисахарид с высоким содержанием рамнозы из Monostroma nitidum , очищенная версия которого была более сильнодействующей, чем стандартный гепарин [127].
Красные водоросли также дали ряд сульфатированных полисахаридов с сильной антикоагулянтной активностью [129,130,131]. Особенно показательны исследования сульфатированного галактана из красных водорослей Botryocladia occidentalis . Farias et al. сообщил, что 2,3-ди-O -сульфатированный D-галактан из B. occidentalis проявляет антикоагулянтную активность, сравнимую с гепарином, что, по-видимому, связано с ингибированием тромбина и фактора X.Его активность была более сильной, чем у аналогичных сульфатированных галактанов из беспозвоночных источников, которые содержали только один сульфат на остаток галактозы [129]. Аналогичная полисахаридная цепь из G. crinale , но с меньшими количествами 2,3-ди- O -сульфатированной D-галактозы, оказалась менее эффективной в анализе времени свертывания по сравнению с таковой из B. occidentalis [ 131]. Два сульфатированных полисахарида не различались по ингибированию тромбина, опосредованному антитромбином; однако в анализах, в которых вместо антитромбина использовали кофактор гепарина II, сульфатированный галактан из G.crinale был менее ингибирующим, чем у crinale B. occidentalis. Тем не менее, сульфатированный галактан из G. crinale был более сильным антикоагулянтом, чем таковой из B. occidentalis , когда фактор X был протеазой-мишенью. Эти наблюдения предполагают, что пропорция и / или распределение 2,3-дисульфатированной галактозы вдоль цепи полисахарида модулируют взаимодействие полисахаридов со специфическими протеазами в системе свертывания. Недавно Glauser et al. показали, что 2,3-дисульфатированный галактан из B. occidentalis ингибирует внутренние комплексы теназы и протромбиназы, которые имеют решающее значение для образования фактора Ха и тромбина, соответственно [130]. Сульфатированный галактан взаимодействует с сайтом связывания гепарина на тяжелой цепи фактора Ха. Интересно, что антикоагулянтная активность, связанная с сульфатированным галактаном и гепарином, по-разному модулируется кофактором гепарина II; Антикоагулянтная активность гепарина усиливалась в плазме, лишенной кофактора гепарина II, тогда как активность сульфатированного галактана не зависела от этого кофактора.
Гепарин широко используется для профилактики венозного тромбоза и лечения других тромбоэмболических заболеваний из-за его ингибирования тромбина и других ферментов в системе свертывания крови. Чтобы преодолеть очевидный потенциальный побочный эффект кровотечения, исследователи исследовали способы снижения антикоагулянтной активности гепарина при одновременном усилении его антитромботической активности, включая химическую модификацию и фракционирование нативного гепарина до низкомолекулярных форм [132, 133, 134].Тем не менее разработка антитромботических полисахаридов водорослей была бы полезной, поскольку их использование позволило бы избежать потенциального загрязнения прионами или вирусами коммерческих гепаринов, которые получают из кишечника свиней и крупного рогатого скота. Более того, с более специфической активностью и / или мишенями сульфатированные полисахариды водорослей могут найти применение в дополнение к гепарину [132]. С этой целью одним из подходов была разработка фукоиданов с низким молекулярным весом (LMW) [121, 135]. Например, фракция LMW приблизительно 8000, полученная из фукоидана A.nodosum снизил средний вес тромба на 80% по сравнению с инъекцией контрольного физиологического раствора в модели венозного тромбоза на кроликах [135]. Этот низкомолекулярный фукоидан и родственные ему производные [136] являются многообещающими, поскольку они показывают более низкие эффекты в тестах на коагуляцию по сравнению с коммерческим низкомолекулярным гепарином, далтерпарином (Fragmen®, Pfizer Inc.). Совсем недавно Rocha и его коллеги сообщили, что сульфатированный галактофукан из бурых морских водорослей Spatoglossum schoederi обладает мощным антитромботическим действием на модели венозного тромбоза на крысах [69].В отличие от гепарина, который оказывает быстрое, но временное антитромботическое действие, действие in vivo этого сульфатированного галактофукана прогрессировало медленно, демонстрируя максимальную эффективность примерно через восемь часов после инъекции. При тестировании in vitro с использованием эндотелиальных клеток было обнаружено, что галактофукан стимулирует выработку гепарансульфата, что привело к гипотезе о том, что его замедленное действие in vivo связано с необходимостью накопления гепарансульфата на поверхности кровеносных сосудов. .Несмотря на высокий уровень сульфатирования, галактофукан не обладает значительной антикоагулянтной активностью, что делает его идеальным кандидатом в качестве антитромботического средства [69].
4.2. Противовирусная активность
Способность сульфатированных полисахаридов из морских водорослей ингибировать репликацию вирусов в оболочке, включая вирус простого герпеса (ВПГ), вирус иммунодефицита человека (ВИЧ), цитомегаловирус человека, вирус денге и респираторно-синцитиальный вирус, хорошо известна [137,138,139,140]. Первые наблюдения противовирусной активности составляющих морских водорослей восходят более чем 50 лет назад к наблюдению, что экстракты морских водорослей защищают куриные эмбрионы от гриппа B и эпидемического паротита [141].
Немного позже, несколько случайно, было обнаружено, что гепарин ингибирует ВПГ в культурах лейкоцитов [142], эффект, предположительно связанный с электростатическим вмешательством в прикрепление вируса к поверхности клеток. Это стимулировало исследования противовирусных эффектов различных полианионных веществ, включая сульфатированные полисахариды ряда видов морских водорослей. Интерес к противовирусным эффектам полисахаридов водорослей существенно вырос в последние годы, поскольку появляется все больше свидетельств того, что их влияние на репликацию вирусов происходит посредством ряда механизмов, которые включают специфические структурные свойства полисахаридов, а не просто через неспецифические взаимодействия [137, 143].Мы обсудим некоторые из недавних открытий, касающихся структурных требований полисахаридов водорослей для противовирусной активности и лежащих в основе механизмов действия.
Фукан из Cladosiphon okamuranus , состоящий из глюкуроновой кислоты и сульфатированных единиц фукозы, эффективно ингибировал инфицирование клеток BHK-21 вирусом денге 2 типа (DENV-2), но оказывал незначительное влияние на три других серотипа вируса [144 ]. Для этого было необходимо сульфирование фукана; неожиданно карбоксильное восстановление глюкуроновых кислот до единиц глюкозы также привело к отмене противовирусных свойств фуканов.Анализ структуры гликопротеинов оболочки из четырех серотипов вируса денге показал, что аргинин-323 в DENV-2, который находится проксимальнее предполагаемого сайта связывания гепарина, имеет решающее значение для взаимодействия с фуканом.
Точно так же Таларико и его коллеги сообщили, что два сульфатированных полисахарида из красных морских водорослей, каррагинан из Gymnogongrus griffithsiae и галактан из Cryptonemia crenulata , ингибировали размножение DENV-2 в клетках Vero [145, 146, 147].Их эффекты были менее сильными против DENV-3 и DENV-4 и были полностью неактивными против инфекции DENV-1 [147]. Было показано, что эти полисахариды препятствуют как адсорбции, так и интернализации DENV-2 в клетках и были эффективны только при добавлении вместе с вирусом или вскоре после заражения. Например, не происходит подавления размножения вируса, когда нормальный процесс проникновения вируса обходится путем трансфекции РНК DENV-2 в клетки [145, 146].
Недавно был также пролен свет на противовирусную активность морских сульфатированных полисахаридов против ВПГ типов 1 и 2 (ВПГ-1, ВПГ-2) [67, 143, 148, 149].Сульфатированные ксиломаннаны из красных морских водорослей Sebdenia polydactyla ингибировали размножение HSV-1 в клетках Vero [148]. Активность отменяется десульфатацией ксиломаннана, и, наоборот, сверхсульфатированные производные проявляют повышенную эффективность. Мохсен сообщил, что фракции сульфатированного полисахарида, выделенные из Sargassum latifolium , ингибировали HSV-1 в анализе налета, причем наиболее эффективная фракция имела большее содержание сульфатного эфира и молекулярную массу по сравнению с другими изученными фракциями [150].Обычно наблюдается, что противовирусная активность сульфатированных полисахаридов увеличивается с увеличением их молекулярной массы [137]. Было показано, что репрезентативные полисахариды из коричневых и красных морских водорослей, различающиеся по структуре (галактаны, фуканы и галактофуканы), уровню сульфатирования и молекулярной массе, подавляют инфекцию HSV-1 и HSV-2 [149], что подтверждает мнение о том, что, как и в случае с другими видами активности, противовирусная активность сульфатированных полисахаридов происходит из-за сложного взаимодействия структурных особенностей, включая уровень сульфатирования, распределение сульфатных групп вдоль основной цепи полисахарида, молекулярную массу, состав сахарных остатков и стереохимию [139, 143].Подмножество этих сульфатированных полисахаридов также показало способность инактивировать HSV-2 непосредственно через инкубацию с вирусом. Эта вирулицидная активность имеет значение, поскольку она связана с усилением противовирусной активности in vivo [151].
4.3. Иммуно-воспалительная активность
Было показано, что сульфатированные полисахариды, в том числе из водорослей, обладают иммуномодулирующей активностью, которая может иметь потенциальное применение для стимуляции иммунного ответа или контроля активности иммунных клеток для смягчения связанных с ними негативных эффектов, таких как воспаление [152].Сульфатированные полисахариды могут воздействовать на несколько мишеней в иммунной и воспалительной системах, что может влиять на прогрессирование и исход заболевания, включая прогрессирование опухоли и метастазирование [153].
Одним из интересов сульфатированных полисахаридов водорослей в качестве противовоспалительных средств является растущее количество доказательств, демонстрирующих их способность препятствовать миграции лейкоцитов к участкам воспаления. Например, на кроличьей модели бактериального менингита количество лейкоцитов заметно снижалось при внутривенном введении фукоидана [154].Точно так же внутривенное добавление фукоидана дозозависимым образом уменьшало рекрутирование лейкоцитов в брюшину в модели воспаления брюшины у крыс [155]. Эти эффекты были приписаны связыванию фукоидана с L- и P-селектинами, молекулами клеточной адгезии, необходимыми в процессе набора. В обоих этих исследованиях использовался фукоидан от Sigma-Aldrich Chemical Co (Сент-Луис, Миссури, США), полученный из F. vesiculosus . Фуканы из других морских водорослей, включая Laminaria sp с. ., Fucus sp p ., A. nodosum и C. okamuranus также подавляют рекрутирование лейкоцитов в брюшную полость во время острого перитонита у крыс [122]. Помимо нарушения действия селектинов, сульфатированные полисахариды водорослей ингибируют ферменты деградации тканей, такие как гепараназа и эластазы, которые участвуют в нарушении целостности базальной мембраны во время воспаления [156, 157].
Одним из основных и потенциально многообещающих видов деятельности является сильное ингибирующее действие сульфатированных фуканов на активацию человеческого комплемента.Первоначальные наблюдения показали, что фракции фукоидана из A. nodosum сильно ингибируют как классический, так и альтернативные пути в сыворотке крови человека [158]. Тиссо и его коллеги тщательно изучили эту активность [159, 160, 161, 162]. Было установлено, что низкомолекулярные фракции фукоидана связываются с субъединицей C1q комплекса C1, запускающего комплемент, посредством узнавания и связывания иммунных комплексов [162]. Связывание фукоидана, по-видимому, препятствует способности C1q полностью запускать активацию C1 [160].Фукоидан также связывает C4, тем самым предотвращая его распад и образование продукта расщепления C4b, последний необходим для образования C3-конвертазы и размножения комплемента [162]. Более того, было обнаружено, что фукоидан связывает глобулярные головки C1q и может препятствовать распознаванию C1q IgG [161]. Недавно с помощью ЯМР было обнаружено, что разветвленные олигосахариды фукоидана лучше ингибируют комплемент по сравнению с линейными структурами [159].
Взаимодействие сульфатированных полисахаридов водорослей с системой комплемента предполагает, что они могут быть полезны для воздействия на врожденный иммунитет для уменьшения провоспалительного состояния или других пагубных состояний, таких как аллергические реакции, возникающие во время врожденного иммунного ответа.Кроме того, появляется все больше доказательств того, что полисахариды водорослей могут регулировать врожденный иммунный ответ напрямую путем связывания с рецепторами распознавания образов (PRR), такими как рецептор маннозы и толл-подобные рецепторы на фагоцитарных клетках, включая макрофаги [152]. Например, λ-каррагинан стимулировал культуры Т-клеток мышей зависимым от toll-подобного рецептора-4 (TLR4) образом [163], генерируя паттерн цитокинового ответа Т-хелперов 1 (Th2). Однако спленоциты, полученные из TLR4-дефицитных мышей, все еще сохраняли некоторую способность продуцировать интерферон-γ в ответ на λ-каррагинан, что позволяет предположить, что PRR, отличные от TLR4, также вызывались.У мышей, иммунизированных овальбумином, чтобы вызвать аллергическую реакцию, пероральное введение λ-каррагинана привело к снижению уровня IgE, специфичного для овальбумина, и высвобождения гистамина в сыворотке, что позволяет предположить, что λ-каррагинан может быть использован для облегчения аллергических реакций. Аналогичные результаты были получены для фукоидана мекабу из U. pinnatifida [164].
Прямое стимулирующее действие полисахаридов водорослей на иммунные клетки приводит к продукции оксида азота за счет индукции индуцибельной синтазы оксида азота (iNOS) и провоспалительного цитокинового / хемокинового профиля [165].В зависимости от ситуации взаимодействие сульфатированных полисахаридов с другими эффекторами может привести к уменьшению воспаления. Например, фукоидан из F. vesiculosus индуцировал iNOS в клетках макрофагов RAW264.7, что приводило к усилению продукции оксида азота [166, 167]. Тем не менее, в присутствии липополисахарида (LPS) фукоидан нарушал LPS-индуцированную экспрессию iNOS и продукцию оксида азота [167]. Точно так же фукоидан подавляет индуцированную гамма-интерфероном экспрессию iNOS в макрофагальных и глиальных клетках [168].
Эти и другие сообщения о сульфатированных водорослях полисахаридах, непосредственно стимулирующих врожденную иммунную систему [165, 168, 169, 170], предполагают, что они могут найти терапевтическое применение в борьбе с патологиями, основанными на Т-хелпере 2 (Th3), такими как аутоиммунные расстройства и аллергия. Кроме того, есть доказательства того, что сульфатированные полисахариды водорослей, включая фукоиданы и каррагинаны, увеличивают цитотоксичность естественных клеток-киллеров, лимфоцитов и макрофагов против опухолей [169,171].
Структурные требования к иммуностимулирующей активности сульфатированных полисахаридов водорослей изучены недостаточно.В одном отчете Лейро и его коллег показано значительное снижение иммуностимулирующей активности ульваноподобных полисахаридов из U. rigida , когда они были десульфатированы [165].
4.4. Антиоксидантная активность
Сульфатированные полисахариды водорослей до недавнего времени в значительной степени игнорировались как источники антиоксидантной активности. Исследования последних нескольких лет показывают, что сульфатированные полисахариды из ряда морских водорослей обладают заметной антиоксидантной способностью [95, 172, 173, 174, 175, 176, 177].Например, фуканы из F. vesiculosus проявляли значительную восстанавливающую / антиоксидантную способность железа [172] и способность улавливать супероксидные радикалы [173]. Фракции фукана из L. japonica также показали значительные антиоксидантные способности в анализах улавливания супероксидных и гидроксильных радикалов [174,176,177]. Активность улавливания супероксидных радикалов положительно коррелировала с содержанием сульфата во фракциях полисахаридов [173,176]. Антиоксидантные свойства каррагинанов [173] и ульванов [94] также оказались связаны с содержанием сульфатов.В последнем исследовании производные ульвана с высоким содержанием сульфатов показали улучшенную антиоксидантную активность [94]. Интересно, что активность фукановых фракций в хелатировании металлов, свободных радикалах и гидроксильных радикалах, по-видимому, связана с их соотношением содержания сульфата / фукозы [176].
4.5. Антилипидемические эффекты
Сульфатированные водорослями полисахариды обладают гиполипидемическими и другими полезными свойствами на моделях животных с гиперлипидемией [178,179,180]. Экстракт из F. vesiculosus дозозависимым образом эффективно снижал повышение уровня триглицеридов в сыворотке и общего холестерина у крыс с гиперлипемией, индуцированной тритоном.У крыс, получавших диету с высоким содержанием холестерина в течение 21 дня, добавление в рацион ульвана из U. pertusa приводило к снижению общего холестерина в сыворотке и холестерина ЛПНП без значительного изменения триглицеридов в сыворотке [180]. Эффекты ульвана были изменены, когда он разложился на фракции с более низкой молекулярной массой. Производные Ульвана с более низкой молекулярной массой и характеристической вязкостью не снижали уровень холестерина в сыворотке, но нормализовали гипертриглицеридемию у этих животных и повышали уровень холестерина ЛПВП.Механизмы, лежащие в основе этих действий, неясны, но, по-видимому, они не связаны с секвестрацией желчных кислот, поскольку ульван и его производные с более низкой молекулярной массой увеличивают выведение желчи в аналогичной степени.
Недавно сообщалось, что фукоидан из L. japonica снижает общий сывороточный холестерин и холестерин ЛПНП и триглицериды, а также повышает уровень холестерина ЛПВП в модели гиперлипидемии на крысах [179]. Лечение также увеличило активность липопротеинлипазы (LPL), печеночной липазы (HL) и лецитинхолестерин-ацилтранферазы (LCAT) в сыворотке крови.Эти изменения активности ферментов могут быть прямым результатом лечения фукоиданом или косвенным эффектом, связанным с улучшением липидного профиля. Конечно, фукоидан и другие сульфатированные полисахариды водорослей могут влиять на LPL и HL через взаимодействие с хорошо изученными сайтами связывания гепарина на этих ферментах. С этим согласуется наблюдение, что фукоидан из F. vesiculosus высвобождает LPL из участков связывания на поверхности клетки и стабилизирует активность LPL в культуральной среде [181].
Сульфатированные полисахариды водорослей демонстрируют многообещающие эффекты в борьбе с гиперлипидемией, связанной с токсичностью некоторых лекарств. Было показано, что фуканы из S. polycystum обладают значительным профилактическим действием на повышение уровня холестерина и триглицеридов в сыворотке и ткани печени в результате токсического гепатита, индуцированного ацетаминофеном [182]. Лечение также частично обратило вспять снижение печеночных LCAT и HL и улучшило общий гистологический вид печени.Точно так же сульфатированный полисахарид из S. wightii уменьшал гиперлипидемию и нормализовал LPL и LCAT в плазме при нефротоксичности, вызванной циклоспорином A [183]. Выведение мочевины, мочевой кислоты и креатинина нормализовалось обработкой сульфатированным полисахаридом. Кроме того, была снижена восприимчивость ЛПНП к окислению, что позволяет предположить, что антиоксидантная активность сульфатированного полисахарида также играет роль и может вносить вклад в его ренопротекторную активность.
Гепарин и неантикоагулянтный гепарин ослабляют гистоновые воспалительные реакции в цельной крови
Abstract
Цитотоксические и провоспалительные гистоны присутствуют во внеклеточных ловушках нейтрофилов (NET) и повышаются в крови при некоторых воспалительных состояниях, главным примером которых является сепсис.Поэтому представляют интерес соединения, которые могут ослаблять активность гистонов, причем гепарин является одним из таких материалов, которое, как ранее было показано, связывается с гистонами. Экспериментально было показано, что гепарин, успешный антикоагулянт на протяжении почти столетия, связывается с гистонами и проявляет защитный эффект при воспалительных заболеваниях. В настоящем исследовании, проведенном в цельной крови, гепарин и селективно десульфатированный гепарин снижали индуцированные гистоном маркеры воспаления, такие как интерлейкин 6 (IL 6), интерлейкин 8 (IL 8), тканевой фактор и C3a, компонент комплемента.Селективно десульфатированные гепарины с пониженной антикоагулянтной активностью сохранили высокую степень эффективности в качестве антигистонового агента, тогда как полностью десульфатированный гепарин оказался неэффективным. Результаты этого исследования показывают, что присутствие сульфата и другие специфические структурные особенности необходимы гепарину для ослабления воспалительного действия гистонов в цельной крови.
Образец цитирования: Hogwood J, Pitchford S, Mulloy B, Page C, Gray E (2020) Гепарин и неантикоагулянтный гепарин ослабляют вызванные гистонами воспалительные реакции в цельной крови.PLoS ONE 15 (5): e0233644. https://doi.org/10.1371/journal.pone.0233644
Редактор: Пабло Гарсиа де Фрутос, Институт биомедицинских исследований Барселоны, ИСПАНИЯ
Поступила: 3 января 2020 г .; Принята к печати: 9 мая 2020 г .; Опубликован: 29 мая 2020 г.
Авторские права: © 2020 Hogwood et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в бумаге, а исходные данные для цифр — во вспомогательной информации.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Есть интерес к той роли, которую гепарин может играть помимо действия как антикоагулянт и антитромботик.Ряд исследований in vitro продемонстрировали, что гепарин обладает полезной противовоспалительной и антикомплементарной активностью [1]. Вполне возможно, что использование гепарина по многим показаниям может не требовать его антикоагулянтной активности, и эта антикоагулянтная активность может считаться нежелательной особенностью в таких условиях [2]. В настоящее время проводится ряд исследований [3–6], в которых основное внимание уделяется неантикоагулянтным гепаринам, полученным путем химических модификаций. Эти модифицированные гепарины использовались для определения некоторых структурных требований по показаниям, не связанным с хорошо описанным антикоагулянтным и антитромботическим действием гепарина.Однако существует явная потребность в простых, надежных анализах, которые отражают неантикоагулянтное действие гепарина, чтобы способствовать развитию этих модифицированных гепаринов в качестве потенциальных терапевтических средств.
Одной из областей, привлекающих некоторое внимание, является способность гепарина действовать как противовоспалительное средство [7] с провоспалительной активностью нейтрофилов, исследованной в качестве одной из потенциальных мишеней для гепарина [8, 9]. Обоснованием этого является важная роль, которую нейтрофилы играют в иммунитете хозяина, обеспечивая защиту от микробной инфекции, однако несоответствующая или чрезмерная активация нейтрофилов может способствовать развитию таких заболеваний, как псориаз, хроническая обструктивная болезнь легких (ХОБЛ) и осложнения сепсиса [ 10].Нейтрофилы также высвобождают связанные с нейтрофилами внеклеточные ловушки (NET) в качестве иммунного ответа посредством формы гибели клеток, называемой НЕТозом [11, 12]. Из компонентов NETs гистоны присутствуют в большом количестве, составляя более 70% от общей массы белка [13], а гистоны, как известно, обладают как антимикробными, так и цитотоксическими свойствами [14].
В дополнение к их присутствию в NETs, внеклеточные гистоны, как было показано, являются маркерами заболевания, высвобождаемыми из клеток в виде белков молекулярных паттернов, связанных с повреждениями [15, 16].Их наличие коррелировало с тромбоцитопенией [17], органной недостаточностью [18] и тяжестью сепсиса [19]. Также было показано, что гистоны индуцируют экспрессию тканевого фактора in vitro как в эндотелиальных клетках [20], так и в моноцитах [21]. Следовательно, агенты, которые можно использовать для снижения уровня гистонов, потенциально могут быть полезны в клинике в качестве потенциального лечения сепсиса, и поэтому представляет интерес то, что гепарин, как было показано, связывается с гистонами [22].
Гепарин обычно используется при лечении сепсиса, где его роль выходит за рамки антикоагуляции [23].Частично эта роль может быть связана с его известной способностью взаимодействовать с нейтрофилами и нарушать их активность, ослабляя высвобождение эластазы и агрегацию нейтрофилов [8]. Также было показано, что гепарин снижает воспалительные эффекты, вызванные введением гистонов [17, 19, 24]. В этой ситуации антикоагулянтные свойства гепарина нежелательны. Было продемонстрировано, что гепарин с его антикоагулянтным компонентом, удаленным фракционированием, сохранял свои цитопротекторные эффекты in vitro после добавления гистона [14].В модели in vivo выживания при острой травме, характеризующейся повышенными уровнями гистонов, N-ацетил-гепарина, явный неантикоагулянтный гепарин оказался почти таким же эффективным, как немодифицированный гепарин, в улучшении выживаемости [25]. Эти исследования показывают, что гепарин может быть разработан как противовоспалительное средство без его антикоагулянтной активности.
Основными целями данной работы было изучение структурных требований, особенно мест сульфатирования, к гепарину для проявления его противовоспалительной активности и исследование того, может ли стимуляция цельной крови гистонами использоваться в качестве теста для количественной оценки противовоспалительное действие гепаринов.Гепарин — это сильно отрицательно заряженный полисахарид, сильно замещенный сульфатными группами. В некоторых сообщениях указано, что противовоспалительные свойства гепарина могут быть связаны с содержанием в нем сульфатов [26, 27]. Основная повторяющаяся трисульфатированная дисахаридная единица гепарина состоит из 2-O-сульфатированной идуроновой кислоты, чередующейся с N-сульфатированным 6-O-сульфатированным глюкозамином. В этом исследовании модифицированные гепарины с удаленными выбранными сульфатными группами (2-O-сульфат, 6-O-сульфат или N-сульфат) и, в случае удаления N-сульфата, повторно N-ацетилированные, были исследованы, чтобы обеспечить понимание в важность расположения сульфатных групп.Модель цельной крови считалась предпочтительной, поскольку она включает ряд компонентов крови, на которые ранее было показано влияние гистонов, включая моноциты [21], нейтрофилы [14], тромбоциты [28] и эритроциты [29]. Это важное соображение для любого анализа, поскольку было показано, что воспалительные реакции в цельной крови отличаются от реакции отдельных компонентов крови при изучении действия липополисахаридов [30, 31]. Кроме того, нет опубликованных данных об антигистоновых эффектах гепарина и родственных соединений в системе цельной крови.В настоящем исследовании были проанализированы одновременные измерения нескольких маркеров, участвующих в воспалении: тканевого фактора, IL6 и IL8. Поскольку гепарин также взаимодействует с путём комплемента [32], также измеряли С3а комплемента, чтобы исследовать связь между комплементом и воспалительной системой. Модифицированные гепарины с точно оцененной антикоагулянтной активностью (информация отсутствует в других исследованиях), выраженной в международных единицах, сравнивали с немодифицированным гепарином для определения потенциальных структурных требований к гепарину для проявления антигистоновой / противовоспалительной активности в цельной крови.
Методы
Гепарин
Два селективно десульфатированных гепарина, 2-O-десульфатированный и N-десульфатированный-ре-N-ацетилированный, получали из одной партии гепарина. 2-O-десульфатированный гепарин получали, как описано Jaseja [33], а N-ацетилгепарин получали, как описано Nagasawa [34]. Другими модифицированными гепаринами были 6-O-десульфатированный гепарин (Iduron, Alderley Edge, UK), N-десульфатированный гепарин и N-ацетил-де-O-сульфатированный гепарин (Sigma, Gillingham UK). Подтверждение сульфатной модификации всех образцов проводили методом ЯМР с химическими сдвигами по сравнению с литературными данными [35, 36].Клинический образец гепарина (Wockhardt Ltd, Wrexham, UK) также был включен в некоторые анализы.
Антикоагулянтная активность модифицированных гепаринов
Антикоагулянтная активность модифицированных гепаринов оценивалась несколькими различными методами: антитромбин-зависимым анти-IIa (метод определения эффективности клинических препаратов гепарина в Европейской фармакопее и США), антитромбин-зависимым анти-Xa, зависимым от кофактора гепарина II анти-IIa и Свертывание плазмы (активированное частичное тромбопластиновое время с использованием плазмы человека) проводили, как описано ранее [37].Все оценки активности рассчитывались относительно 6 -го Международного стандарта нефракционированного гепарина (07/328, NIBSC, Великобритания) с использованием модели параллельных линий в CombiStats 5.0 (EDQM, Страсбург, Франция).
Цельная кровь с гистонами
Цельную кровь (10 мл) брали у здоровых добровольцев (этическое одобрение получено от Консультативного комитета по человеческим материалам Национального института биологических стандартов и контроля) путем венепункции из антекубитальной вены в стерильный шприц.Кровь подвергали антикоагуляции рекомбинантным гирудином (Pharmion, Великобритания) до конечной концентрации 30 мкг / мл. Кровь обрабатывалась для экспериментов в течение 30 минут после сбора.
Цельную кровь распределяли в микротитровальные планшеты (Greiner Bio-one, Frickenhausen, Германия), в которые добавляли возрастающие концентрации гистонов (Type III-S, Sigma, Gillingham, UK). Планшеты для микротитрования помещали на орбитальный шейкер (500 об / мин) в увлажненный инкубатор CO 2 и инкубировали в течение 6 или 24 часов.После инкубации кровь центрифугировали и собирали супернатант для анализа цитокинов. Клеточный компонент промывали четыре раза сбалансированным солевым раствором Хэнка перед замораживанием для анализа тканевого фактора.
Влияние гистонов и гепарина на цельную кровь
Фиксированная концентрация гистонов (конечный уровень 50 мкг / мл) была добавлена к цельной крови, и через 5 минут были добавлены различные количества в международных единицах (МЕ) клинического нефракционированного гепарина. Модифицированные гепарины использовали в (конечных) концентрациях мкг / мл, как указано в результатах.Цельную кровь инкубировали, как указано выше, в течение 6 часов перед сбором супернатанта и клеточных компонентов для анализа. Статистический анализ действия каждого гепарина проводился с использованием дисперсионного анализа (ANOVA) для соответствия данных общей линейной модели. Затем для сравнения результатов использовалось множественное сравнение Даннета, которое корректирует вариабельность от донора к донору за счет использования контрольного образца (ответ только на гистоны для каждого донора).
Анализ маркеров воспаления
Измерение уровней IL6, IL8 и фактора комплемента C3a в плазме проводили с помощью ELISA в соответствии с инструкциями производителя (Thermo Fisher, Hemel Hempstead UK).Уровень тканевого фактора измеряли с помощью анализа свертывания после трех циклов замораживания-оттаивания клеток [38]. Анализ свертывания крови проводили путем смешивания каждого размороженного образца с равным объемом объединенной нормальной плазмы с низким содержанием тромбоцитов (Национальная служба крови и переливания крови, Колиндейл, Великобритания) и инкубировали при 37 ° C в коагулометрах Ceveron Ten (Technoclone, Вена, Великобритания). Австрия) перед добавлением равного объема 25 мМ хлорида кальция. Полученное время свертывания крови переводили в единицы тканевого фактора по стандартной кривой тканевого фактора (14/238, NIBSC, UK) со значениями, представленными в условных единицах.Как описано выше, статистический анализ данных проводили с использованием множественного сравнения Даннета с ответом только на гистоны в качестве контрольного образца.
Результаты
Влияние гистонов на цельную кровь
Способность гистонов вызывать воспалительный ответ в цельной крови от шести разных доноров оценивалась после 6- и 24-часовой инкубации (рис. 1). После 6-часового инкубационного периода гистоны индуцировали продукцию воспалительных маркеров IL6, IL8 и тканевого фактора (TF) и увеличивали активацию комплемента, что наблюдалось по увеличению уровней C3a по сравнению с фоновыми ответами.Через 24 часа уровни как IL6, так и IL8 достигли одинакового уровня для всех концентраций гистонов и были выше, чем в образцах, инкубированных в течение 6 часов. Наблюдалось зависящее от концентрации повышение уровней как C3a, так и TF после 6- и 24-часового инкубационного периода, при этом уровни через 24 часа обычно были выше для C3a, но ниже для TF.
Рис. 1. Влияние гистонов на индукцию воспалительных маркеров в цельной крови человека в течение 6 и 24 часов.
Цельную кровь стимулировали возрастающими концентрациями гистонов в течение 6 и 24 часов.Высвобожденный C3a, IL-6 и IL-8 измеряли в плазме, а тканевой фактор определяли по клеточному компоненту. Для каждой временной точки все концентрации составляли p <0,001 относительно фона (0 мкг / мл), считываемого множественным сравнением Даннета. Планки погрешностей = стандартное отклонение среднего от 6 доноров.
https://doi.org/10.1371/journal.pone.0233644.g001
Способность гепарина влиять на гистоновые ответы в цельной крови
Добавление немодифицированного гепарина к цельной крови в отсутствие гистонов оказало слабое ослабляющее действие на фоновые уровни C3a, IL8 и TF (см. Фиг. 2).C3a был снижен с 4,8 ± 2,2 мкг / мл до 1,9 ± 1,0 мкг / мл, IL8 с 0,9 ± 0,8 нг / мл до 0,2 ± 0,1 нг / мл и TF с 9,2 ± 3,5 ед / мл до 2,7 ± 1,8 ед / мл после инкубация с 40 МЕ / мл гепарина. Эффекта на измеренный уровень IL6 не наблюдалось.
Рис. 2. Влияние гепарина на фоновые и гистоновые воспалительные реакции в цельной крови.
Возрастающие концентрации гепарина (в международных единицах) добавляли к цельной крови, обработанной 50 мкг / мл гистонов или без них, и инкубировали в течение 6 часов.Высвобожденный C3a, IL-6 и IL-8 измеряли в плазме, а тканевой фактор определяли по клеточному компоненту. Анализ каждой группы (с / без гистонов) с помощью множественного сравнения Даннета проводили с использованием фона (0 МЕ) в качестве контрольной группы * или # = p <0,05, ** или ## = p <0,01, *** или ### = p <0,001. Планки погрешностей = стандартное отклонение среднего от 6 доноров.
https://doi.org/10.1371/journal.pone.0233644.g002
Гистоны в концентрации 50 мкг / мл использовали для определения влияния гепарина на ослабление гистон-индуцированной воспалительной реакции в цельной крови (рис. 2).Эта концентрация находится в пределах диапазона, наблюдаемого у пациентов с сепсисом [39]. Клинический образец гепарина, добавленный в различных концентрациях в МЕ, смог снизить влияние гистонов на цельную кровь. Снижение уровней C3a было значительным ( p <0,001) для всех концентраций, при этом индуцированный гистонами ответ снизился с 12,7 ± 2,4 мкг / мл до 8,2 ± 2,3 мкг / мл на 0,004 МЕ / мл гепарина и ниже фоновый уровень при 40 МЕ / мл гепарина 2,8 ± 1,9 мкг / мл.
Все концентрации гепарина снижали уровень продуцируемого IL6; только гистоны дали 12.5 ± 5,2 нг / мл, который снизился до 6,7 ± 2,1–9,2 ± 4,0 нг / мл под действием гепарина. При средней концентрации гепарина 0,4 МЕ / мл не было различий с ответом только на гистоны ( p = 0,091), в то время как другие концентрации выше и ниже этого значимо различались (0,004 МЕ / мл было p = 0,030 , 0,04 МЕ / мл было p = 0,027, 4 МЕ / мл было p = 0,012, 40 МЕ / мл было p = 0,001). Гистон-индуцированный ответ IL8 также снижался гепарином с 11.4 ± 3,8 нг / мл только для гистона до 10,1 ± 3,2 нг / мл с 0,004 МЕ / мл гепарина и далее снижается до 6,4 ± 2,2 нг / мл при добавлении 40 МЕ / мл гепарина. Это снижение было значительным только при концентрациях 40 МЕ / мл ( p = 0,001) и 0,04 МЕ / мл ( p = 0,035), что частично объяснялось высокой вариабельностью ответов доноров и отражалось в большой ошибке. бары. Только 40 МЕ / мл гепарина были способны повлиять на уровень генерируемого ТФ, который снизился с 18,1 ± 3,6 ед / мл до уровня ниже фонового на уровне 7.2 ± 3,1 ед / мл ( р <0,001).
Действие селективно десульфатированного гепарина
Образец нефракционированного гепарина, использованный для получения 2-O-десульфатированного и N-ацетил-гепарина, имел удельную активность 209 МЕ / мг по методу определения активности (анти-IIa) (таблица 1). Активность против Ха для этого гепарина была примерно такой же, 214 МЕ / мг, что дает соотношение aIIa / aXa 0,98. Анализ свертывания показал активность 209 МЕ / мг, а активность HCl составила 241 МЕ / мг. Удаление 2-O-сульфата из гепарина снизило антикоагулянтную активность во всех анализах с наибольшим снижением, наблюдаемым в анализе, зависимом от HCII, до 14.5 МЕ / мг, а наименьшее снижение было по результатам анализа свертывания плазмы — 80,5 МЕ / мг. Удаление N-сульфата из гепарина дало материал, который не проявлял измеримой активности ни в одном анализе. Гепарин, который был де-N-сульфатирован, а затем повторно-N-ацетилирован (N-ацетил), имел очень низкую активность без измеряемой опосредованной антитромбином активности анти-Ха и анти-IIa, некоторую незначительную активность HCII при 1,1 МЕ / мг и ограниченную. активность свертывания крови на основе плазмы (5,1 МЕ / мг), хотя последний ответ не соответствовал стандарту, что указывает на другой механизм действия по сравнению со стандартом гепарина.По сравнению с немодифицированным гепарином, 6-O-десульфатированный гепарин имел пониженную антикоагулянтную активность, оцененную по свертыванию плазмы, в то время как антитромбиновые анти-IIa и HCII-зависимые анализы были в целом аналогичными: 18,2 МЕ / мг, 14,9 МЕ / мг и 17,1 МЕ / мг с немного выше значение анти-Ха, 28,4 МЕ / мг. Полностью десульфатированный гепарин с повторным N-ацетилированием не обладал измеримой антикоагулянтной активностью.
Концентрация модифицированного гепарина 200 мкг / мл была использована в анализе цельной крови гистонов, исходя из произвольного предположения, что клинический гепарин 40 МЕ / мл соответствует приблизительно 200 мкг / мл (200 МЕ / мг удельной активности).Этот высокий уровень гепарина аналогичен тому, который использовали другие группы в экспериментах in vitro для ослабления действия гистонов [17, 19]. При концентрации 200 мкг / мл немодифицированный гепарин (рис. 3) был способен снижать уровень всех измеренных маркеров — C3a, IL6. IL8 и TF в значительной степени (все p <0,001), причем как C3a, так и TF ослаблены до уровня ниже фонового (3,6 ± 2,7 мкг / мл и 5,0 ± 4,7 ед / мл соответственно) и IL6 на 45% (от От 13,5 ± 4,5 до 7,4 ± 2,4 нг / мл) и IL8 на 70% (17.От 5 ± 5,9 до 6,7 ± 3,6 нг / мл).
Рис. 3. Способность селективно десульфатированного гепарина ослаблять вызванные гистоном воспалительные реакции в цельной крови.
Гистоны, 50 мкг / мл, и различные десульфатированные гепарины, 200 мкг / мл, добавляли к цельной крови и инкубировали в течение 6 часов. Высвобожденный C3a, IL-6 и IL-8 измеряли в плазме, а тканевой фактор определяли по клеточному компоненту. Анализ данных проводился с использованием множественного сравнения Даннета без гепарина (только гистоны) в качестве контрольного образца, * = p <0.05, ** = p <0,01, *** p <0,001. Планки погрешностей = стандартное отклонение среднего от 6 доноров.
https://doi.org/10.1371/journal.pone.0233644.g003
Модификация гепарина N-десульфатацией или полной десульфатацией с N-ацетилированием устраняет способность гепарина ослаблять влияние гистонов на цельную кровь измеренными аналитами. . Другие десульфатированные гепарины (2-O-десульфатированный, N-ацетил и 6-O-десульфатированный) показали способность снижать действие гистонов, но это было ниже, чем у немодифицированного гепарина.Измерение C3a и TF показало, что 2-O-десульфатированный гепарин может ослаблять гистоновые ответы более эффективно, чем N-ацетилгепарин, который сам по себе был более эффективным, чем 6-O-десульфатированный гепарин (C3a был 7,8 ± 3,9, 10,1 ± 5,3). , 9,8 ± 4,9 мкг / мл и TF составлял 5,9 ± 5,0, 12,4 ± 9,5 и 14,5 ± 10,5 ед / мл — соответственно 2-O-десульфатированный, N-ацетил и 6-O-десульфатированный гепарин). Снижение уровня IL6 было в целом одинаковым для трех образцов (только с гистона с 13,5 ± 4,5 до 9,1 ± 2,0, 8,2 ± 2,2 и 10.6 ± 4,6 нг / мл соответственно). Для IL8 2-O-десульфатированный гепарин снижал ответ до 7,8 ± 3,9 нг / мл с 17,5 ± 5,9 нг / мл, в то время как N-ацетил и 6-O-десульфатированный гепарин снижали индуцированные гистоном ответы до аналогичных уровней 10,1 ± 5,3. нг / мл и 9,8 ± 4,9 нг / мл соответственно. Все эти сокращения были статистически значимыми ( p <0,01) по сравнению с отсутствием гепарина.
Влияние N-ацетилгепарина на гистоновые ответы
Обладая антикоагулянтной активностью ниже 10 МЕ / мг, N-ацетилгепарин исследовали далее при более низких концентрациях.Исходный гепарин, использованный для приготовления образца, был включен для сравнения. Использовали пять концентраций: 0,02, 0,2, 2, 20 и 200 мкг / мл (рис. 4). Только самая высокая концентрация N-ацетилгепарина была способна значительно снизить влияние гистонов на цельную кровь для всех измеренных медиаторов воспаления — C3a с 22,0 ± 8,3 мкг / мл до уровня ниже фона 5,5 ± 2,0 мкг / мл, IL6 с 8,8 ± От 3,3 до 5,8 ± 3,2 нг / мл, IL8 с 12,9 ± 6,6 нг / мл до 6,2 ± 0,8 нг / мл и TF от 39,9 ± 7,5 до 16,1 ± 7,0 ед / мл ( p <0.01). Ослабление немодифицированным гепарином при 200 мкг / мл было больше, чем ослабление N-ацетилгепарином для всех медиаторов воспаления: C3a составлял 2,0 ± 0,9 мкг / мл, IL6 составлял 4,7 ± 1,4 нг / мл, IL8 составлял 4,2 ± 0,9 нг / мл. и TF составил 5,7 ± 4,8 ед / мл ( p <0,01).
Рис. 4. Дозовое действие гепарина и N-ацетилгепарина на ослабление вызванных гистоном воспалительных реакций в цельной крови.
Гистоны, 50 мкг / мл и возрастающие концентрации исходного гепарина и н-ацетил-гепарина добавляли к цельной крови и инкубировали в течение 6 часов.Высвобожденный C3a, IL-6 и IL-8 измеряли в плазме, а тканевой фактор определяли по клеточному компоненту. Анализ данных проводился с использованием множественного сравнения Даннета без гепарина (только гистоны) в качестве контрольного образца, * = p <0,05, ** = p <0,01, *** p <0,001. Планки погрешностей = стандартное отклонение среднего от 6 доноров.
https://doi.org/10.1371/journal.pone.0233644.g004
Более низкие концентрации как N-ацетила, так и исходных гепаринов были менее эффективны при ослаблении гистон-индуцированного ответа.Для C3a значительное снижение наблюдалось при использовании 20 ( p = 0,001) и 2 мкг / мл ( p = 0,022) без разницы с фоновыми значениями 0,2 и 0,02 мкг / мл ( p = 0,226. и p = 0,472 соответственно). Для IL6, за исключением 0,02 мкг / мл, все более высокие концентрации вызывали небольшое, но значимое ( p <0,01) снижение IL6 - для N-ацетилгепарина значения были 7,0 ± 2,9, 6,8 ± 2,7 и 6,1 ± 2,6 нг. / мл соответственно, а для исходного гепарина уровни были снижены до 6.5 ± 3,2, 5,8 ± 2,3 и 4,9 ± 2,1 нг / мл соответственно по сравнению с 8,8 ± 3,3 нг / мл только для гистона. Эффект обоих гепаринов на уровни IL8 был аналогичен влиянию IL6 (рис. 4). Для ТФ более низкие концентрации (<200 мкг / мл) N-ацетилгепарина не снижали влияние гистонов на цельную кровь, в то время как для исходного гепарина 20 и 2 мкг / мл были способны снизить уровни ТФ до 32,5 ± 5,7. и 35,7 ± 8,7 от 39,7 ± 7,5 ед / мл ( p < 0,05).
Обсуждение
Способность гепарина взаимодействовать с широким спектром белков хорошо известна [40].Несмотря на эти известные взаимодействия, разработка и утверждение терапевтической роли гепарина, помимо антикоагуляции, было медленным. Многие исследования показывают, что гепарин взаимодействует с белками, участвующими в воспалительных реакциях, и может влиять на их роль как в условиях in vivo, и in vitro, так и в условиях , в первую очередь действуя благоприятным противовоспалительным образом [2]. Действительно, считается, что роль гепарина в лечении сепсиса, состояния, которое приводит к повышению уровня гистонов [39], превосходит роль антикоагулянта [23].Эти широкие противовоспалительные эффекты могут объяснить, почему гепарин успешно используется для лечения некоторых воспалительных состояний [2]. Представленные здесь результаты продемонстрировали способность гепарина и модифицированных гепаринов действовать как противовоспалительное средство для снижения цитотоксического действия гистонов при добавлении в цельную кровь.
Ранее было показано, что внеклеточные гистоны увеличивают секрецию / экспрессию ТФ в периферических моноцитах [21] и эндотелиальных клетках [20], и это было подтверждено при использовании цельной крови в этом исследовании.Дальнейшие биомаркеры, измеренные в цельной крови, IL6, IL8 и комплемент C3a были увеличены гистонами в зависимости от концентрации. Эти ответы подтверждают опубликованные наблюдения увеличения экспрессии TNFα и IL6 в эндотелиальных клетках [19] после инкубации с гистонами. Активация системы комплемента гистонами, измеренная в этой работе с помощью C3a, может объяснить увеличение выживаемости мышей с дефицитом C5 по сравнению с мышами дикого типа после введения гистонов [41]. Ландсем и др. Сообщили об этой оси «комплемент-воспаление», связывая активацию комплемента с повышением экспрессии TF в цельной крови человека, стимулированной Escherichia coli [42].
В настоящем исследовании клинический препарат гепарина смог снизить уровни воспалительных маркеров, измеренных в обработанной гистоном цельной крови, подтверждая наблюдения, что гепарин снижает индуцированную гистоном гибель эндотелиальных клеток и лейкоцитов in vitro и улучшает выживаемость в модели in vivo [19, 20, 24]. Это первое исследование, в котором использовался метод цельной крови, чтобы продемонстрировать ослабляющее действие гепарина на воспалительную реакцию, вызванную гистонами.Эффект гепарина в качестве антигистонового агента зависел от концентрации с явным эффектом на уровни C3a и различными эффектами на уровни IL6 и IL8, в первую очередь из-за различий в реакции донора на донора, что влияло на статистическую достоверность при некоторых концентрациях гепарина. Только самый высокий уровень гепарина (200 мкг / мл), использованный в этом исследовании, был способен снизить уровень TF, индуцированного гистонами в цельной крови, что контрастирует с наблюдением, что уровни TF из моноцитов были снижены при инкубации с плазмой от пациентов, получавших терапевтические уровни гепарина по сравнению с нелеченными субъектами [21].
Как описано во введении, побочный эффект гепарина в виде кровотечения может быть недостатком для гепарина, действующего как противовоспалительное средство, поскольку для его эффективности по этому показанию потребуется гораздо более высокая доза. Таким образом, модификация гепарина для снижения или устранения антикоагулянтной активности является привлекательным подходом для улучшения его терапевтического потенциала в качестве антигистонового / противовоспалительного агента. Чтобы исследовать это, были изучены гепарины, модифицированные селективной десульфатацией, с пониженной или нулевой поддающейся измерению антикоагулянтной активностью.Из исследованных препаратов селективно десульфатированного гепарина два сохранили некоторую антикоагулянтную активность (2-O-десульфатированный и 6-O-десульфатированный гепарин), в то время как другие не имели поддающейся измерению антикоагулянтной активности (N-десульфатированный, N-ацетил и полностью десульфатированный гепарин). Хотя концентрация, использованная для сравнения, была высокой, 200 мкг / мл, уровень был выбран для сравнения с клиническим гепарином, используемым в этом исследовании, поскольку этот уровень продемонстрировал статистически значимое снижение гистон-индуцированных ответов во всех используемых анализах.Удаление сульфатов в разных участках гепарина снижает его относительную эффективность (по сравнению с немодифицированным гепарином) в качестве антигистонового лечения, в то время как полное удаление сульфатов делает гепарин неспособным действовать как антигистоновый агент, что демонстрирует важность отрицательно заряженных сульфатных групп. . Одна тонкая структурная особенность была обнаружена при повторном N-ацетилировании N-десульфатированного гепарина. Удаление N-сульфата устраняет антигистоновую активность, в то время как ацетилирование этого сайта (продуцирование N-ацетилгепарина) восстанавливает антигистоновую функцию.Вероятно, это произошло из-за воздействия аминогруппы в гепарине после N-десульфатации. Положительно заряженная аминогруппа может нарушать основанное на заряде взаимодействие гепарина с гистоном, которое затем восстанавливается присутствием нейтральной ацетильной группы. Из изученных сульфатных сайтов удаление 2-O-сульфата сохранило около 90% антигистоновой активности немодифицированного гепарина. Однако антикоагулянтная активность 2-O-десульфатированного гепарина по-прежнему высока и составляет ~ 80 МЕ / мг, поэтому он может оказаться непригодным для использования исключительно в качестве антигистонового агента.6-O-десульфатированный гепарин в дозе ~ 18 МЕ / мг снизил уровень C3a до 75% от уровня, наблюдаемого для немодифицированного гепарина.
Ответы, наблюдаемые с модифицированными гепаринами на уровнях IL6, IL8 и тканевого фактора, показали аналогичную важность для изученных сульфатных сайтов, хотя абсолютное снижение относительно только гистона было ниже по сравнению с ослаблением уровней C3a различными гепаринами. Было показано, что уровень сульфатирования гепарина имеет решающее значение для его способности влиять на систему комплемента, при этом избыточное сульфатирование усиливает эту способность [43], а потеря сульфатов снижает ее [44].Поэтому разумно предположить, что уровень сульфатирования гепарина влияет на степень ингибирования гепарином гистон-индуцированного C3a или путем прямого взаимодействия с факторами комплемента [44, 45].
Из подготовленных материалов N-ацетилгепарин имеет наибольший потенциал в качестве терапевтического антигистонового агента из-за минимальной антикоагулянтной активности. По сравнению с исходным гепарином в той же концентрации, N-ацетилгепарин имел только немного сниженную антигистоновую активность. Относительная эффективность N-ацетилгепарина в отношении ослабления гистон-индуцированных ответов была сравнима с гепарином при измерении IL6 и C3a, но продемонстрировала пониженную эффективность в отношении IL8 и тканевого фактора.
Механизм, с помощью которого гепарин может предотвратить повреждение гистонов, можно частично объяснить вероятным взаимодействием между гепарином и гистонами. Было показано, что гистоны связываются с гепарином [46, 47], а также с гепарансульфатом, менее сульфатированным полисахаридом со структурным сходством с гепарином [40]. Это связывание гистонов с гепарансульфатом, которое является частью механизма, с помощью которого внеклеточный хроматин (и гистоны) выводятся [48] из кровообращения. В модели острого легкого гистоны накапливались на гепарансульфате в легком, вызывая повреждение легких [49] при лечении гепариназой или инфузией гепарина, обеспечивающей защитный эффект.Было бы разумно предположить, что гепарин, обладающий высоким отрицательным зарядом (через свои многочисленные сульфаты), взаимодействует с этими положительно заряженными участками на поверхности молекулы гистона [50, 51]. Таким образом, изменения в характере сульфатирования гепарина будут изменять взаимодействие между гистонами и гепарином, при этом взаимодействие снижает потерю сульфата, как показано в этом исследовании. Это же предположение может объяснить, почему гепарин успешно конкурирует с менее плотно сульфатированными гепарансульфатами клеточной поверхности за связывание с гистонами [49].
Неантикоагулянтный гепарин потенциально может быть полезным терапевтическим средством для лечения таких заболеваний, как острое повреждение легких и сепсис, что приводит к повышению уровня гистонов в крови [25, 39]. Это исследование и предыдущие работы [14, 24] демонстрируют, что гепарин ослабляет вредное воздействие гистонов на клетки. Эта работа показала, что модификация гепарина для удаления антикоагулянтной активности (измеряемой методом определения эффективности клинических гепаринов, анализом анти-IIa) поддерживает потенциальную пользу гепарина, хотя и с небольшим снижением эффективности.Хотя эффективные концентрации N-ацетилгепарина были высокими (> 20 мкг / мл), это относится к антикоагулянту, с которым сравнивается эта концентрация, и не может считаться высоким, если неантикоагулянтный гепарин действует как антикоагулянт. -гистон или противовоспалительное средство.
Сводка
Используя модель цельной крови, мы продемонстрировали провоспалительные эффекты гистонов и активацию комплемента. Этот подход отличается от ранее опубликованных работ с использованием изолированных клеток, таких как моноциты, тем, что использовалась система цельной крови, позволяющая взаимодействие гистонов и гепаринов со всеми компонентами крови, тем самым обеспечивая лучшее моделирование настройки in vivo .Наша работа объединила измерения нескольких соответствующих воспалительных маркеров (IL6, IL8, тканевый фактор и комплемент C3a), ранее изучавшиеся только на отдельных типах клеток или на животных моделях. Результаты показали, что немодифицированный гепарин и модифицированные гепарины способны ослаблять воспаление, и наши результаты показывают, что анализ цельной крови может обеспечить хорошую платформу для изучения сложных противовоспалительных эффектов гепарина и родственных ему продуктов.
Использование модифицированного и избирательно десульфатированного гепарина дало новое понимание структуры и функциональной взаимосвязи между гепарином и гистонами.Снижение антигистоновой активности за счет удаления N-сульфатной группы подчеркивает важность отрицательного заряда гепарина. N-ацетилирование восстанавливало активность N-десульфатированного гепарина, предполагая, что «экранирование» положительно заряженной аминогруппы, экспонированной N-десульфатированием, важно для активности. Понятно, что присутствие сульфатов также было важным, поскольку полностью десульфатированный, но N-ацетилированный гепарин не проявлял никакой антигистоновой активности. Однако положение сульфата может не иметь решающего значения, поскольку удаление 2-O, 6-O или N-сульфатных групп (при замене нейтральной ацетильной группой) оказало минимальное влияние на измеряемые маркеры воспаления.Нарушение антигистоновой активности из-за вмешательства в распределение заряда гепарина согласуется с электростатическим взаимодействием между отрицательно заряженным полисахаридом и положительно заряженными гистонами.
Благодарности
Авторы хотели бы поблагодарить Питера Ригсби (Национальный институт биологических стандартов и контроля, Великобритания) за статистические советы.
Ссылки
- 1. Рычаг R, стр. CP. Неантикоагулянтные эффекты гепарина: обзор.Handb Exp Pharmacol. 2012 (207): 281–305.
- 2. Маллой Б, Хогвуд Дж, Грей Е, Рычаг Р, Пейдж CP. Фармакология гепарина и родственных ему препаратов. Pharmacol Rev.2016; 68 (1): 76–141.
- 3. Чен Дж. Л., Фан Дж., Чен МХ, Донг И, Гу Дж. З. Влияние неантикоагулянтного N-десульфатированного гепарина на экспрессию основного фактора роста фибробластов, ангиогенез и метастазирование карциномы желудка in vitro и in vivo. Гастроэнтерол Рес Прак. 2012; 2012: 752940.
- 4. Экман-Ордеберг Г., Хеллгрен М., Акеруд А., Андерссон Э., Дубике А., Сеннстром М. и др.Низкомолекулярный гепарин стимулирует сократительную способность миометрия и ремоделирование шейки матки in vitro. Acta Obstet Gynecol Scand. 2009. 88 (9): 984–9.
- 5. Silvestro L, Viano I, Macario M, Colangelo D, Montrucchio G, Panico S и др. Влияние гепарина и его десульфатированных производных на адгезию лейкоцитов и эндотелия. Semin Thromb Hemost. 1994. 20 (3): 254–8.
- 6. Браун Р.А., Рычаг Р., Джонс Н.А., Пейдж С.П. Влияние гепарина и родственных молекул на агрегацию нейтрофилов и высвобождение эластазы in vitro.Br J Pharmacol. 2003. 139 (4): 845–53.
- 7. Янг Э. Противовоспалительное действие гепарина и родственных ему соединений. Thromb Res. 2008. 122 (6): 743–52.
- 8. Браун Р.А., Леунг Э., Канкаанранта Х., Мойланен Э., Пейдж CP. Влияние гепарина и родственных препаратов на функцию нейтрофилов. Pulm Pharmacol Ther. 2012. 25 (2): 185–92.
- 9. Левер Р., Лоу В.Т., Фарайдун М., Амин В., Браун Р.А., Галлахер Дж. И др. Гепарины, фракционированные по размеру, по-разному влияют на функцию нейтрофилов человека in vitro.Br J Pharmacol. 2007. 151 (6): 837–43.
- 10. Натан С. Нейтрофилы и иммунитет: проблемы и возможности. Nat Rev Immunol. 2006. 6 (3): 173–82.
- 11. Fuchs TA, Abed U, Goosmann C, Hurwitz R, Schulze I, Wahn V и др. Новая программа гибели клеток приводит к внеклеточным ловушкам нейтрофилов. J Cell Biol. 2007. 176 (2): 231–41.
- 12. Бринкманн В., Райхард Ю., Гусманн С., Фаулер Б., Улеманн Ю., Вайс Д.С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии.Наука. 2004. 303 (5663): 1532–15.
- 13. Урбан С.Ф., Эрмерт Д., Шмид М., Абу-Абед Ю., Гусманн С., Накен В. и др. Внеклеточные ловушки нейтрофилов содержат кальпротектин, цитозольный белковый комплекс, участвующий в защите хозяина от Candida albicans. PLoS Pathog. 2009; 5 (10): e1000639.
- 14. Вильдхаген К.С., Гарсия де Фрутос П., Ройтелингспергер С.П., Шрайвер Р., Аресте С., Ортега-Гомес А. и др. Неантикоагулянтный гепарин предотвращает гистон-опосредованную цитотоксичность in vitro и улучшает выживаемость при сепсисе.Кровь. 2014. 123 (7): 1098–101.
- 15. Chen R, Kang R, Fan XG, Tang D. Высвобождение и активность гистонов при заболеваниях. Cell Death Dis. 2014; 5: e1370.
- 16. Марсман Г, Зеерледер С, Люкен БМ. Внеклеточные гистоны, внеклеточная ДНК или нуклеосомы: различия в иммуностимуляции. Cell Death Dis. 2016; 7.
- 17. Фукс Т.А., Бхандари А.А., Вагнер Д.Д. Гистоны вызывают у мышей быструю и глубокую тромбоцитопению. Кровь. 2011. 118 (13): 3708–14.
- 18.Каваи С., Котани Х., Мияо М., Исида Т., Джемаил Л., Абиру Х. и др. Циркулирующие внеклеточные гистоны являются клинически значимыми медиаторами множественных повреждений органов. Am J Pathol. 2016; 186 (4): 829–43.
- 19. Ван Ф, Чжан Н., Ли Б., Лю Л., Дин Л., Ван И и др. Гепарин защищает от токсичности циркулирующих гистонов при сепсисе. Front Biosci (Landmark Ed). 2015; 20: 1259–70.
- 20. Kim JE, Yoo HJ, Gu JY, Kim HK. Гистоны индуцируют прокоагулянтный фенотип эндотелиальных клеток через повышающую регуляцию тканевого фактора и понижающую регуляцию тромбомодулина.PLoS One. 2016; 11 (6): e0156763.
- 21. Gould TJ, Lysov Z, Swystun LL, Dwivedi DJ, Zarychanski R, Fox-Robichaud AE, et al. Внеклеточные гистоны увеличивают активность тканевого фактора и увеличивают образование тромбина моноцитами крови человека. Шок. 2016. 46 (6): 655–62.
- 22. Фабиан I, Аронсон М. Поликатионы как возможные заменители протамина при нейтрализации гепарина. Thromb Res. 1980. 17 (1–2): 239–47.
- 23. Ли Х, Ма Х. Роль гепарина при сепсисе: гораздо больше, чем просто антикоагулянт.Br J Haematol. 2017; 179 (3): 389–98.
- 24. Иба Т., Хасигучи Н., Нагаока И., Табе Ю., Кадота К., Сато К. Гепарины ослабляли гистон-опосредованную цитотоксичность in vitro и улучшали выживаемость на крысиной модели гистон-индуцированной дисфункции органов. Интенсивная терапия Med Exp. 2015; 3 (1): 36.
- 25. Zhang Y, Zhao Z, Guan L, Mao L, Li S, Guan X и др. N-ацетил-гепарин ослабляет острое повреждение легких, вызванное аспирацией кислоты, главным образом за счет антагонизма гистонов у мышей. PLoS One.2014; 9 (5): e97074.
- 26. Мусави С., Моради М., Хоршидахмад Т., Мотамеди М. Противовоспалительные эффекты гепарина и его производных: систематический обзор. Adv Pharmacol Sci. 2015; 2015: 507151.
- 27. Мохамед С., Кумб ДР. Миметики гепарина: их терапевтический потенциал. Фармацевтические препараты (Базель). 2017; 10 (4).
- 28. Семераро Ф., Аммолло СТ, Моррисси Дж. Х., Дейл Г.Л., Фриз П., Эсмон Н.Л. и др. Внеклеточные гистоны способствуют образованию тромбина через тромбоцитозависимые механизмы: вовлечение TLR2 и TLR4 тромбоцитов.Кровь. 2011. 118 (7): 1952–61.
- 29. Семераро Ф, Аммолло СТ, Эсмон Н.Л., Эсмон СТ. Гистоны вызывают экспозицию фосфатидилсерина и прокоагулянтный фенотип в эритроцитах человека. J Thromb Haemost. 2014; 12 (10): 1697–702.
- 30. Damsgaard CT, Lauritzen L, Calder PC, Kjaer TM, Frokiaer H. Культура цельной крови — действенный недорогой метод измерения моноцитарных цитокинов — сравнение продукции цитокинов в культурах цельной крови человека, мононуклеарных клеток и моноцитов.J Immunol Methods. 2009. 340 (2): 95–101.
- 31. van Dooren FH, Duijvis NW, te Velde AA. Анализ цитокинов и хемокинов, продуцируемых цельной кровью, периферическими мононуклеарными и полиморфноядерными клетками. J Immunol Methods. 2013. 396 (1–2): 128–33.
- 32. Ecker EE, Gross P. Антикомплементарная сила гепарина J. Infect Dis. 1929. 44 (3): 250–3.
- 33. Jaseja M, Rej RN, Sauriol Fo, Perlin AS. Новые регио- и стереоселективные модификации гепарина в щелочном растворе.Спектроскопические доказательства ядерного магнитного резонанса. Канадский химический журнал. 1989. 67 (9): 1449–56.
- 34. Нагасава К., Иноуэ Ю., Камата Т. Сольволитическая десульфатация гликозаминогликуронансульфатов диметилсульфоксидом, содержащим воду или метанол. Carbohydr Res. 1977; 58 (1): 47–55.
- 35. Маллой Б., Форстер М.Дж., Джонс С., Дрейк А.Ф., Джонсон Е.А., Дэвис Д.Б. Влияние вариации замещения на конформацию раствора гепарина: исследование с помощью спектроскопического и молекулярного моделирования.Carbohydr Res. 1994; 255: 1-26.
- 36. Yates EA, Santini F, Guerrini M, Naggi A, Torri G, Casu B. Спектральные отнесения 1H и 13C ЯМР основных последовательностей двенадцати систематически модифицированных производных гепарина. Carbohydr Res. 1996. 294: 15–27.
- 37. Хогвуд Дж., Маллой Б., Грей Э. Осаждение и нейтрализация гепарина из различных источников с помощью сульфата протамина. Фармацевтические препараты (Базель). 2017; 10 (3).
- 38. Саутер П.Дж., Томас С., Хаббард А.Р., Пул С., Ромиш Дж., Грей Э.Антитромбин подавляет индуцированный липополисахаридом тканевый фактор и продукцию интерлейкина-6 мононуклеарными клетками, эндотелиальными клетками пупочной вены человека и цельной кровью. Crit Care Med. 2001. 29 (1): 134–9.
- 39. Альхамди Ю., Абрамс С.Т., Ченг З., Цзин С., Су Д., Лю З. и др. Циркулирующие гистоны являются основными медиаторами сердечной травмы у пациентов с сепсисом. Crit Care Med. 2015; 43 (10): 2094–103.
- 40. Capila I, Linhardt RJ. Гепарин-белковые взаимодействия. Angew Chem Int Ed Engl.2002. 41 (3): 391–412.
- 41. Мизуно Т., Йошиока К., Мизуно М., Симидзу М., Нагано Ф., Окуда Т. и др. Компонент 5 комплемента способствует летальному тромбозу. Научный отчет 2017; 7: 42714.
- 42. Ландсем А., Фуре Х., Кристиансен Д., Нильсен Э. У., Остеруд Б., Моллнес Т. Е. и др. Ключевые роли комплемента и тканевого фактора в индуцированной Escherichia coli коагуляции цельной крови человека. Clin Exp Immunol. 2015; 182 (1): 81–9.
- 43. Maillet F, Petitou M, Choay J, Kazatchkine MD.Структурно-функциональные отношения в ингибирующем действии гепарина на активацию комплемента — независимость антикоагулянтных и антикомплементарных сайтов на молекуле гепарина. Молекулярная иммунология. 1988. 25 (9): 917–23.
- 44. Weiler JM, Edens RE, Linhardt RJ, Kapelanski DP. Гепарин и модифицированный гепарин ингибируют активацию комплемента in vivo. J Immunol. 1992. 148 (10): 3210–5.
- 45. Шенфельд А.К., Ларсен Э., Албан С. Регулирование комплемента и активация контактной системы посредством усиления ингибитора С1 и модуляции активности фактора XIIa с помощью сульфатированных гликанов — взаимосвязь структура-активность.PLoS One. 2016; 11 (10): e0165493.
- 46. Алькантара FF, Iglehart DJ, Ochs RL. Гепарин в образцах плазмы вызывает неспецифическое связывание с гистонами при Вестерн-блоттинге. J Immunol Methods. 1999. 226 (1–2): 11–8.
- 47. Pal PK, Starr T, Gertler MM. Нейтрализация гепарина гистоном и его субфракциями. Thromb Res. 1983; 31 (1): 69–79.
- 48. Du Clos TW, Volzer MA, Hahn FF, Xiao R, Mold C, Searles RP. Клиренс хроматина у мышей C57Bl / 10: взаимодействие с гепарансульфатными протеогликанами и рецепторами на клетках Купфера.Clin Exp Immunol. 1999. 117 (2): 403–11.
- 49. Фриман К.Г., Пэриш К.Р., Нокс К.Дж., Блэкмор Дж.Л., Лобов С.А., Кинг Д.В. и др. Накопление циркулирующих гистонов на гепарансульфате в капиллярном гликокаликсе легких. Биоматериалы. 2013. 34 (22): 5670–6.
- 50. Рамакришнан В. Строение гистонов и организация нуклеосомы. Annu Rev Biophys Biomol Struct. 1997. 26: 83–112.
- 51. Дэйви К.А., Сарджент Д.Ф., Люгер К., Мейдер А.В., Ричмонд Т.Дж.Опосредованные растворителем взаимодействия в структуре ядерной частицы нуклеосомы с разрешением 1,9. J Mol Biol. 2002. 319 (5): 1097–113.

 В жаркую пору процесс сульфатации также ускоряется. Особенно это опасно, если батарея разряжена, даже немного. При этом происходит закупоривание кристаллами поверхностей пластин.
В жаркую пору процесс сульфатации также ускоряется. Особенно это опасно, если батарея разряжена, даже немного. При этом происходит закупоривание кристаллами поверхностей пластин. Вообще, в соответствии с ГОСТ 959-2002 аккумулятор считается негодным при снижении его емкости до значения 40% емкости от изначально заявленной. Но можно попробовать восстановить батарею.
Вообще, в соответствии с ГОСТ 959-2002 аккумулятор считается негодным при снижении его емкости до значения 40% емкости от изначально заявленной. Но можно попробовать восстановить батарею.
 Повторяя таким образом описанные циклы можно добиться плотности электролита 1,27 г/см³, которое является оптимальным значением.
Повторяя таким образом описанные циклы можно добиться плотности электролита 1,27 г/см³, которое является оптимальным значением.