Сколько Электролита в Аккумуляторе 60 и 55 а/ч Должно Быть Объем
Автор Сергей На чтение 8 мин Просмотров 83 Опубликовано
Сколько электролита в аккумуляторе 60 АЧ. Стандартная аккумуляторная батарея обычно используется для легковых машин среднего класса, она может быть обычного вида и сухозаряженной. Первый вид продаётся уже с электролитом внутри, в то время как второй вид реализуется с ёмкостями, незаполненными жидкостным раствором.
Вес АКБ 60 с электролитом
Стандартно аккумулятор 60 А/ч 12 вольт складывается из корпуса и 6 банок. В которых находятся:
- Пластинки.
- Раствор электролита.
- Сепараторы.
- Основная часть его заключается в пластинах и в кислотном растворе, который намного тяжелее воды.
- Также основа аккумулятора слагается из крепкой специальной пластмассы, которая добавляет изделию дополнительный вес.
- Вес аккумуляторной кислотной батареи в основном колеблется в пределах 13-16 кг.

Размеры АКБ и виды клемм
Для установки аккумулятора под капот своего автомобиля вы должны быть ознакомлены с точной размерной сеткой всех видов подходящих батарей, а также с видами их зажимов. Желательно ознакомится с параметрами не только длины и ширины, но и узнать необходимую высоту. Чтобы аккумулятор смог поместиться точно на своё место.
Стандартная батарея 60 ач может выходить в трёх вариантах:
| Вид АКБ | Ширина, см | Длина, см | Высота, см |
| Стандартизированный | 17.5 | 24.2 | 19.0 |
| Низкий | 17.5 | 24.2 | 17.5 |
| Азиатский | 17.3 | 23.2 | 22.5 |
Стоит также учитывать разницу в типах клемм для точного выбора своего аккумулятора. На аккумуляторной батарее 60 ач могут быть установлены производителем такие типы зажимов:
- Стандартизированные.
 Такими клеммами чаще всего оборудованы европейские и российские аккумуляторы. Диаметр плюсового зажима составляет 19,5 мм, минусового – 17,9 мм.
Такими клеммами чаще всего оборудованы европейские и российские аккумуляторы. Диаметр плюсового зажима составляет 19,5 мм, минусового – 17,9 мм. - Азиатские. Клеммы данного типа преобладают на азиатских машинах. По форме эти зажимы выступают вверх над наружной частью АКБ. Здесь плюсовой зажим равен 12,7 мм, а минусовой – 11,1 мм.
- Американские. Такие зажимы встречаются на американских автомобилях, произведённых в США. Они стандартно располагаются на боку аккумулятора и обладают внутренней резьбой. Такие батареи не совмещаются с зажимами европейского или азиатского вида.
Все аккумуляторы могут выпускаться с прямой и обратной полярностью.
Аккумуляторы 55, 60, 75, 90, 190 А/ч – отличительные особенности
Стандартные батареи 55 и 60 распространены в конструкции обычных легковых автомобилей. А вот «семьдесят пятые» и «девяностые» аккумуляторы можно встретить на мощных внедорожниках. Либо машинах вип-класса, где присутствует большое количество дополнительных установок, включая электропакеты, климат и круиз контроли, очистители фар и т. д. В этом случае всем приборам необходимо большое количество энергии, которую должен вмещать в себя соответствующий аккумулятор.
д. В этом случае всем приборам необходимо большое количество энергии, которую должен вмещать в себя соответствующий аккумулятор.
Аккумуляторы большого объёма имеют значительный вес: 75-й – около 20 кг, а 90-й – приблизительно 25 кг. Что касается батареи 190 – она не устанавливается на легковые машины, а используется для автобусов, грузовой и специальной техники. Вес такого огромного аккумулятора может доходить до 42 кг. Также в наличии бывают другие типы батарей: 110, 140 и другие. Но эти типы единичные и встречаются довольно редко.
Сколько электролита в аккумуляторе 55, 60, 190 А/ч
Аккумулятор стандартно подбирается от объёма мотора машины. Чем больше ёмкость аккумулятора, тем большее количество электролита батарея будет вмещать. Ведь внутренняя площадь для заполнения у такой АКБ объёмнее. Рассмотрим, сколько электролита необходимо для разных видов аккумуляторов.
Ориентировочное количество электролита для АКБ разной ёмкости
| Ёмкость АКБ, А/ч | Необходимое количество электролита, л. |
| 55 | 2,5 |
| 60 | 2,7-3,0 |
| 65 | 3,5 |
| 75 | 3,7-4,0 |
| 90 | 4,4-4,8 |
| 190 | 10,0 |
Количество электролита также будет зависеть от модели и производителя аккумулятора. При наливке электролита необходимо соблюдать параметры, указанный производителем. Также нужно контролировать, чтобы электролит покрывал пластины ориентировочно выше на 1 см, но не более 1,5 см.
Правильная эксплуатация аккумуляторов и заливка электролита
Современные аккумуляторы стандартно делятся на 2 вида: обслуживаемые и необслуживаемые. Второй вид наиболее удобный для обычного пользователя, электролит в нём уже присутствует. И автовладелец использует его в таком виде, который был предусмотрен заводом-изготовителем.
Если у вас обслуживаемый аккумулятор, в который вам необходимо доливать электролит самостоятельно, вы должны тщательно придерживаться элементарных правил.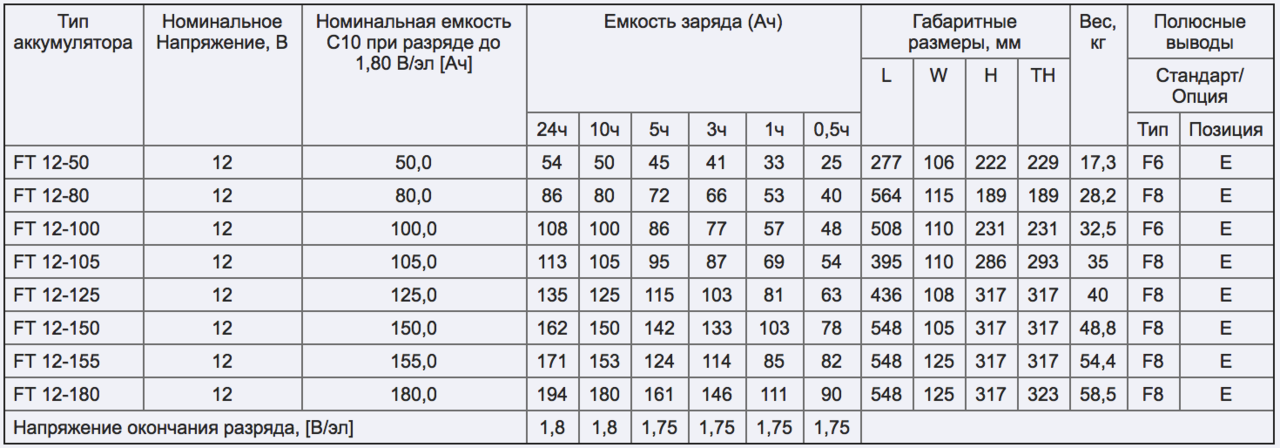 Чтобы ваша батарея прослужила отведённое для неё время в полном объёме.
Чтобы ваша батарея прослужила отведённое для неё время в полном объёме.
Читайте также: При зарядке аккумулятора кипит электролит
Правила заливки электролита
- Для получения электролита следует использовать только дистиллированную воду. Ни в коем случае нельзя пользоваться водой из водопроводной системы. Количество дистиллята рассчитывается согласно рекомендациям производителя.
- Данный гидрораствор производится исключительно в керамической или стеклянной ёмкости. При этом кислота доливается в дистиллят, а не наоборот.
- Электролит время от времени следует доливать в АКБ и следить за его уровнем. Пластины должны покрываться полностью с запасом на 1 см.
- При зарядке аккумулятора выделяются вредные испарения, поэтому её нельзя проводить вблизи открытого огня и в жилом помещении.
- Незаряженная батарея не может сохраняться более суток с электролитом по причине химических процессов с пластинами.

Несоблюдении верного уровня электролита
И высокие, и низкие степени нахождения раствора электролита в аккумуляторе представляют угрозу безопасности.
- Опасность при чересчур высоком уровне: лишний электролит будет выходить через банки аккумулятора, что может спровоцировать взрыв или чрезмерное количество вредных газообразований.
- Опасность при чересчур низком уровне: при данном химическом процессе происходит сульфатация пластинок в банках аккумулятора. Также нежелательные воздействия низкого уровня вмещают в себя падение ёмкости батареи, установленной заводом-производителем и, как следствие, плохую работу аккумулятора.
Безопасность при подзарядке
Самая опасная операция при зарядке батареи – это её отключение от ЗУ. В отдельных случаях это может спровоцировать взрыв. Во время зарядки происходят реакции по выделению водорода из электролита. Однако, более подвержены таким реакциям профессиональные зарядные устройства большого размера.
Автовладельцы или мастера, которые имеют дело с зарядными устройствами, не должны приближаться к нему с сигаретами или другими видами огня. Отключать же зажимы возможно только после полного отсоединения ЗУ от электросети.
Какая величина тока необходима для зарядки аккумулятора 60 А/ч
Сила тока обусловлена ёмкостью батареи и считается из расчёта 10% от значения ёмкости. Если АКБ имеет ёмкость 60, то и величина тока рассчитывается до 6 ампер. При напряжении 14,4В такая батарея заряжается приблизительно за 10 часов.
Современные зарядные устройства включают в себя систему автоматического контроля за величиной тока. Использование данных функционалов является наиболее безопасным и удобным. Так как автовладельцу не нужно самостоятельно настраивать эти параметры и контролировать их.
Для каких авто подойдёт аккумулятор 60 А/ч
Стандартные батареи 60 ач 12 вольт подойдут к легковым машинам с мотором до 2-х литров. Считается, что отечественные автомобили, в которые заводом-производителем установлена батарея 55 ач, могут без негативных последствий перестроиться на АКБ 60 ач.
При этом размеры аккумуляторов этих ёмкостей должны быть идентичными и должно совпадать расположение зажимов, чтобы одна батарея с лёгкостью заменила другую. Считается, что смена 55 ач на 60 ач укрепит эксплуатационные позиции автомобиля.
Если у машины имеется в наличии система Старт-Стоп, то аккумулятор подбирается с технологией EFB, GEL или AGM. Такие батареи имеют выдержку к глубоким разрядам, но для их подзарядки понадобится специализированный зарядный функционал.
Правильный выбор аккумулятора 60 А/ч
Для длительной работы аккумулятора нужен соответствующий уход. Его нужно правильно заряжать, следить за уровнем электролита, очищать от налёта и грязевых загрязнений. При низких показателях температур в зимнее время батарею желательно заносить на ночь домой.
А некоторые водители для лучшей сохранности батареи устанавливают специальный термокейс с подогревающими пластинами. При смене аккумулятора всегда лучше сделать выбор в сторону проверенных марок.
Из отечественных марок наиболее известными являются: Магнум, АвтоФан, Торнадо, Аком, Зверь. Зарубежные модели, которые внушают доверие, указываются автолюбителями в таком порядке: Moratti, Varta, Uno, Fireball, Westa.
Данный список включает модели, обладающие всеми современными преимуществами для легковых машин с объёмом мотора до 2-х литров.
Что влияет на срок службы аккумулятора
Использование аккумулятора в период резкого колебания температур может привести к сокращению его срока эксплуатации. Кроме механических повреждений, которым может подвергаться батарея.
В зимний период на ней могут скапливаться кусочки льда в виде кристаллов, такому же замерзанию может подвергаться и электролит в банках батареи. Поэтому важно не давать АКБ переохлаждаться.
Если вы проживаете или используете автомобиль в регионе с суровыми зимами, вы можете просто заносить батарею домой на ночь. Когда температура воздуха опускается предельно низко, чтобы аккумулятор прогревался равномерно.
Некоторые автолюбители используют для этих целей термокейс с прогревающими пластинами. В противном случае на аккумуляторе могут образовываться трещины от перепадов температур, поэтому очень важно не давать ему сильно перемерзать.
Если вы не смогли уберечь свой аккумулятор, и трещина всё-таки образовалась, то такую батарею необходимо сразу отсоединить от систем автомобиля и утилизировать, потому что её дальнейшее использование запрещено.
Однако, если слегка вздувается сам корпус АКБ, но герметичность при этом соблюдается, эту батарею ещё можно эксплуатировать на автомобиле.
Проверить пригодность аккумулятора можно следующими способами
- Для начала нужно сверить уровень и плотность электролита в батарее. Для этого откручиваются банки с проверяется уровень внутри банок. Далее АКБ следует установить на зарядку на 24 часа с током 1 А. При этом стоит производить замеры плотности электролита во время этой подзарядки.
 При увеличении плотности делается заключение о пригодности АКБ.
При увеличении плотности делается заключение о пригодности АКБ. - Для более детальной проверки необходимо слить старый электролит, полностью промыть банки дистиллятом, затем приготовить правильным способом новый раствор электролита, влить его и оставить на какое-то время. Далее подзаряжать в тихом режиме током 0,5 — 1 А. Если батарея рабочая, то плотность при замере через пару часов должна подняться.
Выводы
Для длительной эксплуатации АКБ нужно чётко следовать инструкциям – сколько электролита доливать в аккумуляторы того или иного объёма. Также на срок работы батареи будет влиять и плотность электролита, которую нужно замерять вовремя. Если объём электролита уменьшается, необходимо делать доливы приготовленного раствора согласно всем требованиям эксплуатации аккумулятора. Если выполнять все правила безопасности использования этого прибора, ваш аккумулятор будет работать долго и безопасно.
Мне нравится2Не нравитсяКаким током заряжать, Сколько электролита, Вес
Для нормальной работы электроприборов в автомобиле необходим подходящий аккумулятор, ёмкость которого позволит без проблем поддерживать работу устройств и при этом запускать двигатель. Чтобы иметь достаточный запас электричества многие автолюбители стремятся установить батареи большей ёмкости. Оптимальным вариантом для легкового автомобиля среднего класса является аккумулятор 60 ah.
Чтобы иметь достаточный запас электричества многие автолюбители стремятся установить батареи большей ёмкости. Оптимальным вариантом для легкового автомобиля среднего класса является аккумулятор 60 ah.
Сколько весит аккумулятор 60 ач
Стандартная 12 вольтова батарея 6СТ-60 состоит из шести одинаковых по объёму банок, в которых находятся свинцовые пластины, сепараторы и электролит. Аккумулятор всегда весит достаточно много. Основной вес приходится на свинцовые пластины, но, кроме этого, внутри изделия заливается достаточно большое количество раствора кислоты, который значительно тяжелее воды. Корпус изделия состоит из плотного пластика, масса которого относительно невелика, но тоже вносит свою лепту в общий вес аккумуляторной батареи.
Полная масса заправленного электролитом аккумулятора ёмкостью 60 А/ч может незначительно колебаться в зависимости от технологии и производителя, но средний показатель будет составлять от 13 до 16 кг.
Габариты АКБ и варианты клемм
Чтобы аккумулятор поместился в подкапотном пространстве на специальной площадке необходимо знать точные размеры. При чем не только длину и ширину, но и высоту. Все дело в том, что АКБ на 60 ампер час выпускаются в трех модификациях:
При чем не только длину и ширину, но и высоту. Все дело в том, что АКБ на 60 ампер час выпускаются в трех модификациях:
| Тип | Длинна, мм | Ширина, мм | Высота, мм |
|---|---|---|---|
| Стандатрный | 242 | 175 | 190 |
| Низкий | 242 | 175 | 175 |
| Азиатский | 232 | 173 | 225 |
Владельцам машин следует также знать, под какой вариант расположения клемм необходимо приобретать автомобильный элемент питания. На прилавках магазинов можно встретить АКБ ёмкостью 60 ампер часов со следующими вариантами клемм:
- Стандартные. Такие клеммы на всех европейских и российских автомобилях. У плюсовой клеммы диаметр 19,5 мм, а минусовой 17,9
- ASIA. Эти клеммы встречаются на азиатских автомобилях, в отличие от стандартных они уже и торчат над АКБ. Плюсовая клемма 12,7 мм, а минусовая 11,1 мм.

- Американские. Винтовые клеммы, расположены на торце батареи, встречаются на пригнанных машинах из США.
Все батареи выпускаются, как с прямой [+ -], так и обратной [- +] полярностью.
Сколько электролита в аккумуляторе 60 ач
В свинцовых аккумуляторах имеется прямая зависимость ёмкости изделия и количества электролита заливаемого в банки. Для батареи 60 ач объём раствора серной кислоты составит около 3-4 литра. Такой разброс из-за различных технологий. В современных дорогих батареях больше свинца и меньше электролита, в бюджетных моделях наоборот.
Приобрести электролит можно практически в любом магазине автозапчастей. Реализация осуществляется в бутылках объёмом 1 и 5 литров. Чтобы сэкономить деньги рекомендуется приобретать 5 – литровую канистру.
Каким током заряжать аккумулятор 60 ач
Величина тока напрямую зависит от емкости АКБ и равна 10% от нее. В нашем случае емкость ровна 60, значит сила тока должна быть до 6 ампер. Напряжение 14,4 вольта. Ориентировочно за 10 часов она должна зарядиться.
Напряжение 14,4 вольта. Ориентировочно за 10 часов она должна зарядиться.
Наиболее безопасным способом является использование автоматических зарядных устройств, которые самостоятельно регулируют интенсивность заряда батареи. При включении таких устройств в сеть полностью отпадает необходимость следить за процессом зарядки батареи.
Для каких автомобилей подходит АКБ 60 ач
Аккумуляторы напряжением 12 вольт и ёмкостью 60 а/ч подходят для установки на легковые автомобили, объём двигателя которых не превышает 2 литров. Как правило, без каких-либо серьёзных последствий можно заменить стандартные батареи ёмкостью 55 А/ч, устанавливаемые на отечественные легковушки. При условии, что батарея подходит по габаритам и расположению клемм, повышение накопительной возможности тока бортовой системы автомобиля приведёт к более уверенной эксплуатации, особенно в условиях городских пробок и в зимнее время года.
Если автомобиль оснащен системой Start-Stop, то нужно выбирать батарею изготовленную по технологиям , или .
Какой аккумулятор 60 ач выбрать и на что обратить внимание
Для того чтобы аккумулятор прослужил как можно дольше важно не допускать глубоких разрядов, предохранять изделие от механических повреждений, заносить изделие в тёплое помещение при длительной стоянке автомобиля на улице в зимнее время. Кроме этого, необходимо во время покупки отдать предпочтение проверенной марке. Среди отечественных и импортных брендов наиболее популярные:
| Отечественные | Зарубежные |
|---|---|
| Varta | |
| Торнадо | |
| Зубр | Atlant |
| АвтоФан | |
| Dominator | Uno |
| Fireball |
Перечисленные марки обладают всеми необходимыми достоинствами для обеспечения электрическим током современных автомобилей, который оснащаются двигателями внутреннего сгорания объёмом до 2 литров.
У Вас был или есть аккумулятор емкостью 60 ач? Тогда расскажите в комментариях какой и о своих впечатлениях о нем, это очень поможет остальным автолюбителям и сделает материал более полным и точным.
Отзывы
Николай. г. Мурманск.
Приобрёл для своей лады новый аккумулятор Вosch s4 silver ёмкостью 60 А/ч. Батарейка прекрасно крутит стартер в любую погоду, а во время полярной ночи обеспечивает хорошую видимость на дороге, даже при небольших оборотах двигателя.
Григорий. г. Ставрополь.
Очень хороший аккумулятор для машины – это Titan 6 ст 60 А/ч. Часто приходится ездить на своей мазде ночью, поэтому повышенная ёмкость АКБ необходима как воздух.
Александр. г. Керчь.
Уже более 10 лет покупаю для своего уазика аккумуляторы Forse. Изделия отличного качества, в том числе и модели повышенной ёмкости.
Сколько заряжать аккумулятор автомобильный по времени зарядным устройством
Содержание:
- Сколько заряжать аккумулятор автомобильный?
- Расчет времени зарядки
- Подготовка аккумулятора и необходимые меры безопасности
- Время зарядки в зависимости от различия аккумулятора
Зарядка АКБ при постоянном токе Зарядка при постоянном напряжении Ускоренная зарядка Как выполнить «прикуривание» авто Применение бустера Специфика применения бустера Использование сетевого зарядного устройства Как использовать ЗУ
Любому автомобилю необходим аккумулятор. Он обеспечивает работу главных узлов электронной системы. С течением времени АКБ разряжается и требует подзарядки. Для этого используется зарядное устройство.
Он обеспечивает работу главных узлов электронной системы. С течением времени АКБ разряжается и требует подзарядки. Для этого используется зарядное устройство.
Основные правила зарядки состоят из:
- Проверки фактического уровня заряда.
- Подготовки устройства.
- Соблюдение этапов зарядки и ее длительности.
- Соблюдение техники безопасности.
Сколько заряжать аккумулятор автомобильный?
Аккумулятор для авто считается полностью заряженным, если электролит начинает закипать. В среднем АКБ заряжается около 9 часов. Однако это считается примерным значением. Как правило, время зарядки авто разное и зависит оно от текущего заряда батареи.
Эксперты не рекомендуют делать сильные перезаряды, поскольку на свинцовой пластине появляется накипь, после которой АКБ уже невозможно восстановить. Чтобы этого не случилось, необходимо периодически измерять плотность электролита, особенно зимой. Летом подзарядка осуществляется, когда емкость аккумулятора составляет 50%, в зимний период данное значение составляет 25%.
Летом подзарядка осуществляется, когда емкость аккумулятора составляет 50%, в зимний период данное значение составляет 25%.
Как видно данный процесс не трудный, необходимо лишь соблюдать правила безопасности, тогда устройство будет служить долго и отлаженно.
Расчет времени зарядки
Чтобы узнать, сколько времени нужно для зарядки автомобильного аккумулятора, нужно воспользоваться простой формулой:
Т=C/I+10%
- Т – время зарядки,
- С – емкость аккумулятора,
- I – мощность зарядного устройства,
- 10% – потеря энергии в качестве тепла.

Подготовка аккумулятора и необходимые меры безопасности
ВАЖНО ЗНАТЬ! После того, как текущий уровень зарядки был установлен, начинаем заправку АКБ с соблюдением всех правил. Каждое действие следует выполнять аккуратно и осторожно.
Основные этапы подготовки АКБ автомобиля:
- В первую очередь необходимо снять клеммы, отключив питание от бортовой сети. Отсоединить аккумулятор и установить на место для зарядки.
- Очистите клеммы от загрязнений, смазочного материала и окислений. Это улучшит контакт в процессе заправки и работы.
- Корпус батареи нужно вытереть, чтобы понизить ее тепловую нагрузку. Для этого используйте сухую мягкую ткань, смоченную в растворе из нашатырного спирта и соды (в пропорции 1:1).
- Затем аккуратно выверните крышки банок АКБ либо отсоедините заглушку. Данный этап важен, поскольку при закрытой крышке пары электролита могут выйти и внутри аккумулятора образоваться опасное давление.

- Проконтролируйте, сколько электролита находится в банке. Если его недостаточно, залейте каждую банку дистиллированной водой до полного покрытия внутренних пластинок.
- Перед подзарядкой, осмотрите визуально поверхность корпуса оборудования. Убедитесь в целостности. Если имеются нарушения или механические повреждения, не ремонтируйте его и не заряжайте. В данной ситуации обратитесь в специализированную организацию по сервису подобных автомобильных аксессуаров.
Время зарядки в зависимости от различия аккумулятора
Есть два вида батарей: обслуживаемые и необслуживаемые (или малообслуживаемые). В таких АКБ присутствует кислота и среднестатистическому пользователю работать с таким устройством не рекомендуется. Химическая жидкость, капая на одежду, может ее прожечь. Если кислота капает на кожу, нужно моментально помыть пораженный участок проточной холодной водой. Эксперты не рекомендуют использовать и заряжать неисправный аккумулятор, если пользователь не обладает конкретными знаниями и с большим опытом. Лучше задать вопрос эксперту, который поможет и расскажет, как заряжать аккумулятор дома самостоятельно и в какой ситуации этого не нужно делать.
Лучше задать вопрос эксперту, который поможет и расскажет, как заряжать аккумулятор дома самостоятельно и в какой ситуации этого не нужно делать.
Чем же отличаются обслуживаемые батареи от необслуживаемых, сколько ампер нужно для зарядки. Есть обслуживаемые АКБ, имеющие прямой доступ к банкам, где можно контролировать уровень, плотность и оттенок электролита. Это помогает грамотно проводить обслуживание и ремонт батареи.
На корпусе необслуживаемого АКБ крышка герметично зафиксирована, в ней отсутствуют какие-либо отверстия. Внутрь банок нет доступа. В некоторых есть индикатор заряда, по которому можно увидеть, сел ли АКБ или находится в хорошем состоянии. Необслуживаемые называются так потому, что никаких действий с ними произвести невозможно, кроме того, как поставить на подзарядку.
Одна из характеристик необслуживаемого АКБ в том, что вода из него никуда не испаряется, даже при перезаряде, так как попадает в систему фильтрации клапанного механизма верхней крышки. А когда в АКБ остывает вода, она конденсирует обратно в банки. Но пластины при частом или долгом перезаряде могут разрушаться, что приводит в негодность батареи, а соответственно цвет электролита становится багровым. В этом случае АКБ перестает держать заряд и передавать заявленный ампераж, поэтому подлежит утилизации.
А когда в АКБ остывает вода, она конденсирует обратно в банки. Но пластины при частом или долгом перезаряде могут разрушаться, что приводит в негодность батареи, а соответственно цвет электролита становится багровым. В этом случае АКБ перестает держать заряд и передавать заявленный ампераж, поэтому подлежит утилизации.
Если сравнивать два типа устройств, то дольше будет служить необслуживаемая конструкция. Надо сказать, что у профессионального автомобилиста и новый родной аккумулятор прослужит дольше, но таких водителей сейчас мало. А на автомобильном рынке на данный момент около 70% необслуживаемых видов. Если говорить о сроке годности АКБ, то выбирайте лучше проверенных известных производителей, которые дают гарантию. Они будут стоить дороже, но работать будут около 7 лет точно.
Необслуживаемый вид
Принцип зарядки необслуживаемого АКБ в том, что мы берем 10% от общей емкости. Если мы берем 60 А.ч., то максимально допустимый ток – 6 А.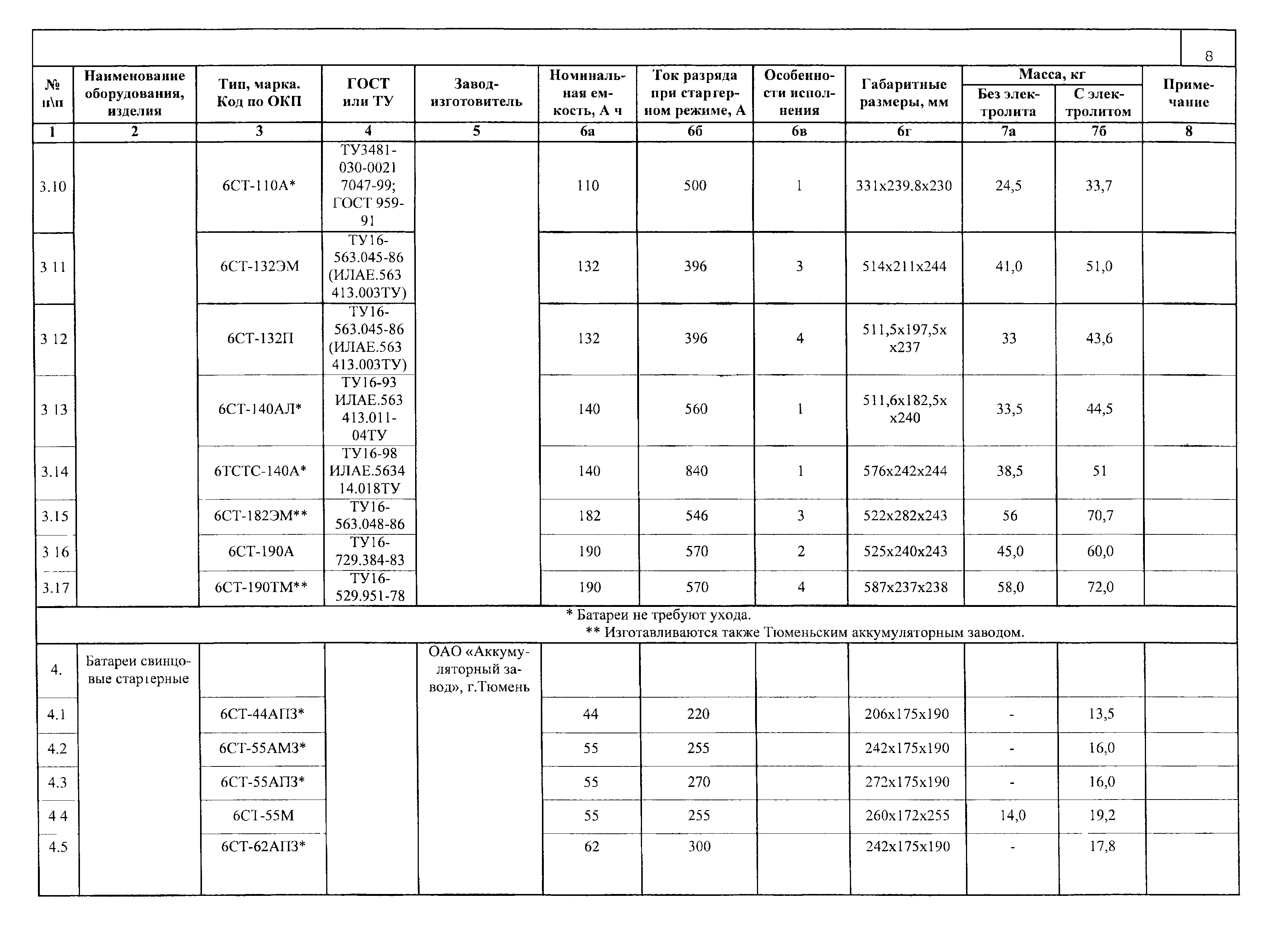 Но лучше заряжать щадящим током, то есть 3 А. По времени будет заряжаться дольше, но сохранит свойства пластин и меньше подвергнет их разрушению. А лучше заряжать автоматическими зарядными устройствами, которые выдают импульсный ток от малого к большему, что не приводит к сильному скоплению газов и разрушает сульфитацию пластин.
Но лучше заряжать щадящим током, то есть 3 А. По времени будет заряжаться дольше, но сохранит свойства пластин и меньше подвергнет их разрушению. А лучше заряжать автоматическими зарядными устройствами, которые выдают импульсный ток от малого к большему, что не приводит к сильному скоплению газов и разрушает сульфитацию пластин.
Неудобство лишь в том, что необходимо точно знать, насколько разряжено устройство и сколько нужно заряжать автомобильный аккумулятор 60 А.ч. Для этого нужно вычислить его емкость.
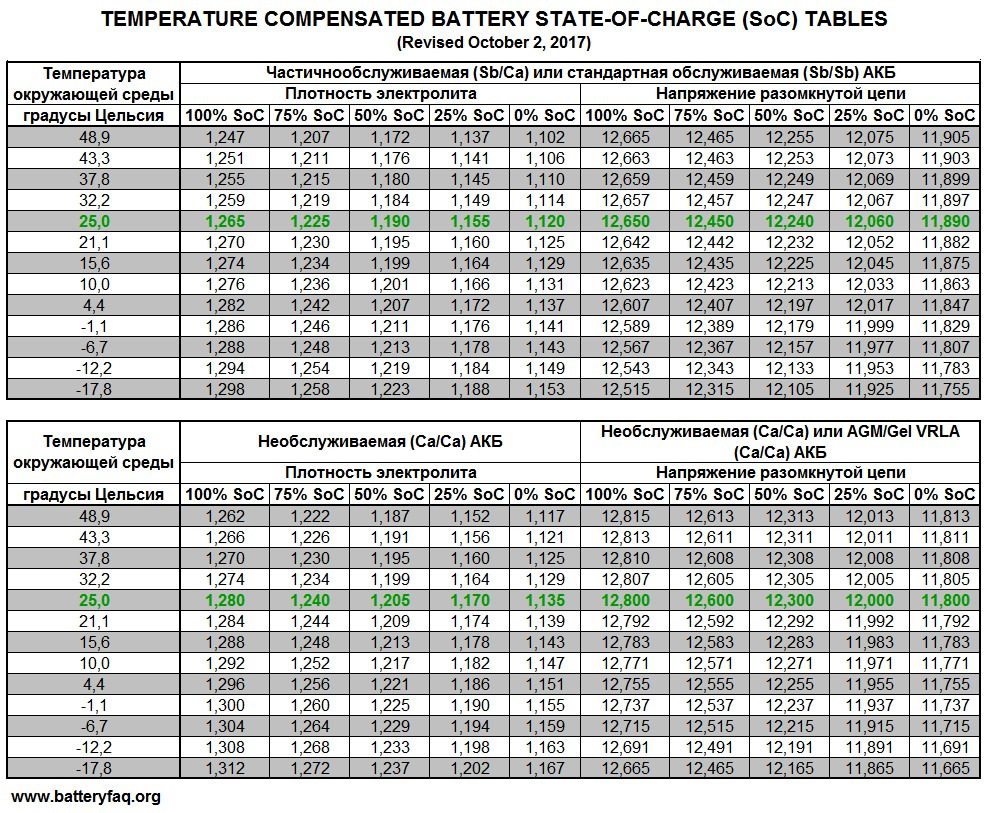
Сделать это просто. Известно, что 100% заряд – это напряжение в 12,7 Вольт. Соответственно плотность электролита будет 1,27. Плотность измеряется ареометром. А напряжение в разряженном аккумуляторе составляет 11,7 Вольт, плотность его составляет 1,1. Разряд может быть еще больше и равняться 10 Вольт, но этого допускать категорически не рекомендуется.
Если посчитать, то разница составит 1 В, то есть 12,7 – 11,7. Полученное значение делим на 10 и получаем 0,10 В, это есть 10% от заряда.
Далее 0,1 х 5 = 0,5 и прибавляем 11,7 = 12,2 В. В этом случае разряд составит 50%.
Также известно, что емкость автомобильного аккумулятора составляет 55 – 60 – 75 и так далее Ампер часов. Иными словами это значение он может отдать за 1 час. В том случае если разряд равен 50% на аккумуляторе 60 ач, то соответственно ушло 30 емкости.
Для того, чтобы восполнить половину, необходимо подать ток на батарею. Если подать 30 А или 25 Ампер, то это может убить устройство. Рекомендуется подавать всего 10%, это 6Ампер. Поскольку необходимо восполнить половину, то 30 разделим на 6, равняется 5 часов. В результате заряд будет длиться 5 часов.
Таким образом, главное определить верхнее и нижнее значение уровня разряда и тогда можно правильно зарядить необслуживаемый аккумулятор.
Обслуживаемый тип
Процесс зарядки необслуживаемого и обслуживаемого аккумулятора автомобиля отличается. Для исправного вида надо присоединить зарядное устройство к обоим клеммам. Затем нужно подзаряжать аккумулятор автомобиля зарядным устройством. Включайте его так в сеть, чтобы не образовывались искры. Используя регулятор тока, зафиксируйте ток, требуемый для подзарядки.
Нормальным значением тока считается 1/10 от емкости конструкции. Если у пользователя изделие на 60 ампер часов, то ток равняется 6 Ампер. Если 100 а/ч, то соответственно – 10 Ампер.
В ходе зарядки обслуживаемого типа пробки нужно выкрутить, поскольку АКБ будет заряжаться, и расти напряжение. Вместе с тем внутри конструкции идет процесс закипания. В итоге образуется скопление газов, можно визуально наблюдать пар, из-за чего изделие воспламеняется. В связи с этим нужно заправлять батарею в хорошо проветриваемой комнате. При этом нельзя курить, что-либо поджигать, чтобы не допустить образования искры и дыма. Если пробки не будут откручены при увеличении напряжения и газообразовании, перепускные клапаны не будут функционировать, и произойдет взрыв.
Зарядка АКБ при постоянном токе
Для успешной и эффективной подзарядки батареи постоянным током, нужно подключить ее к зарядному устройству, которое максимально будет выдавать 16,5 В. Сила тока при 10-тичасовой зарядке составит 1/10 Ср (Ср – номинальная емкость батареи).
Плюсом зарядки постоянным током является быстрота зарядки АКБ, что не всегда является качественным процессом. Потому что свинцовые пластины АКБ состоят из свинца, а если АКБ не новый, то их покрывает сульфатация. Чтобы зарядить аккумулятор качественно и полностью на все 100% нужно параллельно подвесить на минусовую и плюсовую клеммы 3-20 Вт лампочку, что приведет в активность пластины, быстрее их разогреет и снимет часть сульфатации.
К минусам этого способа зарядки считается:
- Нужно стабилизировать силу тока.
- Большое скопление газов.
- Повышение температуры.
Для того чтобы понизить указанные отрицательные эффекты используют 2-хступенчатый режим зарядки. При 1–ступенчатом режиме осуществляют зарядку током 0,1 Ср до тех пор, пока батарея не достигнет напряжения в 14,4 Вольт. После этого заряжают током, сниженным в пару раз.
Зарядка при постоянном напряжении
Таким способом заряжается автомобильный аккумулятор до 95% номинальной емкости и живет дольше. Минус этого способа – существенный прогрев устройства из-за увеличенной силы тока в изначальной зарядке. Напряжение источника, к которому подключается аккумулятор, будет постоянным. Зависимо от значения напряжения, ток достигает максимальной силы, потом по ходу зарядки понижается до нулевой отметки. Как правило, напряжение источника равняется от 14,6 до 15 Вольт.
Сразу после включения в розетку, ток зарядки устанавливается в соответствии с такими факторами:
- Выходное напряжение источника питания.
- Степень заряженности АКБ.
- Температура электролита.
Согласно всем этим параметрам в изначальный момент, заряд достигает 100%-ного значения от своей емкости. Для нового аккумулятора, но разряженного, подобные высокие значения тока не принесут вреда. Несмотря на большой ток вначале зарядки, продолжительность зарядного процесса равняется длительности зарядки при постоянстве тока. Это связано с тем, что окончательный этап проходит при небольших значениях силы тока.
Такой способ зарядки позволяет оперативно зарядить аккумулятор до 100% состояния. Сообщаемая энергия в начале зарядного процесса затрачивается практически вся на целиком всю зарядку. Таким образом, восстанавливает активную массу на аккумуляторной пластине. При этом газы не образуются. Соответственно, зарядке при постоянном напряжении поможет ускорить зарядку.
Данный процесс применяется даже при восстановлении необслуживаемых устройств, поскольку в них невозможно установить и контролировать плотность электролита.
Ускоренная зарядка
Польза от «прикуривания» машины будет, если прочие устройства цепи зажигания работают безотказно. Когда техника разрядилась, имеет смысл просить соседа по стоянке оказать услугу. Прибегать к аварийному способу запуска современного автомобиля, посредством другого авто, нужно в самых крайних случаях, потому что CAN системы чувствительны к скачкам напряжения.
Перепады тока в электрической цепи автотранспортного средства приводят к ошибкам в памяти контроллера и прочим сбоям в автоэлектрике. Несмотря на технологические модернизации систем зажигания, пользоваться указанным методом следует в исключительном случае. Лучшее решение не попадать в подобные ситуации – поддерживать исправное техническое состояние аккумуляторной батареи.
Как выполнить «прикуривание» авто
Чтобы запустить автомобиль при разряженной аккумуляторной батарее, потребуется комплект проводов с сечением не меньше 10 мм² и зажимами в удовлетворительном состоянии. Дальнейшие шаги:
- Подгоняется вторая машина.
- Двигатель вспомогательного авто глушить нельзя.
- Плюсовые клеммы соединяются кабелем.
- Сначала подключается плюс АКБ легковушки соседа, потом в другой машине.
- Затем работа ведется с минусовыми клеммами по указанной выше схеме.
Несложный способ позволяет выполнить быструю зарядку источника электрического тока.
ВАЖНО! Для исключения риска короткого замыкания, последовательность описанных действий необходимо соблюдать.
После 10-15 минут «прикуривания» провода можно отсоединить. Заводить неисправный автомобиль при аварийной подзарядке нельзя. Основная нагрузка, в короткий промежуток времени, ложится на генератор. Дополнительный отбор мощности приведет к выходу из строя элемента навесного оборудования. Многие водители спешат возразить, что устройству в этом случае ничего не грозит. Целостность генератора зависит от сечения кабеля и сопротивления. Если жилы тонкие, может, обойдется без эксцессов, но рисковать не рекомендуется.
В автотранспортных средствах с дизельными или инжекторными ДВС, пуск силовой установки в аварийной машине следует выполнять при включенном двигателе второго авто. Успеют прогреться калильные свечи (в дизеле), запустится бензонасос, создав необходимое давление (в инжекторе). Если попытка запуска мотора удалась, клеммы можно отключать. Действия выполняются в обратной последовательности относительно подключения.
Применение бустера
Современное функциональное устройство не менее эффективно поможет быстро подзарядить аккумулятор. Бустеры – это мобильные АКБ малой емкости. Они не предназначены для пуска генератора и используются в качестве вспомогательного источника тока для подзарядки автомобильной батареи.
Специфика применения бустера
Устройства изготавливаются в двух вариантах:
- Подключение к «прикуривателю». Основной плюс – небольшие размеры. Минус – невысокий КПД. Если нужное «гнездо» подключается к АКБ одновременно с поворотом ключа зажигания, что создает дополнительную нагрузку, бустер начнет разряжаться.
- Использование клемм. В этом случае заряжать аккумуляторную батарею можно без активации функции зажигания.
Рекомендации, как зарядить подсевший источник тока в машине посредством бустера фактически одинаковые, как и в примере «прикуривания» с помощью другого авто.
Использование сетевого зарядного устройства
Автомобилист в критической ситуации может пользоваться зарядным устройством в качестве донорского источника тока для зарядки автомобильной батареи. Ключевое условие выполнения работы – в зарядном устройстве не должно быть неотключаемой автоматики. В противоположном случае, прибор не сможет подзарядить севший аккумулятор.
При любом типе АКБ подается максимальный ток. Это безопасно, потому что аккумулятор разряжен, и процесс перезаряда, который негативно влияет на функциональность автомобильной батареи, не успеет произойти. На выходе зарядного устройства напряжение будет, ориентировочно 14-15 Вольт, что несколько выше привычных значений, но не является опасным для электронных систем.
Как использовать ЗУ
С увеличением ключевых показателей тока можно сделать вывод, что заправка батареи началась. Движение ионов между пластинами активизировалось, сульфат свинца начал растворятся. В данном случае нужно вытащить ЗУ от автобатареи и включить зажигание поворотом ключа. Двигатель заработает, а элемент навесного оборудования – генератор, начнет преобразовывать механическую энергию в электрический ток.
Покупка зарядного устройства для зарядки автомобильного аккумулятора дома позволит пользователю самостоятельно обслуживать свой транспорт. Для этого не нужно обращаться в сервис, что существенно сэкономит время и деньги автовладельца. Благодаря зарядному устройству вы быстро сможете зарядить свинцовый аккумулятор перед длительной поездкой, чтобы полностью восстановить его ресурс.
Итак, вы знаете, сколько времени заряжать автомобильный аккумулятор и насколько хватает заряда АКБ разного типа. Сейчас производители делают современные батареи надежные, безопасные и долговечные, однако всегда соблюдайте правила техники безопасности и правильно заряжайте АКБ, чтобы не допустить преждевременного износа пластин.
| Наименование | Масса без учета электролита, кг |
| Аккумулятор ПСК, СК-1 | 6,8 |
| Аккумулятор ПСК, СК-2 | 12 |
| Аккумулятор ПСК, СК-3 | 16 |
| Аккумулятор ПСК, СК-4 | 21 |
| Аккумулятор ПСК, СК-5 | 25 |
| Аккумулятор ПСК, СК-6 | 30 |
| Аккумулятор ПСК, СК-8 | 37 |
| Аккумулятор ПСК, СК-10 | 46 |
| Аккумулятор ПСК, СК-12 | 53 |
| Аккумулятор ПСК, СК-14 | 61 |
| Аккумулятор ПСК, СК-16 | 68 |
| Аккумулятор ПСК, СК-18 | 101 |
| Аккумулятор ПСК, СК-20 | 110 |
| Аккумулятор ПСК, СК-24 | 138 |
| Аккумулятор ПСК, СК-28 | 155 |
| Аккумулятор ПСК, СК-32 | 172 |
| Аккумулятор ПСК, СК-36 | 188 |
| Аккумулятор ПСК, СК-40 | 208 |
| Аккумулятор ПСК, СК-44 | 226 |
| Аккумулятор ПСК, СК-48 | 243 |
| Аккумулятор ПСК, СК-52 | 260 |
| Аккумулятор ПСК, СК-56 | 278 |
| Аккумулятор ПСК, СК-60 | 295 |
| Аккумулятор ПСК, СК-64 | 312 |
| Аккумулятор ПСК, СК-68 | 330 |
| Аккумулятор ПСК, СК-72 | 347 |
| Аккумулятор ПСК, СК-76 | 365 |
| Аккумулятор ПСК, СК-80 | 382 |
| Аккумулятор ПСК, СК-84 | 397 |
| Аккумулятор ПСК, СК-88 | 414 |
| Аккумулятор ПСК, СК-92 | 434 |
| Аккумулятор ПСК, СК-96 | 450 |
| Аккумулятор ПСК, СК-104 | 467 |
| Аккумулятор ПСК, СК-108 | 487 |
| Аккумулятор ПСК, СК-112 | 506 |
| Аккумулятор ПСК, СК-116 | 524 |
| Аккумулятор ПСК, СК-120 | 541 |
| Аккумулятор ПСК, СК-124 | 559 |
| Аккумулятор ПСК, СК-128 | 577 |
| Аккумулятор ПСК, СК-132 | 592 |
| Аккумулятор ПСК, СК-136 | 312 |
| Аккумулятор ПСК, СК-140 | 631 |
Сколько свинца в аккумуляторе | Таблица содержания свинца по маркам АКБ
От того, сколько свинца в аккумуляторе, зависит цена источника питания при продаже на лом. Зная точное количество металла, вы решите, как поступить с батареей: разобрать и сдать чистый цветной металл или отправить на переработку в собранном виде.
Содержание свинца в различных типах аккумуляторов
Приём б/у аккумуляторов включает анализ устройства на содержание металлов в составе. Количество цветмета зависит от ёмкости АКБ и представлено такими значениями:
- 55 А/ч. Всего – до 10,5 кг свинца. Извлечь без специального оборудования получится около 3-3,5 кг.
- 60 А/ч. Всего – 12 кг. Сколько свинца в АКБ доступного к самостоятельному извлечению? Только 3,4 кг чистого сплава.
- 75 А/ч. Всего – 15,5 кг. Для самостоятельного извлечения доступно 4,5 кг.
- 90 А/ч. Всего – 19 кг, из которых вы извлечёте 5,5 кг.
- 190 А/ч. Всего – 30 кг, количество добываемое вручную сплава – 8-9 кг.
Чаще встречаются источники питания на 55, 60 и 190 А/ч. Ёмкие модели выгоднее разбирать и сдавать на лом чистый металл.
Сколько электролита в аккумуляторе?
Сколько свинца в 1 аккумуляторе зависит от содержания электролита. Рабочее вещество занимает 20-25% от массы устройства. Точный объём жидкости связан с ёмкостью источника.
В батареях на 55 А/ч – 2,5 литра электролита. Для моделей на 60 А/ч используют на 0,2-0,5 литра больше. Чем выше ёмкость устройства, тем больше электролита требуется.
Вес составных частей аккумулятора
Когда проводится скупка аккумуляторов, важно не только сколько свинца в автомобильном аккумуляторе или устройствах другого типа. Важен вес всех элементов конструкции, так как некоторые из них тоже подходят для утилизации и могут принести доход.
Общее содержание неметаллических элементов, а также цветных металлов другого вида – 10-12% от массы устройства. Для установления точного веса понадобится разобрать источник питания и взвесить каждую пластину и другие составляющие. В обычном АКБ на 55 Ампер содержится 1,5-1,7 кг неметаллических элементов (то есть выполненных из ПВХ).
Зачем знать содержание свинца в аккумуляторе?
Компания К-2 занимается скупкой металлолома, в том числе источников питания для переработки и утилизации. Зная, сколько цветного металла в устройстве, вы заранее просчитаете стоимость батареи и выберите удобный вариант сотрудничества – с самостоятельным разбором и АКБ на цветмет или предоставив сортировку и прочие сложные работы нашим сотрудникам.
Аккумуляторы стартерные
| Наименование | Масса, кг |
| Аккумулятор 6 ст-55 | 12,1 |
| Аккумулятор 6 ст-60 | 13,2 |
| Аккумулятор 6 ст-66 | 14,3 |
| Аккумулятор 6 ст-74 | 15,4 |
| Аккумулятор 6 ст-77 | 16,2 |
| Аккумулятор 6 ст-90 | 20,5 |
| Аккумулятор 6 ст-100 | 19,8 |
| Аккумулятор 6 ст-110 | 25,6 |
| Аккумулятор 6 ст-132 | 31,4 |
| Аккумулятор 6 ст-140 | 36,9 |
| Аккумулятор 6 ст-190 | 47,9 |
| Аккумулятор 6 ст-215 | 27,3 |
| Аккумулятор 3 ст-150 эм | 23,2 |
| Аккумулятор 3 ст-155 эм | 25 |
| Аккумулятор 3 ст-215 эм | 35,8 |
| Аккумулятор 6 ст-50 эм | 17,5 |
| Аккумулятор 6-ст 55 эм | 19,2 |
| Аккумулятор 6 ст-60 эм | 21,1 |
| Аккумулятор 6 ст-75 эм | 25,6 |
| Аккумулятор 6 ст-75 тм | 23,9 |
| Аккумулятор 6 ст-90 эм | 30,4 |
| Аккумулятор 6 ст-132 эм | 43,1 |
| Аккумулятор 6 ст-182 эм | 60,4 |
| Аккумулятор 6 ст-190 тм | 61,7 |
Стационарные АКБ открытого типа
| Наименование | Масса, кг |
| Аккумулятор ПСК, СК-1 | 6,8 |
| Аккумулятор ПСК, СК-2 | 12 |
| Аккумулятор ПСК, СК-3 | 16 |
| Аккумулятор ПСК, СК-4 | 21 |
| Аккумулятор ПСК, СК-5 | 25 |
| Аккумулятор ПСК, СК-6 | 30 |
| Аккумулятор ПСК, СК-8 | 37 |
| Аккумулятор ПСК, СК-10 | 46 |
| Аккумулятор ПСК, СК-12 | 53 |
| Аккумулятор ПСК, СК-14 | 61 |
| Аккумулятор ПСК, СК-16 | 68 |
| Аккумулятор ПСК, СК-18 | 101 |
| Аккумулятор ПСК, СК-20 | 110 |
| Аккумулятор ПСК, СК-24 | 138 |
| Аккумулятор ПСК, СК-28 | 155 |
| Аккумулятор ПСК, СК-32 | 172 |
| Аккумулятор ПСК, СК-36 | 188 |
| Аккумулятор ПСК, СК-40 | 208 |
| Аккумулятор ПСК, СК-44 | 226 |
| Аккумулятор ПСК, СК-48 | 243 |
| Аккумулятор ПСК, СК-52 | 260 |
| Аккумулятор ПСК, СК-56 | 278 |
| Аккумулятор ПСК, СК-60 | 295 |
| Аккумулятор ПСК, СК-64 | 312 |
| Аккумулятор ПСК, СК-68 | 330 |
| Аккумулятор ПСК, СК-72 | 347 |
| Аккумулятор ПСК, СК-76 | 365 |
| Аккумулятор ПСК, СК-80 | 382 |
| Аккумулятор ПСК, СК-84 | 397 |
| Аккумулятор ПСК, СК-88 | 414 |
| Аккумулятор ПСК, СК-92 | 434 |
| Аккумулятор ПСК, СК-96 | 450 |
| Аккумулятор ПСК, СК-104 | 467 |
| Аккумулятор ПСК, СК-108 | 487 |
| Аккумулятор ПСК, СК-112 | 506 |
| Аккумулятор ПСК, СК-116 | 524 |
| Аккумулятор ПСК, СК-120 | 541 |
| Аккумулятор ПСК, СК-124 | 559 |
| Аккумулятор ПСК, СК-128 | 577 |
| Аккумулятор ПСК, СК-132 | 592 |
| Аккумулятор ПСК, СК-136 | 312 |
| Аккумулятор ПСК, СК-140 | 631 |
| Аккумулятор СКЭ-16 | 69 |
| Аккумулятор СКЭ-18 | 75 |
| Аккумулятор СКЭ-20 | 85 |
| Аккумулятор СКЭ-24 | 105 |
| Аккумулятор СКЭ-28 | 120 |
| Аккумулятор СКЭ-32 | 144 |
| Аккумулятор СКЭ-36 | 159 |
| Аккумулятор СКЭ-40 | 176 |
| Аккумулятор СКЭ-44 | 191 |
| Аккумулятор СКЭ-48 | 208 |
| Аккумулятор СКЭ-52 | 223 |
| Аккумулятор СКЭ-56 | 240 |
| Аккумулятор СКЭ-60 | 255 |
| Аккумулятор СКЭ-64 | 271 |
| Аккумулятор СКЭ-68 | 287 |
| Аккумулятор СКЭ-72 | 303 |
| Аккумулятор СКЭ-76 | 319 |
Стационарные АКБ закрытого типа
| Наименование | Масса, кг |
| Аккумулятор 3 СН-36 | 13,2 |
| Аккумулятор СН-72 | 7,5 |
| Аккумулятор СН-108 | 9,5 |
| Аккумулятор СН-144 | 12,4 |
| Аккумулятор СН-180 | 14,5 |
| Аккумулятор СН-216 | 18,9 |
| Аккумулятор СН-228 | 23,3 |
| Аккумулятор СН-360 | 28,8 |
| Аккумулятор СН-432 | 34,5 |
| Аккумулятор СН-504 | 37,8 |
| Аккумулятор СН-576 | 45,4 |
| Аккумулятор СН-648 | 48,6 |
| Аккумулятор СН-720 | 54,4 |
| Аккумулятор СН-864 | 64,5 |
| Аккумулятор СН-1008 | 74,2 |
| Аккумулятор СН-1152 | 84 |
Сухозаряженный аккумулятор | Дом АКБ
- Аккумулятор 6ст 190 сухозаряженный(сухой) /ЦЕНА ПО ЗАПРОСУ
- Аккумулятор 6ст 132 сухозаряженный(сухой) /ЦЕНА ПО ЗАПРОСУ
- Аккумулятор 6ст 90 сухозаряженный(сухой) /ЦЕНА ПО ЗАПРОСУ
- Аккумулятор 6ст 60 сухозаряженный(сухой) /ЦЕНА ПО ЗАПРОСУ
Дом АКБ предлагает купить сухозаряженный или сухой аккумулятор оптом или поштучно:
Сухозаряженный аккумулятор (АКБ) представляет собой «сухую», т.е. не содержащую электролита батарею, при этом пластины в такой АКБ — заряжены перед сборкой на заводе-изготовителе в процессе производства (они проходят «формовку»: зарядку, промывку и просушку в потоке горячего воздуха). Кроме того, пробки герметично закрыты и предохраняют пластины аккумулятора от разрушения (коррозии) под воздействием внешней среды — влаги и воздуха.
Кроме того, транспортировка сухозаряженных батарей может быть более выгодна: они легче и не содержат «едкого» электролита.
На этом преимущества сухих АКБ заканчиваются: они не готовы к немедленному использованию, их нельзя проверить на работоспособность без заливки электролитом, хотя обычно проблем не возникает.
Итак, вы приобрели сухозаряженный аккумулятор, что дальше ?
Необходимо запастись качественным (купленным в хорошем магазине) электролитом с плотностью 1,27 — 1,29 г/см.куб. в объеме (или чуть больше), согласно табл. 1. Это гораздо проще и безопаснее, чем готовить электролит самостоятельно, смешивая серную кислоту с дистиллированной водой, т.к. возможно разбрызгивание реагентов. Помните, что запрещается вливать воду в серную кислоту.
- Не пренебрегайте защитными средствами от агрессивного воздействия электролита (очки, резиновые перчатки, кислотостойкая одежда, головной убор и обувь). В случае попадания электролита на кожу промойте пораженные места водой и затем — раствором питьевой соды для нейтрализации. Рекомендуем перед заливкой приготовить раствор питьевой соды (например, в ведре) и ветошь.
- Понадобятся также ареометр (для контроля плотности электролита), нагрузочная вилка (для контроля напряжения батареи под нагрузкой и без нагрузки) и, возможно, стационарное зарядное устройство.
- Перед заливкой необходимо разгерметизировать батарею, срезав приливы на вентиляционных каналах пробок, либо вынув заглушки из боковых поверхностей крышки моноблока, в зависимости от конструкции батареи. Встречаются батареи с пробками, уже имеющими отверстия для вентиляции газов.
- Заливку электролитом необходимо производить при комнатной температуре (температура электролита должна быть от плюс 15 С до плюс 30 С) и в хорошо проветриваемом помещении. Очередность заливки банок особого значения не имеет. Заливать электролит необходимо до отметки «мах» при ее наличии на корпусе АКБ. Если нет метки или корпус не прозрачный, обеспечьте уровень 15 — 20 мм выше верхних кромок пластин (замеряется путем погружения стеклянной трубки, входящей в комплект ареометра, в очередную банку до защитного щитка пластин, после чего зажимается пальцем, вынимается трубка и визуально определяется уровень электролита).
- Не ранее, чем через 20 мин., и не позже, чем через 2 часа после заливки, необходимо проконтролировать плотность электролита. Если она не менее 1,25 г/см.куб., то батарея готова к эксплуатации. В противном случае, а также при напряжении без нагрузки менее 12,5 В, батарею необходимо подвергнуть зарядке от стационарного зарядного устройства.
В любом случае, подзарядку батареи необходимо осуществлять только после пропитки аккумулятора электролитом.
Подзарядку АКБ проводите согласно инструкции на зарядное устройство; не забудьте вывернуть пробки и обеспечить хорошую вентиляцию.
После заливки/зарядки необходимо ввернуть крышки и тщательно протереть корпус аккумулятора раствором соды для нейтрализации электролита. Не забудьте, также, надежно закрепить батарею в гнезде. Клеммы следует очистить от окислов шлифовальной бумагой и обработать смазкой (Литол 24, WD-40).
С увеличением срока хранения сухозаряженного аккумулятора, время подзарядки после заливки также возрастает. Например, не 3-4 часа как в первый год, а 6-10 часов при хранении более года.
Стоит отметить, что качественный аккумулятор, срок хранения которого не превышает 6 — 12 мес., после заливки, вполне может быть подзаряжен на автомобиле (если после пропитки напряжение не менее 12,5 В и плотность в норме).
Компания Дом «АКБ» предлагает Вам купить сухозаряженные аккумуляторные батареи оптом по привлекательной цене.
Специалист по продажам
Компания Дом «АКБ»
Зарядка аккумулятора автомобиля — как правильно заряжать аккумулятор автомобиля
Аккумуляторная батарея является одним из важнейших узлов автомобиля. Ее назначение — обеспечить достаточным количеством электричества бортовую сеть. Если на работающем двигателе аккумулятору помогает генератор, то запуск мотора и питание потребителей при заглушенном моторе целиком и полностью обеспечивает АКБ.
Содержание:
- Меры безопасности
- Как определить, заряжен или разряжен аккумулятор?
- Как правильно заряжать аккумулятор: техника безопасности
- Методы зарядки
- Сколько времени необходимо заряжать аккумулятор
- Каким током и напряжением следует заряжать аккумулятор автомобиля
- Последствия глубокого разряда, и как правильно зарядить после этого
- Зарядка зимой
- Как часто нужно заряжать аккумулятор автомобиля
- Нужно ли заряжать новый аккумулятор для автомобиля
Оказаться в автомобиле, который отказывается заводиться в холодную погоду неприятно, поэтому батарея требует к себе пристального внимания. Важнейшим условием стабильной работы этого прибора является своевременная зарядка аккумулятора автомобиля. В необслуживаемых батареях важно контролировать, чтобы АКБ не разряжалась ниже определенного уровня. В обслуживаемых вариантах необходимо дополнительно следить за плотностью электролита и его количеством.
Меры безопасности
Для того чтобы застраховаться от получения травм, необходимо соблюдать ряд правил.
- Помещение, в котором будет проходить работа, должно либо иметь приточную вентиляцию достаточной производительности, либо хорошо проветриваться. Газы, которые выделяются в процессе, токсичны, и крайне негативно влияют на организм человека. В жилых помещениях заряжать аккумулятор автомобиля не стоит.
- Поблизости не должно быть открытого огня. Недопустимо проведение работ или совершение других действий, приводящих к образованию искр. Выделяемые газы огнеопасны, и возгорание может привести к взрыву и другим тяжелым последствиям.
- Запрещается наклонять и переворачивать аккумулятор. Такие действия приводят к выливанию чрезвычайно агрессивной и токсичной жидкости наружу. Батарея должна быть установлена на ровной твердой площадке в устойчивом положении.
- Недопустимо применение самодельных устройств. Ошибки сборки, поломки могут привести к ожогам и другим травмам.
- Нельзя касаться руками клемм батареи в процессе работы.
- Необходимо соблюдать полярность при подключении устройства.
- Все работы необходимо производить в резиновых перчатках и защитных очках.
Когда аккумулятор заряжается при помощи устройства непосредственно на автомобиле, необходимо отсоединить плюсовую и минусовую клеммы. Нельзя допускать чрезмерного кипения электролита. Пополнять заряд, не снимая клеммы опасно. Кислота, выплеснувшаяся в подкапотное пространство, может повредить изоляцию проводов, резиновые и пластмассовые детали. При подключенном аккумуляторе возможно замыкание электрической цепи, что чревато возгоранием.
Как определить, заряжен или разряжен аккумулятор
По мере эксплуатации любая АКБ теряет энергию. Существует несколько способов определить состояние батареи.
- При помощи встроенного индикатора, которым оснащено большинство современных изделий. Роль индикатора играет поплавок в виде шарика, погруженный в электролит. Все это находится внутри прозрачной стеклянной колбы. Когда все в норме, поплавок всплывает на поверхность и отчетливо виден невооруженным взглядом. Индикатор окрашен в зеленый цвет, поэтому автолюбители ошибочно считают, что загорелась лампочка. Если индикатор не виден, аккумулятор не в оптимальном состоянии.
- Используя мультимер. С его помощью можно измерить напряжение на клеммах, что позволяет судить о состоянии батареи, надо зарядить аккумулятор автомобиля или нет. Если напряжение находится в пределах 12,6 – 12,8 В, можно считать батарею полностью заряженной. Напряжение ниже 10,5 В свидетельствует о полном разряде. Измерения следует проводить при отсоединенных клеммах, дабы исключить падение напряжения, вызванное работающими потребителями.
- С помощью нагрузочной вилки. Данный метод позволяет измерить напряжение под нагрузкой, благодаря чему можно оценить фактическую емкость АКБ. Это поможет определить, как правильно заряжать аккумулятор автомобиля. Если емкость ниже критического уровня из-за сульфатации пластин и их осыпания, обслуживать такую батарею большого смысла не имеет. Аккумулятор с низкой емкостью лучше заменить.
Если нет возможности самостоятельно провести проверку нагрузочной вилкой, есть смысл обратиться в автосервис. Большинство станций техобслуживания проверяют заряд таким оборудованием бесплатно.
Как правильно заряжать аккумулятор: техника безопасности
Предварительно необходимо удостовериться, что батарея действительно нуждается в дополнительной энергии. Когда замеры показывают, что батарея частично или полностью потеряла свои свойства, следует подготовиться к пополнению заряда. В подготовке АКБ особых сложностей нет. Необходимо соблюдать осторожность и тщательность. Попадание кислоты на кожу чревато сильными ожогами, поэтому техника безопасности должна соблюдаться неукоснительно. Последовательность действий такова:
- Отсоединить клеммы аккумулятора, как плюсовую, так и минусовую, тем самым отключив батарею от бортовой сети.
- Демонтировать прибор и поместить его в то место, где будет производиться зарядка. Во избежание перегрева очистить корпус от грязи, масла, других отложений. Заодно убедиться в отсутствии механических повреждений.
- Внимание! Обязательно вывернуть пластиковые крышки на каждой банке. В аккумуляторе под действием внешнего напряжения образуется избыточное количество паров электролита, что приводит к повышенному давлению газов внутри АКБ. В крайних случаях возможен взрыв батареи, со всеми вытекающими последствиями. В крышках имеются дренажные отверстия, но их производительности при бурной реакции недостаточно.
- Убедиться, что уровень электролита соответствует норме, иначе полноценная зарядка аккумулятора автомобиля будет недостижима. При отсутствии индикатора надо долить жидкость до положения, когда свинцовые пластины полностью закрыты, но уровень меньше нижней кромки заливного отверстия. Для точного измерения можно одним концом опустить в банку полую стеклянную трубку, так чтобы она доставала до дна. Затем зажать верхний конец и извлечь трубку. Высота столба электролита должна быть около 10 – 15 мм.
- Проверить плотность электролита. В продаже имеются недорогие ареометры, позволяющие довольно точно определить соотношение серной кислоты и дистиллированной воды. При отклонении от нормы довести плотность до требуемого состояния.
Методы зарядки
Зарядка аккумулятора автомобиля требует применения специального устройства. Бытующее среди автолюбителей мнение, что достаточно добавить дистиллированной воды или электролита, а там генератор сам доводит процесс до конца, не совсем верно.
Отчасти это так. Можно зарядить батарею от машины соседа, принудительно завести мотор, а генератор действительно зарядит АКБ до определенного уровня. Но для полной зарядки аккумулятора автомобиля, так чтобы к этому не приходилось часто возвращаться, необходим контроль напряжения и силы тока. Без специального устройства измерить эти параметры можно, но отрегулировать нет.
Перед автолюбителем встает задача: как правильно заряжать аккумулятор автомобиля, не повредив его. Сама процедура не представляет сложности. Достаточно подсоединить к клеммам соответствующие выводы устройства и следить за параметрами, не допуская перегрева АКБ.
Существует три метода, с помощью которых можно зарядить аккумулятор автомобиля:
- постоянным током;
- постоянным напряжением;
- ускоренным комбинированным методом.
Первому присуща высокая эффективность, но необходим контроль и подстройка параметров. Второй способ осуществить легче, но батарея заряжается не более чем на 80%, процесс требует длительного времени.
Комбинированный метод наиболее предпочтителен. Он позволяет зарядить аккумулятор автомобиля практически автономно, никаких регулировок не требуется. Широкому распространению этого метода препятствует в разы более высокая стоимость специального устройства.
Зарядка постоянным током
В этом случае зарядка аккумулятора автомобиля производится постоянной силой тока, которая в 10 раз меньше емкости аккумуляторной батареи. Например, АКБ емкостью 60 А.ч желательно заряжать током не выше 6 ампер. Затем силу тока в два раза уменьшают наполовину, до 3 А, а на финишном этапе до 1,5 А.
Зарядка постоянным напряжением
Этот способ, по сути, не отличается от зарядки автомобильным генератором. Отличие в том, что устройство позволяет регулировать величину напряжения, тогда как генератор — нет.
Осуществлять ее просто. Устройство подключается к клеммам АКБ и поддерживается напряжение около 14,5 вольт. Батарея считается заряженной, если сила тока при постоянном напряжении перестала уменьшаться. Как уже указывалось, таким способом можно зарядить батарею не больше чем на 80%.
Ускоренная комбинированная зарядка
В ней совмещены преимущества двух предыдущих способов. На первом этапе пополнение заряда осуществляется постоянным напряжением. По достижении определенного уровня устройство переключается на постоянный ток. Такая последовательность позволяет полностью зарядить аккумулятор автомобиля, исключает нежелательное кипение электролита.
В случае острой необходимости таким методом можно ускоренно зарядить аккумулятор автомобиля в течение получаса, даже если он полностью разряжен. Но сократится ресурс батареи.
Каждый из способов имеет свои достоинства и недостатки. Метод постоянного тока позволяет полностью, на 100%, пополнить батарею электричеством. Чем ниже сила тока, тем полнее заряд, но увеличивается время процесса. Недостатки данного метода:
- необходимость в стабилизации силы тока;
- обильное выделение паров электролита;
- нагрев АКБ.
Описанный выше ступенчатый режим, когда дважды снижается сила тока, позволяет минимизировать эти негативные моменты. Применение метода постоянного напряжения сопровождается значительным нагревом батареи из-за повышенной силы тока в начале процесса. Данный метод только частично пополняет батарею энергией.
Комбинированный метод лишен недостатков, присущих первым двум способам. В современных устройствах процесс автоматизирован. При использовании таковых исключается сильный нагрев батареи, кипение электролита, обильное выделение газов. Недостаток один — дороговизна оборудования.
Сколько времени необходимо заряжать аккумулятор
Животрепещущий вопрос для автолюбителей — как правильно заряжать аккумулятор по времени. В большинстве случаев, если батарея совсем не “убита”, с проблемой недостаточного заряда автолюбители сталкиваются при отрицательных температурах. Человек, спешащий на работу и обнаруживший, что автомобиль не заводится из-за севшего аккумулятора, старается как можно быстрее решить эту проблему. Тут применяется и прикуривание от другого автомобиля, и частичная ускоренная зарядка большими токами, лишь бы быстрее завестись. Такие действия приводят к резкому сокращению срока службы батареи. Необходимо правильно заряжать аккумулятор, соблюдая все условия. При использовании метода постоянного тока, полностью разряженная батарея, если она не имеет дефектов, приходит в соответствие с паспортными характеристиками в течение примерно 10 часов. При двухступенчатом процессе время увеличивается до 15 часов. Уменьшив силу тока, можно добиться более глубокой зарядки, но время пропорционально увеличится. Двухступенчатый процесс наиболее полно отвечает требованиям, как правильно заряжать аккумулятор. Частично разряженные батареи набирают кондиции быстрее. Критерием полной зарядки является ситуация, когда напряжение АКБ стабилизировалось на уровне 14,5 В, а сила тока при этом перестала уменьшаться. Зарядка аккумулятора автомобиля постоянным напряжением требует значительно большего времени. Продолжительность процесса составляет 20 – 25 часов. Чем выше напряжение, тем быстрее заряжается батарея. Подбирать необходимо оптимальный вариант, когда напряжение тока выше напряжения аккумуляторной батареи, но при этом не происходит чрезмерного нагрева и интенсивного кипения электролита. С другой стороны, не затрачивается чрезмерно много времени. Следует помнить, что процесс зарядки аккумулятора автомобиля нежелательно прерывать и начинать заново. Это уменьшает емкость аккумулятора и снижает ресурс.
Каким током и напряжением следует заряжать аккумулятор автомобиля
Зарядку производят при силе тока, равной десятой части емкости батареи. Для 50 А.ч соответственно 5А. Такой уровень необходимо поддерживать до тех пор, пока напряжение на клеммах аккумулятора не достигнет 14,4 – 14,6 В. Затем снижают силу тока в два раза и ждут повышения напряжения до 15 В.
Следующим этапом необходимо еще раз уменьшить силу тока в 2 раза. Через какое-то время напряжение должно достигнуть 14,5 В и перестать повышаться. С этого момента батарея считается полностью заряженной.
При зарядке постоянным напряжением его поддерживают на уровне 14,5 В. Как только сила тока стабилизируется, можно заканчивать процесс.
Последствия глубокого разряда, и как правильно зарядить после этого
Глубокий разряд оказывает губительное воздействие на АКБ. Происходит сульфатация пластин, они частично разрушаются и осыпаются. При этом падает емкость батареи, такая быстро заряжается и также быстро теряет энергию.
Лучший способ избавиться от этой проблемы — заменить аккумулятор. Но если ситуация не зашла слишком далеко, применяют переполюсовку АКБ. Для начала приводят в порядок электролит и разряжают батарею до нуля, подключив галогенную лампу.
Затем подключают устройство, но наоборот: плюс к минусу, минус к плюсу. Галогенную лампу не отсоединяют. Заряжают батарею до 5 вольт. После этого отсоединяют лампу, нормально подключают устройство и завершают процедуру в обычном порядке, как на частично разряженном аккумуляторе.
Зарядка зимой
Аккумуляторные батареи могут заряжаться при температуре окружающего воздуха от –15 до +40 ºC. Важно, чтобы плотность электролита соответствовала климатическим условиям. При понижении температуры напряжение следует увеличить, а при повышении уменьшить. Корректировочная величина — 0,03 В на 1 ºC.
Оптимальной температурой является диапазон 20–25 ºC. Поэтому в холода лучше заниматься аккумулятором в теплом помещении.
Как часто нужно заряжать аккумулятор автомобиля
Чем реже происходит зарядка внешним источником, тем долговечнее батарея, если она не разряжается ниже определенного предела. Ведь при езде эту функцию непрерывно выполняет генератор. Целесообразно проводить эту процедуру раз в год, перед наступлением холодов, и каждый раз после длительной стоянки.
Нужно ли заряжать новый аккумулятор для автомобиля
Новые аккумуляторы не нуждаются в обслуживании, если перед продажей длительное время не стояли на складе. Батарея имеет свойство медленно терять напряжение за счет саморазряда. Если от даты выпуска до установки на машину прошло полгода и больше, необходимо зарядить аккумулятор автомобиля. Точный ответ даст проверка состояния батареи.
Если знать все нюансы, как правильно заряжать аккумулятор автомобиля, которые заключаются в регулярной проверке плотности электролита, очистке клемм, своевременном исполнении процедуры — батарея долго будет долго и безотказно служить на радость владельцу.
Влияние количества электролита на литий-ионные элементы
В производственной цепочке литий-ионных аккумуляторных элементов процесс заполнения имеет первостепенное значение для качества конечного продукта и затрат. Заполнение состоит из нескольких этапов дозирования жидкого электролита в ячейку и последующего (промежуточного) смачивания компонентов ячейки. Количество залитого электролита не только влияет на скорость смачивания электродов и сепаратора, но также ограничивает емкость ячейки и влияет на срок службы батареи.Однако слишком много электролита является мертвым грузом, приводит к более низкой плотности энергии и излишне увеличивает стоимость батареи. Для обеспечения низких затрат на производство и в то же время высокого качества ячеек в данной статье исследуется оптимальное количество электролита. На основе экспериментальных данных спектроскопии электрохимического импеданса, процесса заполнения, процесса формирования, а также испытания на срок службы представлены взаимозависимости между количеством электролита, скоростью смачивания, емкостью, плотностью энергии и сроком службы для крупноформатных ячеек.
Литий-ионные батареи (LIB) в качестве электрохимических систем хранения энергии являются ключевой технологией для замены ископаемого топлива и позволяют хранить возобновляемые ресурсы из-за их малого веса, высокой плотности энергии и длительного срока службы. 1 Эти батареи за последние три десятилетия заняли доминирующее положение в потребительской электронике и послужили толчком к успеху мобильных устройств, таких как сотовые телефоны и портативные компьютеры. Таким образом, ожидается, что рынок электротранспорта и стационарного хранения энергии будет активно продвигаться за счет LIB. 2 Цель более высокой плотности энергии в автомобильных приложениях может быть достигнута за счет уменьшения процентного содержания неактивных материалов, таких как фольга токосъемника, компоненты корпуса или разделители на элемент. Это способствует тенденции к увеличению размеров ячеек 3 , а также к более толстым электродам. 4 Ячейки большого формата, однако, создают проблемы для производственных процессов, таких как заполнение жидкими электролитами. Для обеспечения надежной работы и высокой производительности все полости и поры электродов и сепаратора должны быть увлажнены перед началом цикла пласта. 5 В противном случае существует риск образования неоднородной межфазной фазы твердого электролита (SEI), которая является продуктом реакции компонентов растворителя электролита и лития на поверхности анода. 6 В то время как SEI на аноде формируется во время этих начальных циклов зарядки и разрядки, межфазная фаза катодного электролита (CEI) является результатом старения при повышенных температурах или цикличности при высоких напряжениях. 7 Преждевременная зарядка до полного смачивания может привести к сильным локальным колебаниям толщины слоя, которые могут вызвать частичные отслоения слоя. 8 Тогда, в отличие от реальной функции SEI, возможен перенос электронов от электрода к электролиту (восстановление электролита) и блокирование ионов, что отрицательно сказывается на емкости и сроке службы элемента. . 9
Увеличение количества слоев, толщины электрода и площади поверхности на ячейку еще больше снижает трудоемкое смачивание компонентов ячейки электролитом. 10 Небольшие поверхности в монетных элементах не представляют проблемы для смачивания, так как электролит может достичь всех полостей за короткое время.Однако при промышленном производстве ячеек большого формата выполняется несколько периодических циклов смачивания и формирования, в результате чего общая продолжительность составляет до 3 недель. 11 Это подразумевает значительные расходы, так как десятки тысяч циклов, а также складские помещения необходимы для управления требуемой пропускной способностью. 11
Один из способов снизить стоимость LIB — ускорить процесс смачивания. 12 Weydanz et al. 13 показали, что розлив под вакуумом до 100 мбар значительно ускоряет этот производственный этап.Habedank et al. 14 даже достиг в 12 раз более быстрого смачивания за счет лазерного структурирования электродов, что дополнительно улучшает характеристики C-скорости. 15 Состояние смачивания определяется как смоченные и насыщенные поверхности и полости электродов и сепаратора по сравнению с общими поверхностями и полостями узла ячейки. Заполнение полостей, которые представляют собой внутренние поверхности среды, можно описать как микроскопическое смачивание. А смачивание (макроскопических) поверхностей можно рассматривать как поверхностное смачивание.Первые можно измерить с помощью спектроскопии электрохимического импеданса (EIS). 16,17 Последнее можно визуализировать с помощью нейтронной радиографии. 18 Еще один способ снизить затраты на киловатт-час — это снизить материальные затраты, например, за счет минимизации количества электролита на элемент. 12 В лабораторных условиях дозируется непропорционально большое количество электролита по сравнению с поверхностями компонентов в однослойных ячейках. Напротив, при производстве промышленных ячеек в ячейках большого формата не хватает пустого пространства для содержания электролита в таком же соотношении к поверхности активного материала и сепаратора. 19 Кроме того, поскольку электролит является неактивным материалом, слишком много и, следовательно, ненужного электролита является мертвым грузом, что снижает плотность энергии и увеличивает стоимость батареи. 10
Чтобы точно определить влияние количества производимого электролита, были построены большие ячейки, заполненные различным количеством электролита. Эти ячейки были измерены во время смачивания с помощью импедансной спектроскопии, затем подверглись процедуре формирования и были циклически проверены в испытании на срок службы.
Cell-Assembly
Ячейки-пакеты, состоящие из 13 анодных листов и 12 катодных листов, были собраны в Техническом университете Мюнхена на полуавтоматических машинах в сухом помещении с точкой росы ниже -55 ° C. Катодные листы состояли из двустороннего покрытия из LiNi 1/3 Co 1/3 Mn 1/3 O 2 (NCM111) на алюминиевой фольге коллектора, а для анода в качестве активного материала использовался графит. покрытый с обеих сторон медный коллектор.Точные характеристики имеющихся в продаже электродов с покрытием показаны в Таблице I. Электродные листы были разделены в процессе удаленной лазерной резки, как описано в Ref. 20 до формата 101 мм × 73 мм (катод) и 104 мм × 76 мм (анод). Коммерческий сепаратор (Celgard 2325) был зажат между электродами, чтобы обеспечить электрическую изоляцию, и обернут вокруг пакета ячеек для обеспечения механической стабильности, удерживая электроды в их точном положении. Язычки и фольга токосъемника были соединены с помощью ультразвуковой сварки, и готовый пакет ячеек был упакован в гибкий пакет с углубленным карманом.С трех сторон пакет из фольги запечатывали импульсными запаивающими планками, оставляя одну сторону открытой для заполнения электролитом. Чтобы предотвратить нежелательные побочные реакции с остаточной влажностью, как указано в Ref. 21, они были высушены в вакуумной печи при 60 ° C и 20 мбар перед последующим заполнением в течение ночи. Подробности процедуры заполнения будут объяснены в следующем разделе. До и после каждого этапа производства ячейки взвешивались, чтобы отобразить влияние каждого этапа процесса на плотность энергии продукта посредством сборки ячеек, как показано на рисунке 1.
Таблица I. Технические характеристики используемых электродов.
| шт. | катод | анод | |
|---|---|---|---|
| активный материал | вес.% | 93,0 (NCM111) | 92,5 (графит) |
| проводящий углерод | вес.% | 3,0 | 0,5 |
| связующее | вес.% | 4.0 | 7,0 |
| загрузка емкости | мАч см -2 | 2,748 | 3,606 |
| пористость | % | 32,1 | 32,2 |
| толщина электрода | мкм | 118 | 130 |
| толщина фольги подложки | мкм | 20 (Al) | 10 (Cu) |
Приблизить Уменьшить Сбросить размер изображения
Рисунок 1. Изменение доли NMC на этапах процесса сборки электролизера после изготовления электродов в качестве индикатора влияния сборки электролизера на плотность энергии продукта. Объемный коэффициент vf описывает количество дозированного электролита и приведен в таблице II.
Filling-Process
1 М раствор LiPF 6 в смеси этиленкарбоната (EC) и этилметилкарбоната (EMC; массовое соотношение EC: EMC 3: 7) с 2 мас.% Виниленкарбоната (VC ) от BASF служил электролитом.Как правило, для крупноформатных ячеек требуется несколько итераций дозирования после поглощения жидкости узлом ячеек из-за небольшого количества пустого пространства в ячейке и высокого сопротивления потоку пористых структур. 22 Для данной экспериментальной схемы, из-за небольшого количества электролита по сравнению с объемом пустот между гибкой фольгой пакета и стопкой, одной стадии дозирования было достаточно. В результате наполнение состояло из шести этапов: промывка инертным газом, вакуумирование, дозирование, герметизация, удаление воздуха и смачивание.Электролит дозировали в вакуумную камеру при абсолютном давлении 80 мбар. Количество варьировалось по объемному коэффициенту.
от 0,6 до 1,8 объема пор компонентов ячейки (сепаратора и электродов). Средний объем пор ячеек составил 8,85 мл. Точность дозирования и полученные объемы электролита сведены в Таблицу II. Давление закрытия герметизирующих стержней было установлено на 3 бара в течение 3 секунд при температуре герметизации 195 ° C.
Таблица II. Точность дозирования, итоговое количество дозированного электролита и емкость ячеек после формирования, которые соответствуют токам при испытании на срок службы.
| объемный коэффициент | – | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 |
| количество электролита | мл | 5.35 | 7,11 | 8,77 | 10,98 | 12,54 | 14,26 | 15,82 |
| стандартное отклонение | мл | 0,08 | 0,04 | 0,17 | 0,04 | 0,13 | 0,16 | 0,19 |
| количество электролита | мл Ач — 1 теор | 1,10 | 1,46 | 1.81 | 2.26 | 2,58 | 2,93 | 3,26 |
| Емкость ячейки | Ач об. | 2,68 | 3,23 | 3,33 | 3,16 | 3,28 | 3,41 | 3,44 |
| стандартное отклонение | Ач об. | 0,12 | 0,07 | 0,04 | 0,07 | 0,11 | 0,01 | 0.02 |
| количество ячеек | – | 3 | 5 | 6 | 3 | 4 | 3 | 4 |
После вентиляции камеры ячейки выдерживались под давлением окружающей среды в течение 180 минут перед первой загрузкой. Во время этого смачивания электрохимические измерения проводились с помощью потенциостата Interface 5000E от Gamry Instruments. Последовательность состояла из измерений потенциала открытого тока (OCV) и EIS и была запрограммирована на повторение в течение не менее 90 минут.Сначала измеряли OCV в течение 15 секунд с периодом выборки 0,5 секунды. Впоследствии потенциостатический EIS был запущен с начальной частотой 100 кГц и был изменен на 1 Гц с 10 точками на декаду и амплитудой 10 среднеквадратичных мВ в качестве сигнала возбуждения переменного тока, подаваемого на ячейку. Постоянное потенциальное смещение, которое может применяться к ячейке во время сбора данных, было установлено равным нулю по сравнению с OCV ячейки. Напряжение переменного тока суммировалось с напряжением постоянного тока.
Кривые EIS были проанализированы с акцентом на высокочастотное сопротивление (HFR).HFR ячейки — это значение импеданса, при котором мнимая часть равна нулю. Он интерпретируется как внутреннее сопротивление ячейки и изменяется во время смачивания компонентов ячейки жидким электролитом. 17
Процесс формирования и испытание на срок службы
Формирование проводили с использованием испытательной системы ячеек BaSyTec, подключенной к ячейкам в температурной камере при 25 ° C. Процесс состоял из 2 циклов при скорости C 0,1 ° C (что соответствует 4,86 Ач те или ).Ячейки заряжались в режиме постоянного тока и постоянного напряжения (CCCV) с ограничением тока, соответствующим C / 20, в то время как разряд выполнялся в режиме постоянного тока (CC). Верхнее напряжение отсечки было установлено на 4,2 В, а нижнее напряжение отсечки было установлено на 2,5 В.
Перед началом испытания на срок службы элементы были дегазированы, удаляя газ, который образовывался во время первых циклов зарядки и разрядки в результате химических реакций между ними. электроды и электролит, а также активация электродов.Сначала клетки были измерены с помощью EIS, используя ту же процедуру, что и в последнем разделе. Из-за временной стабильности EIS только трех циклов измерения было достаточно, чтобы зафиксировать поведение импеданса ячейки после цикла. Затем клетки помещали в вакуумную камеру. Камера промывалась инертным газом и откачивалась до 100 мбар, что было немного выше, чем уровень давления для дозирования электролита в последней секции. Ячейки открыли для удаления газа и снова запечатали. После вентиляции камеры мешок с избыточным газом упаковки был вырезан, и клетки снова были измерены с помощью EIS и взвешены.
Обратимые емкости клеток определяли по второму циклу формирования. Вернувшись в температурную камеру, циклирование было выполнено при 1 C (Ah rev ) и 25 ° C в режиме CCCV для зарядки с ограничением тока, соответствующем C / 20, и в режиме CC для разряда. Перед каждым набором из 50 циклов при 1 ° C выполняли один цикл при 0,1 ° C, а затем один цикл при 0,5 ° C. После завершения испытания на срок службы клетки были измерены с помощью EIS в четвертый раз.
Для каждого варианта были протестированы не менее трех независимых ячеек, и данные на рисунках всегда представляют собой среднее значение этих ячеек. Планки погрешностей на рисунках представляют собой стандартное отклонение измерений.
На рис. 1 показана массовая доля NMC в общей массе промежуточного продукта в процессах сборки ячеек. Поскольку (без электролита) активный материал катода является единственным резервуаром лития в элементе, содержание NMC является показателем плотности энергии элемента.Начальная доля катода в 76% уменьшается за счет таких этапов сборки, как z-образное складывание, при котором добавляются сепаратор и аноды. Затем удельный вес дополнительно увеличивается за счет приваренных ультразвуком язычков и алюминиевой фольги упаковки. График разделен на различные количества электролита для секции, представляющей процесс заполнения. С увеличением количества электролита весовая доля NMC еще больше уменьшается. От vf 0,6 до 1,8 наблюдается разница почти в 10% в доле NMC.Окончательное увеличение доли NMC связано с удалением фольги мешка для отходов после дегазации.
Измерения EIS после дозирования электролита показаны на рисунке 2a для смачивания ячеек. Результирующая HFR изменяется во времени и сходится к окончательному значению, как описано в [4]. 17. Эта точка схождения зависит от количества жидкого электролита. Большие дозированные количества приводят к более низким значениям HFR клеток после смачивания. Кроме того, HFR уменьшается и сходится для величин, больших или равных vf 1, тогда как он снова увеличивается для меньших величин перед сходимостью.Относительно скорости смачивания
(со степенью смачивания) влияние на скорость смачивания также становится заметным на Рисунке 2b. Скорость смачивания клеток с vf 0,6 и 0,8 пересекает нулевую линию в отрицательный диапазон и медленно приближается к нулю. В отличие от ячеек с большим количеством электролита, эти ячейки еще не завершили смачивание за время измерения 150 мин. Увеличение HFR и связанное с этим более длительное смачивание элементов является результатом недостаточного количества электролита в элементе.На этом этапе можно провести различие между двумя фазами микроскопического смачивания. Во время первой фазы смачивания HFR элементов уменьшается, как и в элементах с большим количеством электролита. Причина этого может заключаться в том, что электролит сначала проникает через участки поверхности компонентов ячейки, которые находятся в прямом контакте с жидкостью, и начинает сжимать или замещать остаточный газ в порах. Эта фаза смачивания заканчивается минимальной HFR (Рисунок 2a) или переходом через нуль скорости смачивания (Рисунок 2b).Минимум получается из-за локального избытка электролита, который замыкает электрическую цепь параллельно несмачиваемым участкам во время измерения EIS. На втором этапе жидкость электролита перераспределяется в оставшиеся поры, которые еще не заполнены электролитом в такой же степени. Капиллярные силы, действующие во время проникновения, зависят от радиуса пор. 23 Следовательно, объемная доля жидкого электролита в малых порах увеличивается за счет более крупных пор с тем же углом смачивания, если присутствует недостаточно электролита.Вторая фаза завершается, когда между порами всех компонентов ячейки достигается равновесие сил (например, капиллярных сил, сжатия газа, силы тяжести и т. Д.). Макроскопически теперь наблюдается однородное распределение жидкого электролита. HFR остается неизменным с течением времени, а скорость смачивания приближается к нулю.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 2. а) HFR ячеек при смачивании жидким электролитом; б) Скорость смачивания как функция времени после дозирования жидкого электролита.
Помимо недостаточного насыщения электролитической жидкостью, подробное картирование скорости смачивания показывает, что зависимость от количества электролита незначительна (для исследованных количеств и формата ячейки). Влияние гидростатического давления столба жидкости на пакет ячеек приводит к разнице 0,06 мОм в первые 10 минут и снижается до менее 0,01 мОм через 20 минут. Можно предположить, что гидростатическое давление не оказывает большого влияния, поскольку даже максимальный дозируемый объем составляет 16.01 мл остается небольшим по сравнению с смачиваемыми поверхностями.
Влияние количества электролита на обратимую емкость и плотность энергии ячеек после образования показано на Рисунке 3 как функция от коэффициента C. Объемный коэффициент 1 соответствует дозированному количеству электролита, равному величине всех полостей электродов и сепаратора. Однако никакие границы раздела или объемы между сепаратором и электродами не принимаются во внимание. Следовательно, для достижения максимально возможной производительности за счет смачивания всех пустотных объемов необходим коэффициент, превышающий vf 1.Емкость при 0,1 ° C увеличивается с vf 0,6 до 1,2, а затем остается постоянной, поскольку vf продолжает увеличиваться. При 0,5 и 1 ° C он не меняется до vf 1,4. Превосходное электрическое поведение ячеек с vf 1 или меньшим 1 C может быть объяснено диффузией носителей заряда: во время этих более длительных фаз заряда / разряда у носителей заряда есть достаточно времени, чтобы не обходить (достаточно ) смоченные участки ячеек. Максимальная плотность энергии достигается при 0,1 C и vf 0,8. Чем больше электролита дозируется в ячейки, тем ниже становится плотность энергии после этого пика.Причина такого поведения — уменьшение веса активного материала, которое имеет большее влияние, чем увеличение емкости. Также можно показать, что плотность энергии при 1 C не уменьшается так быстро, как при более низких скоростях C.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 3. Обратимая удельная емкость (столбцы слева) и удельная энергия (столбцы справа) ячеек в зависимости от количества электролита в течение первых трех циклов (0.1 C, 0,5 C, 1 C) срока службы.
На рисунке 4 показана удельная емкость ячеек во время испытания на срок службы в зависимости от объемного фактора, а также от коэффициента C. Емкость тем выше, чем ниже C-rate, и уменьшается с увеличением количества циклов. Поскольку после 50 циклов клетки циклируются с двумя более низкими скоростями C, на графике появляются небольшие скачки при 1 C, что свидетельствует о восстановлении клеток после низких скоростей. Ячейки с vf 0,6 уже испытывают резкое падение емкости в течение первых 50 циклов и теряют свою функциональность из-за недостаточного количества электролита внутри элементов.Ян и др. 24 различают линейное и нелинейное старение. В то время как рост SEI за счет электролита играет доминирующую роль в линейной фазе, нелинейное старение является индикатором литиевого покрытия, вызванного большими локальными градиентами электролита на аноде и на границе раздела с сепаратором. 24 Здесь после формирования кулоновская эффективность ячеек с vf 0,6 [vf 1] составляет 99% (± 1) [102,5% (± 1,1)] при 0,1 C. При 1 ° C она быстро падает до 78% ( ± 2) [95.8% (± 0,5)], а затем требуется около 30 циклов [1 цикл] для достижения эффективности 97% (± 1) [99,9% (± 0)]. Предполагается, что емкость, которую не удалось восстановить во время разряда, на которую указывает эффективность, будет размещена в позднем здании ГЭИ. В дополнение к восстановлению SEI из-за растрескивания во время работы, 9 дополнительных SEI образуется из несмаченных участков, вытягивающих электролит из уже увлажненных участков из-за изменения преобладающего равновесия сил. Низкая максимальная эффективность 97% при 1 ° C для vf 0.6 является результатом местных плохо или даже не увлажненных участков, которые имеют более высокое сопротивление и, следовательно, способствуют нанесению литиевого покрытия по сравнению с другими участками. 25 При дальнейшем истощении электролита ионная проводимость через поры сепаратора уменьшается, прекращая функциональность ячеек. По этой причине предполагается, что истощение электролита и последующее литиевое покрытие является механизмом разрушения элементов.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 4. Характеристики ячеек в течение всего срока службы после формирования. Тест состоял из 20 [0,1 C, 0,5 C, 50 [1 C]] циклов в режиме CCCV для зарядки и в режиме CC для разряда.
По мере увеличения количества электролита до vf 1,4 характеристики ячеек улучшаются, так что потери емкости в течение их срока службы уменьшаются. Однако для больших количеств (vf 1,6–1,8) большая потеря емкости может наблюдаться в увеличенном виде первых 200 циклов при 1 ° C на Рисунке 4.Ячейки могут до некоторой степени компенсировать эту потерю: даже несмотря на то, что емкость при 0,5 ° C после 650 циклов снова выше, чем для vf 1,2, элементы остаются ниже производительности этих элементов с vf 1,4 даже при более высоких циклах. Этот нежелательный эффект потери емкости во время первых циклов можно объяснить избытком VC. Добавка, не израсходованная во время формирования, создает CEI во время цикла до тех пор, пока не будет исчерпана. Таким образом он связывает литий, который впоследствии больше не может участвовать в перезарядке. 26
Два разных эффекта, потеря лития и истощение электролита, также можно наблюдать на рис. 5, представляющем напряжение разряда в зависимости от емкости элементов. Во время первого цикла преобладает недостаток электролита. Чем больше электролита присутствует в элементах, тем выше напряжение во время разряда и тем выше емкость, при которой напряжение падает до напряжения отсечки. Это эквивалентно уменьшению перенапряжения при увеличении количества электролита и, следовательно, увеличению разрядной емкости элемента.После 100 циклов ячейка с vf 0,6 уже разрушилась. Поскольку применялись высокие скорости зарядки при относительно низких температурах, возможными причинами могут быть нанесение литиевого покрытия уже в первых циклах 27 или недоступные электродные области. Ячейки с vf 1,6 и vf 1,8 остаются при более высоких напряжениях примерно до 2,5 А · ч, но затем падают, так что емкость ячеек соответствует емкости ячеек с vf 0,8. Эта потеря емкости связана с недоступным количеством лития, который лигирован в CEI.Ячейки с vf 1,2 и 1,4 по-прежнему генерируют высокое напряжение во всем диапазоне емкости, а также высокую конечную емкость. Однако после 500 циклов эти элементы (vf 1.2 и 1.4) страдают от потери напряжения в начале фазы разряда, что, как предполагается, является результатом литиевого покрытия в сочетании с повышенным SEI. Хотя ячейки, заполненные vf 1.4, все еще достигают максимальной емкости, напряжение vf 1.6 и 1.8 выше при одновременной более низкой емкости. Как правило, напряжение в начале процесса разряда падает из-за того, что в элементах присутствует меньше электролита.Однако потеря лития в элементах (из-за чрезмерного наращивания CEI) указывается преждевременным падением напряжения с высокого уровня по сравнению с элементами без чрезмерного CEI.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 5. Напряжение разряда выше емкости характеристической ячейки как функция количества электролита для 1 st , 100 th и 500 th цикл при 1 C срока службы.
CV-доля определяется как емкость, заряженная в режиме CV, по отношению к общей заряженной емкости Q в режимах CC и CV:
и показан на рисунке 6. Процент заряда может служить индикатором способности аккумуляторов к быстрой зарядке и зависит от C-rate: с увеличением SOC потенциал катода увеличивается, а потенциал графита приближается. 0 В по сравнению с Li + / Li . Разница между двумя потенциалами определяет напряжение ячейки.Таким образом, в режиме CC напряжение зарядки повышается, чтобы обеспечить определенный ток. Анод должен интеркалировать атомы лития за заданное время (определяемое скоростью C). Если скорость интеркаляции на аноде ниже, чем скорость переноса Li + в электролите, вызванная током заряда, литий накапливается на поверхности анода. Потенциал графита падает ниже 0 В по сравнению с Li + / Li , и металлическое покрытие литием происходит на верхней части анода.Следовательно, высокие концентрации углерода способствуют нанесению литиевого покрытия. 28 Кроме того, гальваника может быть вызвана несмачиваемыми участками анода или сепаратора в результате неоднородного распределения плотности тока. 29 Отрицательный потенциал анода (по сравнению с литием) приводит к тому, что напряжение элемента превышает потенциал катода, так что верхнее напряжение отсечки и, следовательно, фаза CV достигается раньше. 30 На верхнем уровне напряжения отсечки напряжение поддерживается постоянным в режиме CV, и элемент будет заряжаться до тех пор, пока ток не упадет до состояния отсечки.Таким образом, небольшая доля CV является синонимом высокой скорости интеркаляции анода и полностью увлажненного сепаратора, как показано на рисунке 6: чем больше электролита дозируется в ячейки, тем ниже доля CV. С увеличением количества циклов и C-rate доля CV увеличивается. Следовательно, элементы не только должны заряжаться в течение более длительного времени, но они также должны подвергаться более длительному воздействию более высоких напряжений, что представляет собой нагрузку на компоненты элементов. 31
Приблизить Уменьшить Сбросить размер изображения
Рисунок 6. CV-доля клеток в течение жизненного цикла после образования. CV-доля определяется как емкость, заряженная в режиме CV, по отношению к общей заряженной емкости в режимах CC и CV. Испытание на срок службы состояло из 20 [0,1 C, 0,5 C, 50 [1 C]] циклов в режиме CCCV для зарядки и в режиме CC для разряда.
HFR всех ячеек после смачивания, формирования, дегазации и испытания на срок службы показано на рисунке 7. Предполагалось, что SOC всех ячеек равняется 0%, поскольку они либо никогда не заряжались (просто смачивались), либо разряжались до напряжения 2.5 В. HFR после дегазации немного выше, чем после образования. Причина этого может заключаться в том, что небольшое количество жидкого электролита вытягивается из пор во время дегазации и должно повторно занимать это пространство. Для ячеек с vf от 0,6 до 1,2 оба значения HFR после образования и дегазации выше, чем HFR после смачивания. От vf 1,4 до 1,8 HFR после образования и после дегазации ниже, чем после смачивания. В сочетании с электрохимическими характеристиками во время испытания на срок службы измерения показывают, что количество электролита не менее vf 1.4 требуется, чтобы позволить SEI полностью сформироваться во время формирования и обеспечить оптимальную ионную проводимость через сепаратор, необходимую для перезарядки. Перенос заряда между электролитом и анодом даже улучшается за счет образования SEI с достаточным количеством электролита, как показывают значения HFR. Однако в течение срока службы внутреннее сопротивление элемента увеличивается из-за расхода электролита, нежелательных реакций и образования дополнительных SEI и CEI. Стандартное отклонение измерений не позволяет делать какие-либо существенные выводы, но существует тенденция к тому, что HFR увеличивается в меньшей степени в течение срока службы с большими количествами электролита, чем с элементами с небольшими количествами электролита.
Приблизить Уменьшить Сбросить размер изображения
Рис. 7. HFR ячеек после смачивания, формирования, дегазации и испытания на срок службы (1040 циклов без образования) для различных количеств электролита при SOC 0.
Исследование, на котором основана эта статья, показало, что плотность энергии, а также емкость литий-ионных батарей зависят от количества электролита. Слишком мало электролита приводит к потере емкости и срока службы, тогда как слишком большое количество электролита снижает плотность энергии.Для оптимального смачивания компонентов ячейки электролитом было определено минимальное количество электролита, соответствующее объему пор. Кроме того, избыток ВК сравнивали с недостатком электролита в течение срока службы элементов. Оба механизма отказа можно распознать по разному напряжению разряда в зависимости от емкости. При недостатке электролита напряжение резко падает уже в начале процесса разряда, а превышение VC приводит к более позднему, но более сильному падению напряжения в конце фазы разряда.Доля CV при циклировании увеличивается с уменьшением количества электролита и без влияния чрезмерных количеств VC. Следовательно, предполагается, что без чрезмерной добавки VC и с увеличением количества электролита производительность увеличивается в течение срока службы, особенно при более высоких скоростях C. Также было показано, что HFR уменьшается с увеличением количества электролита. При слишком низком количестве электролита можно использовать EIS для обнаружения перераспределения электролита в порах.Таким образом, EIS не может использоваться только для измерения распределения электолита после завершения смачивания компонентов ячейки, но также помогает выяснить, было ли дозировано достаточное количество электролита для данной пористой структуры. Этапы производства после заполнения и цикла влияют на внутреннее сопротивление ячейки в зависимости от дозированного объема электролита, который также можно измерить с помощью EIS и наблюдать с помощью HFR.
Становится очевидной не только необходимость адаптации состава электролита к активным материалам и количества электролита на поверхность активного материала, но также необходимость адаптации количества электролита к желаемому заказчику применению.
Авторы выражают признательность Федеральному министерству образования и исследований Германии (BMBF) за финансирование их исследований в рамках проекта Cell-Fi (номер гранта 03XP0069C). Авторы благодарят Таню Цюнд за ее критический отзыв об электрохимической интерпретации, Яна Бернд Хабеданка и Ходу Мохсени за техническую поддержку в лазерной резке и ультразвуковой сварке, а также Gamry Instruments за предоставление потенциостата.
Флориан Дж. Гюнтер 0000-0002-5967-6801
Ухудшение работы литий-ионной батареи: что вам нужно знать
Распространение литий-ионных аккумуляторов от бытовой электроники до крупномасштабных приложений для транспорта и хранения энергии сделало понимание многих механизмов, ответственных за деградацию аккумуляторов, все более важным.Литература по этой сложной теме значительно выросла; эта перспектива направлена на то, чтобы изложить текущие знания в сжатой форме, в качестве справочного материала и руководства для понимания деградации батареи. В отличие от других обзоров, эта работа подчеркивает связь между различными механизмами и различными физическими и химическими подходами, используемыми для запуска, идентификации и мониторинга различных механизмов, а также различных вычислительных моделей, которые пытаются моделировать эти взаимодействия. Ухудшение подразделяется на три уровня: сами фактические механизмы, наблюдаемые последствия на уровне соты, называемые режимами, и рабочие эффекты, такие как затухание емкости или мощности.Было обнаружено пять основных и тринадцать вторичных механизмов, которые обычно считаются причиной деградации во время нормальной работы, и все они вызывают пять наблюдаемых режимов. Блок-схема иллюстрирует различные контуры обратной связи, которые связывают различные формы деградации, в то время как таблица представлена для выделения экспериментальных условий, которые с наибольшей вероятностью запускают определенные механизмы деградации. Вместе они представляют собой мощное руководство по разработке экспериментов или моделей для исследования деградации батарей.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Пористость катода является недостающим ключевым параметром для оптимизации плотности энергии литий-серной батареи
Морфология серного электрода с разной пористостью
Морфология композитных электродов S / C с разной пористостью наблюдается с помощью сканирующей электронной микроскопии (SEM), так как показано на рис.1. При пористости 70% наблюдается большое пустое пространство с частицами, перекрывающимися и неравномерно распределенными по поверхности. При пористости 60% или 50% расстояние между частицами было значительно уменьшено, а пустое пространство также было менее заметным из-за процесса каландрирования. Между тем, частицы упакованы более конденсированными по поверхности электрода, и агрегация также очевидна. Морфология серного электрода с пористостью 40 и 50% после циклирования наблюдалась с помощью изображений поперечного сечения SEM (дополнительный рис.1 во вспомогательной информации, SI). Толщина обоих электродов увеличивается из-за объемного расширения во время цикла. Поверхность углерода также покрыта осажденными материалами, вероятно, изолирующим Li 2 S.
Рис. 1Изображения, полученные с помощью сканирующего электронного микроскопа (SEM). СЭМ-изображения серного электрода с пористостью 70, 60 и 50%
Электрохимические характеристики ячеек с разной пористостью
Для серного катода важна высокая доля объема пор для обеспечения пространства как для окислительно-восстановительных реакций, так и для объема расширение серы (~ 80%) 40,43 .В то же время требуется некоторый избыток электролита для полного заполнения пор и обеспечения взаимосвязанных путей переноса ионов лития между частицами. Начальная пористость электрода с покрытием составляет 70%. Посредством процесса каландрирования были подготовлены электроды с различной пористостью для оценки электрохимических характеристик.
На рис. 2а показаны профили заряда – разряда Li – S элементов с содержанием серы 2,5 мг / см –2 при пористости 70, 65, 60, 55, 50 и 45%.Типичное поведение двухплато при разряде Li – S батареи наблюдалось, когда пористость превышала 55%. Первое плато при ~ 2,4 В обычно приписывается реакциям превращения элементарной S в растворимый Li-PS (включая Li 2 S 8 , Li 2 S 6 и Li 2 S 4 ), а второе плато 2,1 В указывает на дальнейшее преобразование растворимого Li-PS в нерастворимый Li 2 S 2 и Li 2 S. , а общая начальная разрядная емкость была выше 1000 мАч / г -1 для ячеек с пористостью выше 50%, что означает, что степень использования серы не сильно пострадала, когда пористость находилась в определенном диапазоне.При дальнейшем уменьшении пористости до 50% точка поворота плато сместилась назад до 260 мАч г -1 , и наблюдалась значительная депрессия второго плато. Общая начальная емкость снизилась до 910 мАч g −1 . Это явление было еще более серьезным для ячейки с меньшей пористостью 45%. Точка поворота была дополнительно уменьшена до емкости 200 мАч g −1 , а общая емкость резко снизилась до всего 299 мАч g −1 . Аналогичную тенденцию можно наблюдать и для электродов с содержанием серы 5 мг / см -2 , как показано на рис.2b. Электроды с пористостью 70 и 60% показали идентичные емкости, близкие к 1100 мАч g -1 со вторым плато разряда выше 2,0 В. Хотя электрод с пористостью 50% обеспечивал относительно более высокую начальную емкость по сравнению с электродом с более низкой нагрузкой при той же пористости. , по-прежнему наблюдалось значительно пониженное второе плато разряда. Когда пористость была дополнительно уменьшена до 40%, начальная разрядная емкость составила всего 255 мАч / г -1 , а плато разрядки 2 и было сильно сжато.Эти результаты показали, что электроды с более высокой пористостью могут обеспечивать больше реакционных центров и, таким образом, иметь более высокую степень использования серы.
Рис. 2Электрохимические характеристики ячеек с различной массовой загрузкой серы. a , b Зарядно-разрядные профили литий-серных (Li-S) элементов с содержанием серы 2,5 мг см −2 и 5 мг см −2 при различной пористости. c Цикл работы ячеек с содержанием серы 5 мг / см −2 при пористости 70, 60, 50 и 40%. d Спектр электрохимического импеданса серного электрода с пористостью 70, 60 и 50% (содержание серы 2,5 мг / см −2 ). e , f Li – S аккумулятор с электролитом, состоящим из диметоксиэтана (DME) и диоксолана (DOL) в качестве растворителя с 0,4 M бис (трифторметансульфонил) имидом лития (LiTFSI) −0,6 M LiNO 3 и 3 M LiTFSI– 0,2 M LiNO 3 (загрузка серы 2,5 мг / см -2 )
Циклические характеристики ячеек с загрузкой серы 5 мг / см -2 при различной пористости представлены на рис.2c. Электроды с пористостью 70, 60 и 50% показывают очень близкие начальные емкости 1104, 1116 и 1040 мАч / г -1 , соответственно. Емкость электрода с пористостью 70% уменьшилась в течение первых 12 циклов, а затем восстановилась и оставалась относительно стабильной. Ячейка с пористостью 60% показала несколько более высокую емкость в течение первых 10 циклов по сравнению с электродом с пористостью 70%, но емкость уменьшилась более значительно в следующих циклах. Ячейка с пористостью 50% показала более стабильную циклическую производительность по сравнению с ячейками с более высокой пористостью, но емкость внезапно упала после 34 циклов, что может быть вызвано коротким замыканием.Что касается ячейки с пористостью 40%, она быстро вышла из строя после двух циклов с начальной емкостью 255 мАч g −1 . Хотя небольшие поры углеродной матрицы благоприятны для использования активных материалов 40 , электрод с пористостью 70% по-прежнему демонстрирует лучшие характеристики по сравнению с электродами с более низкой пористостью. При низком содержании серы (дополнительный рисунок 2) ячейка с пористостью 70% показала стабильную работу цикла, хотя начальная разрядная емкость была ниже, чем у ячеек с более низкой пористостью (65, 60 и 55%).В то время как начальная емкость ячейки с пористостью 60% была самой высокой среди всех ячеек, она продолжала снижаться и почти сравнялась с емкостью с пористостью 65% после 10 циклов. Обе ячейки с пористостью 70 и 55% испытали быстрое разрушение емкости после 20 циклов по сравнению с ячейками с пористостью 60 и 65%. Емкость ячейки с пористостью 65% постепенно увеличивалась до 80 циклов, а затем внезапно упала до даже меньшей емкости, чем у ячейки с пористостью 60 и 55%.Ячейка с пористостью 70% показала наиболее стабильную производительность цикла в течение 100 циклов по сравнению с другими, за которыми следовали 60 и 55%. Кулоновская эффективность всех клеток сохранялась около 98%, что можно объяснить ингибированием эффекта челнока за счет использования LiNO 3 35,44 . На разложение LiNO 3 также указывает небольшое увеличение дополнительной емкости при напряжении ниже 1,8 В для пористости более 50% на рис. 2b, что согласуется с наблюдениями в литературе 35 .
На рис. 2d показана спектроскопия электрохимического импеданса для ячеек с пористостью электродов 70, 60 и 50% после 5 циклов при 50% -ном состоянии заряда. Когда пористость уменьшилась на 10%, сопротивление переносу заряда элемента уменьшилось почти вдвое, в то время как сопротивление электролита осталось прежним, что указывает на то, что процесс каландрирования может улучшить проводимость за счет улучшения контакта между частицами 45 . Однако процесс каландрирования также оказал отрицательное влияние на электрохимические характеристики ячеек в результате значительного уменьшения пустот и объема пор, как обсуждалось в вышеупомянутом контексте.
Плохие электрохимические характеристики серного электрода с пониженной пористостью демонстрируют, что доля объема пор имеет решающее значение как для скорости использования серы, так и для стабильности циклирования. В отличие от обычных литий-ионных аккумуляторов с интеркаляцией, механизм реакции Li-S аккумуляторов включает процессы растворения и осаждения Li-PS, которые сильно зависят от свойств электролита. Как показано на рис. 2e, с электролитом низкой концентрации, ячейка представила длинное плато разряда 2 и в точке 2.1 В, который, однако, заметно сжимается, если концентрацию увеличивать до 3 моль л -1 (M, см. Рис. 2f). Было очевидно, что на электрохимические характеристики Li-S батареи сильно влияет наличие свободных растворителей в электролите, что, вероятно, связано с растворением Li-PS. Если концентрация лития Li-PS в элементе превышает предел его растворимости (~ 8 M), производительность аккумулятора будет отрицательно сказываться 46 .
Аналитическая модель
Согласно экспериментальным наблюдениям, на общие характеристики Li – S батареи сильно повлияла пористость композитного катода S / C.Сообщалось, что площадь поверхности углерода катодов S / C оказала значительное влияние на второе плато разряда 47 . Наши экспериментальные данные показали, что уменьшение пористости вызвало не только пониженное второе плато, но также укороченное первое плато, как показано на рис. 2a, b. Чтобы понять фундаментальные механизмы, была построена единая аналитическая модель для количественной оценки влияния пористости катода, p , на плотность энергии на уровне ячеек. В экспериментах мы выбрали залитые монетные элементы с базовым электролитом, чтобы отделить влияние пористости катода от других экспериментальных факторов, таких как расход электролита из-за образования SEI на поверхности Li-металла.Из-за конструкции плоского круглого элемента не весь электролит был использован. Наша аналитическая модель рационализирует количество электролита, участвующего в работе ячейки и растворении Li-PS. Это послужит основой для оценки предела отношения E / S в практической конструкции пакета без избытка электролита.
Ограниченная емкость на первом плато разряда
После сборки ячейки поры электродов, показанные на рис. 1, будут заполнены электролитом. Таким образом, количество электролита, необходимое для полного смачивания электрода, будет зависеть от пористости электрода, p .С учетом пористого полимерного сепаратора и непористого литиевого анода, используемых для изготовления ячейки, общий объем пор ячейки, V , поры , включает поры в сепараторе и катоде, как
$$ V _ {{\ mathrm {pore}}} = V _ {{\ mathrm {pore}}} ({\ mathrm {sep}}) + V _ {{\ mathrm {pore}}} \ left ({{\ mathrm {cat}}} \ справа) $$
(1)
V пор (sep) был рассчитан как 2,5 мм 3 на основе общего объема (6.3 мм 3 ) и пористость (40%) сепаратора Celgard 2500, использованного в эксперименте. V пора (cat) включает микропоры внутри углерода и пустое пространство между частицами углерода. Он масштабировался с учетом пористости, p как
$$ V _ {{\ mathrm {pore}}} \ left ({{\ mathrm {cat}}} \ right) = p \ ast V \ left ({{\ mathrm {cat}}} \ right) = p (V _ {{\ mathrm {density}}} \ left ({{\ mathrm {cat}}} \ right) + V _ {{\ mathrm {pore}}} \ left ({{\ mathrm {cat}}} \ right)) $$
(2)
Исходя из экспериментально измеренного компактного объема катода, объем плотного композитного катода S / C без какой-либо пористости V плотный (катод) был около 5.3 мм 3 (Дополнительная таблица 1). Во-первых, мы можем предположить, что весь электролит можно утилизировать. Коэффициенты диффузии самого маленького Li-PS, Li 2 S 4 , в типичном растворителе диметоксиэтане (DME) были рассчитаны как функция концентраций Li 2 S 4 с помощью классической молекулярной динамики (MD). моделирование. Хотя коэффициент диффузии Li 2 S 4 уменьшался с увеличением концентрации, расстояние диффузии Li 2 S 4 во время процесса разряда составляло 0.По оценкам, 1 C составляет 1–3 мм, что намного превышает размер пор и частиц S / C-композита и толщину электрода. Это подтверждает наличие челночного движения Li-PS, которое широко наблюдалось в опубликованных экспериментах 10,11 . Также предполагается, что диффузия Li-PS не является ограничивающим фактором для использования серы.
Исходя из содержания серы 5,0 мг / см -2 , общая масса S в катоде м с (общая) составляла 6,5 мг для катода площадью 1.3 см 2 , что соответствует объему 3,25 мм 3 . (Дополнительная таблица 1). Если бы все 6,5 мг S преобразовались в Li 2 S 4 после завершения первого плато разряда, была бы получена теоретическая емкость Q th = 420 мАч г -1 . Поскольку вся экспериментально измеренная разрядная емкость после первого плато меньше Q th , мы ввели процент использования S P s (uti) как отношение массы использованной S (преобразованных в Li 2 S 4 ), м с (uti), а общая масса S равна
$$ P_s ({\ mathrm {uti}}) = \ frac {{m _ {\ mathrm { s}} \ left ({{\ mathrm {uti}}} \ right)}} {{m _ {\ mathrm {s}} \ left ({{\ mathrm {total}}} \ right)}} = \ frac {{Q _ {{\ mathrm {pr}}}}} {{Q _ {{\ mathrm {th}}}}} $$
(3)
Q pr — это практическая емкость на первом плато, которую можно получить из рис.2b. Как показано на рис. 3а, экспериментальный P s (uti) поддерживался на уровне ~ 70% для пористости выше 60%. Таким образом, не более 70% S может быть преобразовано в Li 2 S 4 . Растворимость Li 2 S 4 в растворителе-электролите в пересчете на S составляет C max = 8 M 19 . Если предположить, что эти Li 2 S 4 растворены только в электролите в поре, его концентрация все равно будет превышать предел насыщения даже при высокой пористости 70%.Это означает, что доступный объем электролита был больше, чем V pore . Дальнейшее уменьшение пористости ниже 60% привело к уменьшению P s (uti), поскольку количество доступного электролита больше не растворяет полностью образовавшийся Li 2 S 4 , что ограничивает использование активной S Следовательно, мы считаем, что первое плато будет прекращено, когда концентрация Li 2 S 4 достигнет предела насыщения, поэтому использование S будет ограничено максимальным количеством растворимого Li 2 S 4 ,
.$$ P _ {\ mathrm {s}} ({\ mathrm {uti}}) = \ frac {{gV _ {{\ mathrm {pore}}} M _ {\ mathrm {s}} \ cdot C _ {{\ mathrm {max}}}}} {{m _ {\ mathrm {s}} \ left ({{\ mathrm {total}}} \ right)}} $$
(4)
, где M s = 32 г моль -1 — молярная масса S, а доступный объем электролита был принят как г · V пора .Новый параметр г был введен для учета доступного электролита за пределами пор, но способствовал растворению Li-PS. Путем подгонки к практической емкости первого плато при различной пористости, как показано на рис. 2b, значение г было определено равным 1,8, предполагая, что объем использованного электролита примерно в два (1,8 раза) больше объема внутри электролита. поры.
Рис. 3Результаты аналитического моделирования. Прогнозируемая концентрация полисульфида лития (Li-PS) и использование серы в зависимости от пористости ( a ).Прогнозируемая общая площадь поверхности и эффективная площадь поверхности как функция пористости ( b ). Расчетные кривые разгрузки при разной пористости ( c ). Прогнозируемая гравиметрическая плотность энергии, основанная на общей массе катода, включая S, углеродную матрицу, углеродную сажу, карбоксиметилцеллюлозу и стирол-бутадиеновый каучук (CMC-SBR), и объемную плотность энергии на основе полного объема катода ( дн. ). Также были вставлены схемы, показывающие разницу между низкой и высокой пористостью.Неиспользованная сера, углеродная матрица и осажденный слой Li 2 S 2 / Li 2 S были представлены желтым, черным и красным соответственно
В зависимости от количества использованной серы растворенный Li 2 S 4 Концентрация была также рассчитана в единицах моля S.
$$ c _ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right) = \ frac {{m_ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right)}} {{gV _ {{\ mathrm {pore}}} M _ {\ mathrm {s}}}} $$
(5)
На рис.3a, c s (uti) увеличивалась с уменьшением пористости и сходилась при насыщенной концентрации 8 M 19 , когда пористость была ниже 60%. Это подтвердило, что насыщение Li-PS в растворителе электролита было ограничивающим фактором для емкости на первом плато.
Углубление второго плато разряда
Электрохимическая реакция, соответствующая второму плато, будет протекать на поверхности углерода, где растворенный Li 2 S 4 забирает электроны с поверхности, а литий-ионные от электролита и осаждает. как изолирующие Li 2 S 2 и Li 2 S на поверхности.\ alpha \), где α — эмпирическая константа, зависящая от структуры пор, обычно в диапазоне от -1 до 1. Учитывая тот факт, что пористость была изменена в процессе каландрирования вдоль направления толщины, α было выбрано значение 1. Далее связав V (cat) с пористостью p , общая площадь поверхности A уменьшилась с p
$$ A (p) = \ frac {{A_0}} {{1 — p}} $$
(6)
Как мы знаем, измеренная площадь поверхности Брунауэра – Эммета – Теллера (БЭТ), A , составляла ~ 1000–1100 м 2 г −1 при p = 70%, остальная часть A может можно получить как функцию от p .
Если вся сера может быть преобразована в растворенный в электролите Li 2 S 4 , углеродная поверхность, первоначально покрытая изолирующей серой, снова станет доступной для облегчения реакции переноса заряда. Однако, если после реакции, связанной с первым плато, остается неиспользованная S, часть поверхности, покрытая S, по-прежнему является изолирующей. Таким образом, эффективная площадь поверхности A eff была определена для учета неиспользованной серы, \ (m _ {\ mathrm {s}} \ left ({{\ mathrm {total}}} \ right) (1 — P _ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right)) \) с параметром k ,
$$ A _ {{\ mathrm {eff}}} = A-km _ {\ mathrm {s}} \ left ({{\ mathrm {total}}} \ right) (1 — P _ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ справа)) $$
(7)
Зная процент использования серы, предполагая, что разные k , A, и A eff были построены как функция от p на рис.3b. И A 0 , и A eff уменьшились с уменьшением пористости, но уменьшение A eff было намного быстрее по сравнению с A . Это произошло из-за увеличения неиспользованной серы, покрывающей площадь поверхности углерода. Точное значение k будет определено позже.
Если предположить, что осажденные изолирующие продукты Li 2 S 2 / Li 2 S равномерно распределены на поверхности углерода, толщина слоя d пропорциональна емкости на втором плато \ (Q — Q_ { {\ mathrm {th}}} P _ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right), \) и обратно пропорционально эффективной площади поверхности A eff . Q здесь был полной вместимостью. Таким образом, используя константу b , соотношение между толщиной d и общей емкостью Q может быть получено как
$$ d = b \ frac {{(Q — Q _ {{\ mathrm {th}}} P_ { \ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right))}} {{A _ {{\ mathrm {eff}}} m _ {\ mathrm {C}}}} $$
(8)
м c = 1,85 мг — масса углеродной матрицы, использованной в эксперименте. Изолирующий слой Li 2 S 2 / Li 2 S будет вызывать сопротивление, и электроны должны туннелировать через его толщину, чтобы продолжить электрохимические реакции.{Bd} — 1) $$
(9)
, где C и B были двумя подгоночными параметрами, которые будут рассмотрены позже. Согласно формуле. (9), R было 0, когда толщиной d можно было пренебречь. Изолирующий слой индуцировал падение IR , причем I представляло ток разряда, на кривой разряда для второго плато. Равномерное нанесение изолирующего Li 2 S 2 / Li 2 S на углеродную поверхность поддерживалось S / C электродом, полученным методом диффузии расплава (аналогичным нашему) Pan et al. 50 . Интересно, что они также представили неоднородное осаждение Li 2 S, так называемое «цветочное» агломерации Li 2 S, которое сохраняло электрохимическую активность углеродного волокна и серного катода. Будет интересно, удастся ли этого добиться в макропористой углеродной матрице.
Если взять равновесное напряжение холостого хода 2,4 и 2,1 В для первого и второго плато, кривая разряда покажет две стадии для напряжения В и емкости Q :
$$ V = \ left \ {{\ begin {array} {* {20} {c}} {2.\ prime (Q — Q _ {{\ mathrm {th}}} P _ {\ mathrm {s}} \ left ({{\ mathrm {uti}}} \ right))}} {{A _ {{\ mathrm {eff }}} m _ {\ mathrm {C}}}}} — 1} \ right) \ left ({Q \> \ Q _ {{\ mathrm {th}}} P _ {\ mathrm {s}} \ left ({ {\ mathrm {uti}}} \ right)} \ right)} \ end {array}} \ right. $$
(10)
B ′ = Bb и C ′ = CI были двумя объединенными параметрами. Подгоняя кривые разряда с пористостью 40 и 50% на рис.2b, подобранные значения B ′ , C ′ и k были определены как 1,07 × 10 –3 м 2 г мАч −1 , 0,050 В и 1,27 × 10 5 m 2 g −2 соответственно. Хотя мы явно не подсчитывали набухание катода, показанное на дополнительном рис. 1, избыточный объем электролита в формуле. (1) и подгоночные параметры в уравнении. (2) неявно должен был включать эффект набухания. Расчетные кривые разрядки при других значениях пористости показаны на рис.3c. Модель успешно предсказала кривые разгрузки с незначительными изменениями, когда пористость была выше 60%. Дальнейшее уменьшение пористости сокращало первое плато и понижало второе плато. Таким образом, емкость быстро падала при уменьшении пористости до 40–50%. Это также соответствовало экспериментальным наблюдениям.
Кроме того, эта аналитическая модель может также объяснить изменение напряжения холостого хода с рис. 2e на рис. 2f, когда концентрация бис (трифторметансульфонил) имида лития (LiTFSI) в электролите увеличилась с 1 до 3 М.Подобно системе «вода в соли» 51 , с увеличением концентрации LiTFSI количество свободного растворителя, которое можно использовать для сольватации Li-PS, будет падать. Это привело к более низкой концентрации насыщения Li-PS в электролите и уменьшению P s (uti), что укорачивает первое плато, а также снижает второе плато. Это причина того, что даже при высокой пористости 70% на электрохимические характеристики сильно повлиял электролит 3 M LiTFSI, показанный на рис.2f.
Объемная и гравиметрическая плотность энергии
На основании приведенного выше обсуждения влияние пористости на электрохимические характеристики можно обобщить на схемах на рис. 3d. Неиспользованная S, углеродная матрица и осажденный слой Li 2 S 2 / Li 2 S были представлены желтым, черным и красным соответственно. Когда пористость была высокой (> 55%), P s (uti) сохранялась на уровне 70%, способствуя длительному первому плато.Кроме того, A eff составлял не менее 500 м 2 g −1 , что было достаточно высоким, чтобы поддерживать слой осажденного Li 2 S 2 / Li 2 S до тех пор, пока не будет образован весь Li -PS был преобразован в Li 2 S 2 и Li 2 S, как показано на схемах справа на рис. 3d. Сопротивление, вызванное этим тонким слоем, сформированным на поверхности углерода, было менее 0,1 В, и второе плато оставалось плоским. При средней пористости (~ 50%) значение P s (uti) упало до 55%, что привело к укороченному первому плато.Кроме того, из-за уменьшения пористости и увеличения количества неиспользованной серы A eff составляло всего ~ 200 м 2 г -1 . Осажденный слой Li 2 S 2 / Li 2 S становился толще по мере продолжения второй реакции разряда, вызывая увеличение сопротивления. Как показывает аналитическая модель, падение ИК-излучения составило ~ 0,2 В при общей емкости 800 мА · ч g −1 и ~ 0,4 В при общей емкости 1100 мА · ч g −1 , демонстрируя явное снижение во втором плато.При низкой пористости (<45%) P s (uti) ~ 42% привело к еще более короткому первому плато. A eff также резко упало до ~ 15 м 2 г −1 . В результате толщина слоя Li 2 S 2 / Li 2 S и соответствующее сопротивление увеличивались очень быстро, как показано на вставленных слева схемах на рис. 3d. Общая емкость была <250 мАч g −1 , когда IR упал на 0,4 В и предел напряжения 1.Было достигнуто 7 В. В этом причина сильной депрессии второго плато, сопровождающейся низкой пористостью.
На рис. 3d расчетная гравиметрическая плотность энергии была рассчитана как общая энергия (рассчитанная по кривой разряда), деленная на общую массу катода. Объемная плотность энергии была рассчитана как полная энергия, деленная на полный объем катода, V (кат) в уравнении. (1). Гравиметрическая плотность энергии сначала монотонно увеличивается с увеличением пористости и достигает постоянной, когда пористость превышает 55%.Однако объемная плотность энергии показала пиковое значение пористости около 52%.
Критические параметры для проектирования на уровне ячейки
Хотя избыток электролита может увеличить использование серы и улучшить рабочие характеристики цикла, это неэффективный подход для достижения высокой плотности гравиметрической энергии. Недавно были продемонстрированы некоторые многообещающие характеристики Li – S-монетных элементов с отношением E / S <5 мкл, мг -1 при определенных условиях 52,53,54 .Как обсуждалось выше, для практического применения рекомендуемое соотношение E / S составляет 3 мкл mg -1 , что сопоставимо с имеющимся в продаже литий-ионным аккумулятором 52 . Дополнительная таблица 2 иллюстрирует значения отношения E / S при различной площади поверхности и пористости на основе монетных ячеек с учетом объема пор в серном электроде и сепараторе. Отношение E / S обычно уменьшается с увеличением площади поверхности и пористости. Когда поверхностная емкость серы составляет 5 мАч / см -2 , отношение E / S близко к 4 мкл мг -1 даже для электрода с пористостью 70%, и оно становится еще меньше по мере уменьшения пористости.В формате ячейки пакета соотношение E / S может быть дополнительно уменьшено за счет устранения мертвого пространства и неравномерного распределения давления 10 . Как показано на рис. 4, доля электролита увеличивается с 42 до 53%, когда объемная емкость серы изменяется от 1 до 5 мАч см -2 при фиксированной пористости 70%. Такая чрезвычайно высокая пористость электрода снижает плотность энергии и увеличивает стоимость из-за большого количества электролита. Если емкость серного электрода остается прежней, использование количества электролита уменьшается с уменьшением пористости.Для электродов емкостью 5 мАч / см -2 доля электролита уменьшается на 18% при уменьшении пористости до 50%. Это явление указывает на то, что пористость играет важную роль в конструкции элемента в целом, поскольку она определяет количество электролита в элементе. Однако электрохимические характеристики элемента могут ухудшиться, если пористость электрода уменьшается ниже уровня 50%, как показано на фиг. 3c. На рис. 3d максимальная объемная плотность энергии была предсказана аналитической моделью, предполагая, что пористость от 50 до 60% является оптимальной для сбалансированного использования серы и плотности энергии на уровне ячейки для данной загрузки серы.
Рис. 4Параметры для проектирования на уровне ячеек. Соотношение электролит / сера (E / S) в ячейке-пакете с разной пористостью при разной емкости по сере
Таким образом, аналитическая модель позволяет проектировать Li – S аккумуляторные батареи на уровне ячеек. Чтобы использовать эту модель для других конструкций ячеек, таких как другой сепаратор или электролит, можно соответствующим образом скорректировать измеренные константы, перечисленные в дополнительной таблице 3, и подгоночные параметры { g , B ‘, C ‘ и k } необходимо переоборудовать, в то время как ключевые уравнения остаются прежними.Затем модель можно использовать для оптимизации пористости катода с целью максимизации плотности энергии ячейки. Следует отметить, что катодная пористость является ключевым параметром при проектировании высокоэнергетических Li-S ячеек, но не единственным. Для описания микроструктуры электрода в будущей работе необходимо мезомасштабное моделирование с более конкретными и точными параметрами, как описано Райаном и Мукерджи 55 . Текущая аналитическая модель также не учитывает моделирование жизненного цикла ячейки, которое требует модели, основанной на механизме деградации, в которой также следует учитывать побочную реакцию электролита и старение литий-анода.
Замена обычных присадок к электролиту в аккумуляторах производными диоксолона для литий-ионных аккумуляторов с высокой плотностью энергии
Гуденаф, Дж. Б. и Ким, Ю. Проблемы литиевых аккумуляторных батарей. Chem. Матер. 22 , 587–603 (2010).
CAS Статья Google Scholar
Тараскон, Дж. М. и Арман, М. Проблемы и проблемы, с которыми сталкиваются перезаряжаемые литиевые батареи. Nature 414 , 359–367 (2001).
ADS CAS PubMed Статья Google Scholar
Арико, А.С., Брюс, П., Скросати, Б., Тараскон, Дж. М. и ван Шалквейк, В. Наноструктурированные материалы для передовых устройств преобразования и хранения энергии. Нат. Матер. 4 , 366–377 (2005).
ADS PubMed Статья CAS Google Scholar
Лю К., Ли, Ф., Ма, Л. П. и Ченг, Х. М. Современные материалы для хранения энергии. Adv. Матер. 22 , E28 – E62 (2010).
CAS PubMed Статья Google Scholar
Чае, С., Чой, С. Х., Ким, Н., Сунг, Дж. И Чо, Дж. Интеграция графитовых и кремниевых анодов для коммерциализации высокоэнергетических литий-ионных аккумуляторов. Angew. Chem. Int. Эд. 58 , 2–28 (2019).
Артикул CAS Google Scholar
Liu, W. et al. Насыщенный никелем слоистый оксид переходного металла лития для высокоэнергетических литий-ионных батарей. Angew. Chem. Int. Эд. 54 , 4440–4457 (2015).
CAS Статья Google Scholar
Мантирам А., Найт, Дж. К., Мюнг, С. Т., О, С. М. и Сан, Ю. К. Катоды из слоистого оксида с высоким содержанием никеля и лития: прогресс и перспективы. Adv. Energy Mater. 6 , 1501010 (2016).
Артикул CAS Google Scholar
Касаваджула, У., Ван, К. и Эпплби, А. Дж. Вставные аноды на основе нано- и объемного кремния для литий-ионных вторичных элементов. J. Источники энергии 163 , 1003–1039 (2007).
ADS CAS Статья Google Scholar
МакДауэлл, М.Т., Ли, С. В., Никс, В. Д. и Цуй, Ю. Статья в честь 25-летия: понимание литиирования кремния и других легирующих анодов для литий-ионных аккумуляторов. Adv. Матер. 25 , 4966–4985 (2013).
CAS PubMed Статья Google Scholar
Чен, З., Шеврие, В., Кристенсен, Л. и Дан, Дж. Р. Разработка электродов из аморфного сплава для литий-ионных аккумуляторов. Electrochem. Solid State Lett. 7 , A310 – A314 (2004 г.).
CAS Статья Google Scholar
Choi, N.-S. и другие. Влияние добавки фторэтиленкарбоната на межфазные свойства кремниевого тонкопленочного электрода. J. Источники энергии 161 , 1254–1259 (2006).
ADS CAS Статья Google Scholar
Шобукава, Х., Альварадо, Дж., Янг, Ю. и Мэн, Ю.С. Электрохимические характеристики и межфазные исследования кремниевого композитного анода для литий-ионных аккумуляторов в полном элементе. J. Источники энергии 359 , 173–181 (2017).
ADS CAS Статья Google Scholar
Zhao, H. et al. Пленкообразующие добавки к электролиту для литий-ионных аккумуляторов: прогресс и перспективы. J. Mater. Chem. А 7 , 8700–8722 (2019).
CAS Статья Google Scholar
Xu, G. et al. Назначение функциональных добавок для устранения плохих характеристик высоковольтных (класс 5 В) литий-ионных аккумуляторов LiNi0,5 Mn1,5 O4 / MCMB. Adv. Energy Mater. 8 , 1701398 (2018).
Артикул CAS Google Scholar
Han, J. G. et al. Несимметричный фторированный малонатоборат как амфотерная добавка для литий-ионных аккумуляторов с высокой плотностью энергии. Energy Environ. Sci. 11 , 1552–1562 (2018).
CAS Статья Google Scholar
Haregewoin, A. M., Wotango, A. S. и Hwang, B. J. Электролитные добавки для электродов литий-ионных аккумуляторов: прогресс и перспективы. Energy Environ. Sci. 9 , 1955–1988 (2016).
CAS Статья Google Scholar
Чой, Н.-С. и другие. Проблемы, с которыми сталкиваются литиевые батареи и электрические двухслойные конденсаторы. Angew. Chem. Int. Эд. 51 , 9994–10024 (2012).
CAS Статья Google Scholar
Jo, H. et al. Стабилизация межфазного слоя твердого электролита и циклические характеристики кремний-графитового анода батареи с помощью бинарной добавки фторированных карбонатов. J. Phys. Chem. С 120 , 22466–22475 (2016).
CAS Статья Google Scholar
Nguyen, C.C. и Lucht, B.L. Улучшенные характеристики циклирования анодов из наночастиц Si за счет введения метиленэтиленкарбоната. Electrochem. Commun. 66 , 71–74 (2016).
CAS Статья Google Scholar
Чен, Л., Ван, К., Се, X. и Се, Дж. Влияние виниленкарбоната (ВК) в качестве добавки к электролиту на электрохимические характеристики кремниевого пленочного анода для литий-ионных аккумуляторов. J. Источники энергии 174 , 538–543 (2007).
ADS CAS Статья Google Scholar
Далави, С., Гудуру, П. и Лучт, Б. Л. Добавки к электролиту, улучшающие характеристики литий-ионных батарей с кремниевыми анодами. J. Electrochem. Soc. 159 , A642 – A646 (2012).
CAS Статья Google Scholar
Etacheri, V. et al. Влияние фторэтиленкарбоната (FEC) на характеристики и химию поверхности анодов литий-ионных аккумуляторов с Si-нанопроволокой. Langmuir 28 , 965–976 (2012).
CAS PubMed Статья Google Scholar
Xu, C. et al. Улучшенные характеристики кремниевого анода для литий-ионных аккумуляторов: понимание механизма модификации поверхности фторэтиленкарбоната как эффективной добавки к электролиту. Chem. Матер. 27 , 2591–2599 (2015).
CAS Статья Google Scholar
Jaumann, T. et al. Срок службы в зависимости от производительности: понимание роли FEC и VC в литий-ионных батареях высокой энергии с нанокремниевыми анодами. Energy Storage Mater. 6 , 26–35 (2017).
Артикул Google Scholar
Ким, К.и другие. Понимание термической нестабильности фторэтиленкарбоната в электролитах на основе LiPF6 для литий-ионных аккумуляторов. Электрохим. Acta 225 , 358–368 (2017).
CAS Статья Google Scholar
Schiele, A. et al. Критическая роль фторэтиленкарбоната в газовыделении кремниевых анодов для литий-ионных аккумуляторов. ACS Energy Lett. 2 , 2228–2233 (2017).
CAS Статья Google Scholar
Schwenke, K.U., Solchenbach, S., Demeaux, J., Lucht, B.L. и Gasteiger, H.A. Воздействие CO 2 возникло из VC и FEC во время образования графитовых анодов в литий-ионных батареях. J. Electrochem. Soc. 166 , A2035 – A2047 (2019).
CAS Статья Google Scholar
Aurbach, D. et al. Об использовании виниленкарбоната (ВК) в качестве добавки к растворам электролитов для литий-ионных аккумуляторов. Электрохим. Acta 47 , 1423–1439 (2002).
CAS Статья Google Scholar
Buqa, H. et al. Формирование пленки SEI на высококристаллических графитовых материалах в литий-ионных батареях. J. Источники энергии 153 , 385–390 (2006).
ADS CAS Статья Google Scholar
Michan, A. L. et al. Восстановление фторэтиленкарбоната и виниленкарбоната: понимание добавок к электролиту литий-ионных аккумуляторов и межфазного образования твердого электролита. Chem. Матер. 28 , 8149–8159 (2016).
CAS Статья Google Scholar
Ushirogata, K., Sodeyama, K., Okuno, Y. & Tateyama, Y. Аддитивный эффект на восстановительное разложение и связывание карбонатного растворителя с образованием межфазной границы твердого электролита в литий-ионной батарее. J. Am. Chem. Soc. 135 , 11967–11974 (2013).
CAS PubMed Статья Google Scholar
Ота, Х., Саката, Ю., Иноуэ, А., Ямагути, С. Анализ слоев SEI, полученных из виниленкарбоната, на графитовом аноде. J. Electrochem. Soc. 151 , A1659 – A1669 (2004).
CAS Статья Google Scholar
Wang, Y., Nakamura, S., Tasaki, K. & Balbuena, P. B. Теоретические исследования для понимания химии поверхности угольных анодов для литий-ионных батарей: как виниленкарбонат играет свою роль в качестве добавки к электролиту? J. Am. Chem. Soc. 124 , 4408–4421 (2002).
CAS PubMed Статья Google Scholar
Херстедт, М., Андерссон, А.М., Ренсмо, Х., Зигбан, Х. и Эдстрем, К.Характеристика SEI, образованного на природном графите в электролитах на основе ПК. Электрохим. Acta 49 , 4939–4947 (2004).
CAS Статья Google Scholar
Чжан, С.С., Сюй, К. и Джоу, Т.Р. Исследование EIS по образованию границы раздела твердых электролитов в литий-ионных аккумуляторах. Электрохим. Acta 51 , 1636–1640 (2006).
CAS Статья Google Scholar
Son, H. B. et al. Влияние восстанавливающих циклических карбонатных добавок и линейных карбонатных сорастворителей на быструю заряжаемость ячеек LiNi0.6Co0.2Mn0.2O2 / графит. J. Источники энергии 400 , 147–156 (2018).
ADS CAS Статья Google Scholar
Deng, B. et al. Влияние потенциала отсечки заряда на добавку электролита для полных ячеек с мезоуглеродными микрошариками LiNi0.6Co 0.2Mn0.2O2. Energy Technol. 7 , 1800981 (2019).
Артикул CAS Google Scholar
Zuo, X. et al. Влияние трис (триметилсилил) бората на сохранение высоковольтной емкости ячеек LiNi0,5Co0,2Mn0,3O2 / графит. J. Источники энергии 229 , 308–312 (2013).
CAS Статья Google Scholar
Deng, B. et al. Исследование влияния высоких температур на циклическую стабильность LiNi0.Катод 6Co0.2Mn0.2O2 с использованием инновационной добавки к электролиту. Электрохим. Acta 236 , 61–71 (2017).
ADS CAS Статья Google Scholar
Han, J.-G., Kim, K., Lee, Y. & Choi, N.-S. Поглощающие материалы для стабилизации LiPF6-содержащих карбонатных электролитов для литий-ионных аккумуляторов. Adv. Матер. 31 , 1804822 (2019).
Артикул CAS Google Scholar
Фэн П., Ли, К. Н., Ли, Дж. У., Чжан, С. и Нгаи, М. Ю. Доступ к новому классу синтетических строительных блоков посредством трифторметоксилирования пиридинов и пиримидинов. Chem. Sci. 7 , 424–429 (2016).
CAS PubMed Статья Google Scholar
Alpegiani, M., Zarini, F. & Perrone, E. О получении 4-гидроксиметил-5-метил-1,3-диоксол-2-она. Synth. Commun. 22 , 1277–1282 (1992).
CAS Статья Google Scholar
Liu, J. B. et al. Серебро-опосредованное окислительное трифторметилирование фенолов: прямой синтез арилтрифторметиловых эфиров. Angew. Chem. Int. Эд. 54 , 11839–11842 (2015).
CAS Статья Google Scholar
Фарлоу, М. В., Мэн, Э. Х. и Таллок, Д. В. Карбонилфторид.Неорганические синтезы (Rochow, E.G. ed.) Vol. 6, 155–158 (McGraw-Hill Book Company, Inc., 1960). https://doi.org/10.1002/9780470132371.ch58.
Аватанео М., Де Патто У., Галимберти М. и Маркионни Г. Синтез α, ω-диметоксифторполиэфиров: механизм реакции и кинетика. J. Fluor. Chem. 126 , 631–637 (2005).
Артикул Google Scholar
Петцольд, Д.и другие. Опосредованное видимым светом высвобождение и превращение фторфосгена in situ. Chem. Евро. J. 25 , 361–366 (2019).
CAS PubMed Статья Google Scholar
Xu, W., Vegunta, S. S. & Flake, J. C. Аноды из кремниевых нанопроволок с модифицированной поверхностью для литий-ионных аккумуляторов. J. Источники энергии 196 , 8583–8589 (2011).
ADS CAS Статья Google Scholar
Zhang, J. et al. Прямое наблюдение неоднородной межфазной границы твердого электролита на аноде из MnO с помощью атомно-силовой микроскопии и спектроскопии. Nano Lett. 12 , 2153–2157 (2012).
ADS CAS PubMed Статья Google Scholar
Wan, G. et al. Подавление роста дендритного лития путем образования на месте химически стабильной и механически прочной межфазной границы твердого электролита. ACS Appl. Матер. Интерфейсы 10 , 593–601 (2018).
CAS PubMed Статья Google Scholar
Снеддон И. Н. Связь между нагрузкой и проникновением в осесимметричной задаче Буссинеска для штампа произвольного профиля. Внутр. J. Eng. Sci. 3 , 47–57 (1965).
MathSciNet МАТЕМАТИКА Статья Google Scholar
Колле, Дж. П., Шуман, Х., Леджер, Р. Э., Ли, С. и Вайзель, Дж. У. Эластичность отдельного фибринового волокна в сгустке. Proc. Natl Acad. Sci. США 102 , 9133–9137 (2005).
ADS CAS PubMed Статья Google Scholar
Чжан, К., Ву, Т., Лу, Дж. И Амин, К. Растворение, миграция и осаждение ионов переходных металлов в литий-ионных батареях на примере катодов на основе марганца — критический обзор . Energy Environ. Sci. 11 , 243–257 (2018).
CAS Статья Google Scholar
Гилберт, Дж. А., Шкроб, И. А. и Абрахам, Д. П. Растворение переходного металла, миграция ионов, электрокаталитическое восстановление и потеря емкости в полных литий-ионных элементах. J. Electrochem. Soc. 164 , A389 – A399 (2017).
CAS Статья Google Scholar
Ravdel, B. et al. Термостойкость электролитов литий-ионных аккумуляторов. J. Источники энергии 119-121 , 805–810 (2003).
ADS CAS Статья Google Scholar
Ko, M. et al. Масштабируемый синтез графита, внедренного в кремний в нанослой, для высокоэнергетических литий-ионных аккумуляторов. Нат. Энергетика 1 , 16113 (2016).
ADS CAS Статья Google Scholar
Делли, Б. Полностью электронный численный метод решения функционала локальной плотности для многоатомных молекул. J. Chem. Phys. 92 , 508–517 (1990).
ADS CAS Статья Google Scholar
Делли Б. От молекул к твердым телам с подходом DMol 3 . J. Chem. Phys. 113 , 7756–7764 (2000).
ADS CAS Статья Google Scholar
Klamt, A. & Schüürmann, G. COSMO: новый подход к диэлектрическому экранированию в растворителях с явными выражениями для экранирующей энергии и ее градиента. J. Chem. Soc. Perkin Trans. 2 , 799–805 (1993).
Артикул Google Scholar
Холл, Д. С., Селф, Дж. И Дан, Дж. Р. Диэлектрические постоянные для квантовой химии и литий-ионных батарей: смеси растворителей этиленкарбоната и этилметилкарбоната. J. Phys. Chem. С 119 , 22322–22330 (2015).
CAS Статья Google Scholar
Лойенга, Х. Диэлектрические проницаемости гетерогенных смесей. Physica 31 , 401–406 (1965).
ADS CAS Статья Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Объем рынка электролита для литий-ионных аккумуляторов в 2021 г., среднегодовой темп роста 6,0%, ведущие растущие компании: Mitsubishi Chemical, UBE Industries, Panax-Etec и, конечный пользователь, SWOT-анализ в отрасли за 2026 г.
Отдел новостей MarketWatch не участвовал в создании этого контента.
16 июня 2021 г. (Expresswire) — В 2021 году, « Рынок электролита для литий-ионных аккумуляторов » Размер, состояние и анализ рынка, прогноз до 2027 года | (Количество страниц: 117)
Рост рынка электролита для литий-ионных аккумуляторов и тенденции по типу (жидкий электролит, твердый электролит), по применению (бытовая электроника, электромобили и др.) География (Северная Америка (США, Канада и др.) Мексика), Южная Америка (Китай, Япония, Корея, Индия и Юго-Восточная Азия), Европа (Германия, Франция, Великобритания, Россия и Италия), Азиатско-Тихоокеанский регион (Китай, Япония, Корея, Индия и Юго-Восточная Азия), Ближний Восток и Африка (Саудовская Аравия, Египет, Нигерия и Южная Африка)) Тенденции развития отрасли до 2021 года.
Кто являются ключевыми игроками на рынке электролитов для литий-ионных аккумуляторов и насколько высока конкуренция в 2021 году?
Информация о компании: Список ведущих производителей / ключевых игроков в отчете по анализу рынка электролитов литий-ионных аккумуляторов:
● Mitsubishi Chemical ● UBE Industries ● Panax-Etec ● Soulbrain ● BASF e-Mobility ● Mitsui Chemicals ● Shenzhen Capchem ● Guotai Huarong ● Материалы Guangzhou Tinci ● Tianjin Jinniu ● Dongguan Shanshan (DGSS) ● Zhuhai Smoothway ● Пекинский институт химических реактивов ● Shantou Jinguang High-Tech ● Central GlassПолучите образец отчета о рынке электролитов для литий-ионных батарей за 2021 год
Что такое Обзор отрасли?
В этом отчете исследуется рынок электролитов для литий-ионных аккумуляторов.Литий-ионные батареи в основном состоят из четырех основных компонентов: анодного материала, катодного материала, электролита и сепаратора. Электролит является одним из ключевых сырьевых материалов для литий-ионных аккумуляторов, он является «кровью» литий-ионных аккумуляторов, между положительным и отрицательным полюсом аккумулятора играет роль переноса энергии, гарантируя, что литий-ионные аккумуляторы имеют высокое напряжение, высокая удельная энергия и другие преимущества. На его долю приходится около 5-12% затрат на производство литий-ионных аккумуляторов.Обычно электролит готовится из органического растворителя высокой чистоты, электролита, добавки и других материалов при определенных условиях и определенной пропорции.
Органический растворитель входит в состав раствора электролита; в настоящее время используемый органический растворитель представляет собой в основном диметилкарбонат, диэтилкарбонат, пропиленкарбонат, этиленкарбонат, этилметилкарбонат и другие категории. Основные распространенные электролиты — гексафторфосфат лития, тетрафторборат лития и др.с точки зрения стоимости, безопасности и т. д. гексафторфосфат лития является наиболее распространенным коммерческим электролитом.
Анализ рынка и аналитическая информация: Мировой рынок электролита для литий-ионных аккумуляторов
Мировой рынок электролита для литий-ионных аккумуляторов оценивается в 1552,2 миллиона долларов США в 2020 году, и ожидается, что к концу 2026 года он достигнет 2344,5 миллиона долларов США, при этом среднегодовой темп роста составит 6,0%. в течение 2021-2026 гг.
Мировой рынок электролитов для литий-ионных аккумуляторов: факторы и ограничения
В исследовательский отчет включен анализ различных факторов, способствующих росту рынка.Он представляет собой тенденции, ограничения и движущие силы, которые изменяют рынок в положительную или отрицательную сторону. В этом разделе также представлены различные сегменты и приложения, которые потенциально могут повлиять на рынок в будущем. Подробная информация основана на текущих тенденциях и исторических событиях. В этом разделе также представлен анализ объема производства на мировом рынке, а также по каждому типу с 2015 по 2026 год. В этом разделе упоминается объем производства по регионам с 2015 по 2026 год.Ценовой анализ включен в отчет по каждому типу с 2015 по 2026 год, производителю с 2015 по 2020 год, региону с 2015 по 2020 год и мировым ценам с 2015 по 2026 год.
Тщательная оценка ограничений, включенных в отчет отображает контраст между драйверами и дает возможность для стратегического планирования. Факторы, которые омрачают рост рынка, имеют решающее значение, поскольку их можно понять как создание различных способов использования прибыльных возможностей, которые присутствуют на постоянно растущем рынке.Кроме того, для понимания рынка Bette
были проанализированы мнения экспертов рынка. Также обсуждаются размер рынка различных сегментов и аспекты их роста, а также сравнительный анализ конкурентов, исторические данные и прогнозы, доли доходов компании, региональные возможности. , Последние тенденции и динамика, тенденции роста, различные заинтересованные стороны, такие как инвесторы, генеральные директора, трейдеры, поставщики, исследования и СМИ, глобальный менеджер, директор, президент, SWOT-анализ i.е. Сила, слабость, возможности и угрозы для организации и другие. Прогноз доходов, доля компании, конкурентная среда, факторы роста и тенденции
COVID-19 / Большая изоляция оказала давление на мировую экономику, а вместе с ней и производственный сектор, производство, сбои и финансы.
ЧТОБЫ ПОНЯТЬ, КАК В ДАННОМ ОТЧЕТЕ ОСУЩЕСТВЛЯЕТСЯ ВОЗДЕЙСТВИЕ COVID-19 — ЗАПРОСИТЕ ОБРАЗЕЦ
Что касается продукта, то этот отчет отображает сборку, выручку, цену, долю рынка Классификаций и темпы роста каждого типа, в первую очередь разделен на
● Жидкий электролит ● Твердый электролитС точки зрения пользователей / приложений с наибольшим числом пользователей, в этом отчете основное внимание уделяется состоянию и перспективам основных приложений / конечных пользователей, потреблению (продажам), доле рынка и темпам роста для каждого приложения, в том числе
● Бытовая электроника ● Электромобиль ● ДругоеПолучите образец отчета в формате PDF @ https: // www.360marketupdates.com/enquiry/request-sample/14828649
Целостное исследование рынка формируется с учетом разброса факторов, от демографических условий и деловых циклов в конкретной стране до микроэкономических воздействий на конкретный рынок. Исследование выявило сдвиг в рыночных парадигмах с точки зрения региональных конкурентных преимуществ и, следовательно, конкурентного ландшафта основных игроков. Дополнительно осуществляется анализ спроса на переработку и сырье и оборудование для добычи и сбыта.
Объем отчета:
Этот отчет посвящен электролиту для литий-ионных аккумуляторов на мировом рынке, особенно в Северной Америке, Европе и Азиатско-Тихоокеанском регионе, Южной Америке, Ближнем Востоке и Африке. В этом отчете рынок классифицируется по производителям, регионам, типу и применению. Отчет о рынке литий-ионных аккумуляторных электролитов дает четкое представление о текущем рыночном сценарии, который включает исторический и прогнозируемый размер рынка с точки зрения стоимости и объема, технологического прогресса, макроэкономических и определяющих факторов на рынке.
Рынок электролита для литий-ионных аккумуляторов анализ по географическим регионам: Основные регионы, охваченные отчетом: Потребление по регионам 2021 : —
Северная Америка, США, Канада, Европа, Германия, Франция, Великобритания, Италия, Россия, Азиатско-Тихоокеанский регион, Китай, Япония, Южная Корея, Индия, Австралия, Тайвань, Индонезия, Таиланд, Малайзия, Филиппины, Вьетнам, Латинская Америка, Мексика, Бразилия, Аргентина, Ближний Восток и Африка, Турция, Саудовская Аравия, ОАЭ
Отчет может помочь узнать рынок и разработать соответствующую стратегию расширения бизнеса.В рамках анализа стратегии он дает понимание от позиционирования на рынке и маркетинговых каналов до потенциальных стратегий роста, обеспечивая углубленный анализ для новых брендов или существующих конкурентов в отрасли электролитов для литий-ионных аккумуляторов. Отчет о мировом рынке электролитов для литий-ионных аккумуляторов 2021 предоставляет эксклюзивные статистические данные, данные, информацию, тенденции и детали конкурентной среды в этом нишевом секторе.
Заполните форму предварительного заказа для отчета @ https: // www.360marketupdates.com / запрос / предварительный заказ / 14828649
Ключевые вопросы и Ключевые моменты, затронутые в этом отчете об исследовании рынка электролита для литий-ионной батареи:
● Определить, описать и спрогнозировать рынок продуктов с электролитом для литий-ионных аккумуляторов по тип, приложение, конечный пользователь и регион. ● Рынок электролита для литий-ионных аккумуляторов 2021 г. Анализ внешней среды предприятия и анализ PEST. ● Предоставить компании стратегии борьбы с последствиями COVID-19.● Динамический анализ рынка электролитов для литий-ионных аккумуляторов, включая движущие факторы рынка, ограничения развития рынка. ● Анализ стратегии выхода на рынок литий-ионных аккумуляторов и электролитов для новых игроков или игроков, готовых выйти на рынок, включая определение сегмента рынка, анализ клиентов, модель распределения, обмен сообщениями о продуктах и их позиционирование, а также анализ ценовой стратегии. ● Каковы ключевые факторы развития мирового рынка электролитов для литий-ионных аккумуляторов? ● Кто являются основными производителями на рынке электролитов для литий-ионных аккумуляторов? ● Каковы рыночные возможности, рыночный риск и обзор рынка электролитов для литий-ионных батарей? ● Каков анализ продаж, доходов и цен ведущих производителей на рынке электролитов для литий-ионных аккумуляторов? ● Кто такие дистрибьюторы, продавцы и дилеры на рынке электролитов для литий-ионных батарей? ● С какими возможностями и угрозами на рынке электролита для литий-ионных батарей сталкиваются поставщики на мировом рынке электролита для литий-ионных аккумуляторов? ● Что такое анализ продаж, доходов и цен по типам и областям применения на рынке электролитов для литий-ионных аккумуляторов? ● Каков анализ продаж, доходов и цен по регионам рынка электролитов для литий-ионных батарей?С помощью таблиц и цифр, помогающих анализировать глобальный прогноз рынка электролитов для литий-ионных батарей, это исследование предоставляет ключевую статистику о состоянии отрасли и должно стать ценным источником рекомендаций и указаний для компаний и частных лиц, заинтересованных в рынке.
Основные моменты из содержания:
1.1 Литий-ионный аккумуляторный электролит
1.2 Ключевые сегменты рынка в этом исследовании
1.3 Основные производители, охваченные
1.4 Рынок по типу
1.4.1 Глобальный электролит для литий-ионных аккумуляторов Скорость роста размера рынка по типам
1.5 Рынок по приложениям
1.5.1 Глобальные темпы роста объема рынка электролитов для литий-ионных батарей по приложениям
1.6 Цели исследования
1.7 лет рассмотрения
2 Краткое содержание
2.1 Мировое производство электролита для литий-ионных аккумуляторов
2.1.1 Мировой доход от электролита для литий-ионных аккумуляторов 2015-2026
2.1.2 Мировое производство электролита для литий-ионных аккумуляторов 2015-2026
2.1.3 Емкость электролита для литий-ионных аккумуляторов в мире, 2015-2026 гг.
2.1.4 Ценообразование и тенденции в области маркетинга электролитов для литий-ионных аккумуляторов в мире
2.2 Скорость роста электролита для литий-ионных аккумуляторов (CAGR) 2021-2026 гг.
2.3 Анализ конкурентной среды
2.3.1 Коэффициент концентрации рынка производителей (CR5 и HHI)
2.3.2 Основные производители электролитов для литий-ионных батарей
2.4 Движущие силы рынка, тенденции и проблемы
2.5 Макроскопический индикатор
2.5.1 ВВП для основных регионов
2.5.2 Цена сырья в долларах: эволюция
3 Объем рынка по производителям
3.1 Производство электролита для литий-ионных батарей по производителям
3.1.1 Производство электролита для литий-ионных аккумуляторов по производителям
3.1.2 Доля рынка производства электролита для литий-ионных аккумуляторов по производителям
3.2 Выручка от производства электролита для литий-ионных аккумуляторов по производителям
3.2.1 Выручка от производства электролита для литий-ионных аккумуляторов по производителям (2015-2020)
3.2.2 Доля выручки от производства электролита для литий-ионной батареи по производителям (2015-2020)
3.3 Цена электролита для литий-ионной батареи по производителям
3.4 Слияния и поглощения, планы расширения
4 Производство электролита для литий-ионных аккумуляторов по регионам
4.1 Мировое производство электролита для литий-ионных аккумуляторов по регионам
4.1.1 Доля мирового рынка производства электролита для литий-ионных аккумуляторов по регионам
4.1.2 Мировой литий Доля рынка ионных аккумуляторных электролитов по регионам
4,2 США
4.2.1 Производство электролитов для литий-ионных аккумуляторов в США
4.2.2 Выручка от производства электролитов для литий-ионных аккумуляторов в США
4.2.3 Основные игроки в США
4.2.4 Импорт и экспорт электролитов для литий-ионных аккумуляторов в США
4.3 Европа
4.3.1 Производство электролитов для литий-ионных аккумуляторов в Европе
4,3 .2 Выручка от производства электролитов для литий-ионных аккумуляторов в Европе
4.3.3 Ключевые игроки в Европе
4.3.4 Импорт и экспорт электролитов для литий-ионных аккумуляторов в Европе
4,4 Китай
4.4.1 Производство электролита для литий-ионных аккумуляторов в Китае
4.4.2 Доходы от производства электролитов для литий-ионных аккумуляторов в Китае
4.4.3 Ключевые игроки в Китае
4.4.4 Импорт и экспорт электролита для литий-ионных аккумуляторов в Китае
4.5 Япония
4.5.1 Япония Производство электролита для литий-ионных аккумуляторов
4.5.2 Выручка от производства электролитов для литий-ионных аккумуляторов в Японии
4.5.3 Основные игроки в Японии
4.5.4 Импорт и экспорт электролитов для литий-ионных аккумуляторов в Японии
4.6 Другие регионы
4.6.1 Южная Корея
4.6.2 Индия
4.6.3 Юго-Восточная Азия
5 Потребление электролита литий-ионной батареи по регионам
5.1 Глобальное потребление электролита литий-ионной батареи по регионам
5.1.1 Глобальное Потребление электролита литий-ионной батареи по регионам
5.1.2 Доля мирового рынка потребления электролита литий-ионной батареи по регионам
5.2 Северная Америка
5.2.1 Потребление электролита литий-ионной батареи в Северной Америке приложением
5.2.2 Потребление электролита литий-ионного аккумулятора в Северной Америке по странам
5.2.3 США
5.2.4 Канада
5.2.5 Мексика
5.3 Европа
5.3.1 Европа Литий-ионный аккумулятор Потребление электролита приложением
5.3. 2 Европа Литий-ионный аккумулятор Потребление электролита по странам
5.3.3 Германия
5.3.4 Франция
5.3.5 Великобритания
5.3.6 Италия
5.3.7 Россия
5.4 Азиатско-Тихоокеанский регион
5.4.1 Потребление электролита литий-ионной батареи в Азиатско-Тихоокеанском регионе
5.4.2 Потребление электролита литий-ионной батареи в Азиатско-Тихоокеанском регионе по странам
5.4.3 Китай
5.4.4 Япония
5.4.5 Южная Корея
5.4.6 Индия
5.4.7 Австралия
5.4.8 Индонезия
5.4.9 Таиланд
5.4.10 Малайзия
5.4.11 Филиппины
5.4.12 Вьетнам
5.5 Центральная и Южная Америка
5.5.1 Потребление электролита литий-ионной батареи в Центральной и Южной Америке по приложениям
5.5.2 Потребление электролита в литий-ионной батарее в Центральной и Южной Америке по странам
5.5.3 Бразилия
5.6 Ближний Восток и Африка
5.6.1 Расход электролита литий-ионных батарей на Ближнем Востоке и в Африке по приложениям
5.6.2 Потребление электролита в литий-ионных аккумуляторах на Ближнем Востоке и в Африке по странам
5.6.3 Турция
5.6.4 Страны ССЗ
5.6.5 Египет
5.6.6 Южная Африка
6 Размер рынка по типу
6.1 Глобальный анализ электролита литий-ионной батареи Dada по типу
6.2 Глобальный доход от электролита литий-ионных аккумуляторов по типу
6.3 Цена электролита для литий-ионной батареи по типу
7 Объем рынка в зависимости от приложения
7.1 Обзор
7.2 Глобальный анализ электролита литий-ионного аккумулятора Dada по приложению
7.2.1 Глобальное потребление электролита для литий-ионных аккумуляторов по приложениям
7.2.2 Доля мирового рынка потребления электролитов литий-ионных аккумуляторов по приложениям (2015-2020)
Продолжение….
Просмотрите полное содержание на
https://www.360marketupdates.com/TOC/14828649#Tables
Причины купить этот отчет:
● Чтобы получить полный обзор электролита литий-ионной батареи Рынок ● Чтобы получить обширную информацию о ведущих игроках в этой отрасли, их портфелях продуктов и ключевых стратегиях, принятых игроками.● Чтобы получить представление о странах / регионах на рынке электролитов для литий-ионных аккумуляторов.Приобрести этот отчет (цена 2900 долларов США за однопользовательскую лицензию) — https://www.360marketupdates.com/purchase/14828649
Свяжитесь с нами:
Имя: Mr. Ajay More
Электронная почта: [email protected]
Организация: 360 Обновления рынка
Телефон: +14242530807 / + 44 20 3239 8187
Объем рынка стоматологических брекетов в 2021 году с среднегодовым темпом роста 5.4%, отчет о ведущих компаниях охватывает проблемы рынка, технологии, последние тенденции и прогноз на 2027 год
Размер рынка столовых приборов на биологической основе на 2021 год с CAGR%, Ведущие растущие компании: Huhtamäki, Packaging Finance, Biodegradable Food Service и , Конечный пользователь, SWOT-анализ в отрасли в 2026 году
Размер рынка White Spirit в 2021 году: доля отрасли, стратегия ведущих игроков, планы развития, растущий спрос, среднегодовой темп роста, драйверы и перспективы возможностей с ведущими растущими компаниями
Пресс-релиз, распространенный The Express Wire
Чтобы просмотреть исходную версию на Express Wire, посетите рынок электролита для литий-ионных аккумуляторов, размер рынка 2021 года, среднегодовой темп роста 6.0%, Лидеры роста: Mitsubishi Chemical, UBE Industries, Panax-Etec и, конечный пользователь, SWOT-анализ в отрасли на 2026 год
COMTEX_388350382 / 2598 / 2021-06-16T00: 13: 17
Есть ли проблемы с этим пресс-релизом? Свяжитесь с поставщиком исходного кода Comtex по адресу [email protected]. Вы также можете связаться со службой поддержки клиентов MarketWatch через наш Центр поддержки клиентов.
Отдел новостей MarketWatch не участвовал в создании этого контента.
Внутри аккумуляторов, питающих ваш автомобиль, телефон и многое другое
Батареи завоевали современный мир, не сильно изменившись.
Смартфон, для сравнения, имеет гораздо меньше общего с предшествующими ему мэйнфреймами. То же самое касается Tesla Model 3 и Ford Model T. Но литий-ионная технология, используемая в современных батареях, выдержала десятилетия экспоненциального роста — переход от гаджетов к электромобилям и даже порождение нескольких миллиардеров на этом пути — без серьезных изменений в его структура с тех пор, как Sony впервые коммерциализировала эту технологию в 1991 году.
Это не потому, что химики не пробовали. Просто разработка новых материалов, отвечающих промышленным стандартам, — очень сложная проблема.
Все батареи состоят из четырех компонентов: двух электродов (анода и катода), жидкого электролита, который помогает ионам перемещаться между электродами, и разделителя, предотвращающего прямой контакт электродов друг с другом и предотвращающего возгорание. Когда батарея заряжена, ионы текут от катода к аноду. Когда он разряжается, ионы меняют свой курс.
По мере того, как мир движется к быстрому сокращению выбросов парниковых газов, продолжается гонка за то, чтобы подключить к еще более мощным батареям больше вещей: электросети, грузовики, корабли и даже самолеты. Внутреннее пространство этой важной технологии, наконец, готово увидеть драматические изменения, и ряд скрытых стартапов обещает прорывы. QuantumScape Corp. утверждает, что создала новый материал для аккумуляторов, который позволил бы электромобилям путешествовать дальше и заряжаться намного быстрее — и в результате стартап имеет оценку, которая в последние недели колеблется от 13 до 20 миллиардов долларов, даже без каких-либо доходов от продаж. достопримечательность.Его конкуренты, в том числе такие гиганты, как Samsung и Panasonic, также гонятся за батареями следующего поколения.
Прежде чем мы перейдем к аккумуляторному будущему, важно понять физическую эволюцию современной литий-ионной технологии. Миллиарды людей используют телефоны с более быстрой подзарядкой и автомобили с большей дальностью действия, но немногие из нас могут объяснить, что стоит за этими улучшениями. Это история хитростей: небольшая эффективность производства, небольшие улучшения в материалах и небольшой прирост производительности.
Батарея оценивается по тому, сколько энергии она заряжает. Этот ключевой фактор тесно связан со скоростью зарядки аккумулятора, количеством циклов заряда-разряда, которое он может выдержать, и безопасностью. Повышенная плотность энергии также может сделать его более подверженным возгоранию. Более высокая скорость перезарядки может привести к сокращению жизненных циклов.
В конечном счете, цена царит безраздельно. Это определяется тем, сколько энергии может хранить батарея, материалами, из которых она изготовлена, и толщиной электродного покрытия, которое можно нанести без ущерба для характеристик.Чем ниже стоимость, тем дешевле электромобиль.
За последнее десятилетие небольшие разработки привели к совокупному снижению стоимости литий-ионных батарей более чем на 90%. С учетом будущих разработок исследовательская группа BloombergNEF в области экологически чистой энергии ожидает, что в следующем десятилетии затраты снизятся вдвое. Электромобили уже сейчас конкурентоспособны во многих странах, если учесть затраты на топливо в течение срока службы автомобиля, но по мере дальнейшего снижения стоимости аккумуляторов даже ориентировочная цена электромобилей будет дешевле, чем цена альтернативы с бензиновым двигателем.
Возвращаясь к началу, литий-ионный аккумулятор был получен в исследовательской лаборатории Exxon еще в 1970-х годах. Металлический литий, из которого сделан анод батареи, продолжал вызывать пожары, что привело к тому, что Exxon отказалась от этой идеи. Академический интерес продолжался, и ученые из разных частей мира разрабатывали более безопасные материалы.
Американский ученый Джон Гуденаф обнаружил, что катоды, полностью сделанные из кобальта, более безопасны и хранят больше энергии. Это открытие принесло ему Нобелевскую премию по химии в 2019 году.Затем марокканский ученый Рашид Язами обнаружил, что использование графита, формы углерода, в качестве анода, сделало литий-ионную батарею более стабильной и, таким образом, помогло ей прослужить дольше. Наконец, Кейдзабуро Тозава, глава аккумуляторного подразделения Sony в 1990-х годах, объединил все эти изобретения, чтобы создать первую коммерческую литий-ионную батарею.
Несмотря на то, что кобальт — дорогой металл, он оставался доступным для использования в небольших батареях ранних ноутбуков и мобильных телефонов. Но как только литий-ионные батареи начали использоваться в электромобилях, химики стали искать более дешевые металлы, такие как никель, марганец и даже железо.
Альтернативные металлы требуют тщательной оценки. Если дешевый металл означает непропорционально худшую производительность батареи, этого не произойдет. Благодаря миллионам экспериментов на рынке стали доминировать три типа катодов: оксиды никель-марганца-кобальта (NMC), оксиды никель-кобальта-алюминия (NCA) и фосфат лития-железа (LFP).
Давайте заглянем внутрь черного ящика, который представляет собой батарею, чтобы понять, как мы сюда попали и что будет дальше.
Сокращение выбросов кобальта с помощью NMC
Одной из первых альтернатив кобальту было использование никеля и марганца, которые превышали способность кобальта накапливать ионы лития.Но полностью потерять кобальт было невозможно. Химики узнали, что кобальт играет роль учителя в школе, дисциплинируя непослушные ионы лития во время их движения и гарантируя, что батарея выдержит большее количество циклов заряда-разряда.
За несколько лет исследований химикам удалось увеличить толщину материала анода и катода, которые являются энергоносителями в батарее, по сравнению с другими деталями. Методом проб и ошибок они также нашли смесь, в которой можно было бы использовать меньше кобальта и больше никеля.Все это помогает накапливать больше ионов лития на единицу объема и массы, что помогает увеличить удельную энергию батареи. Это, в свою очередь, увеличивает запас хода автомобиля и снижает его ориентировочную цену.
Алюминий приходит с Tesla NCA
Вместо марганца Tesla и ее партнер по производству аккумуляторов Panasonic обнаружили, что алюминий также может выполнять эту работу. В то время это считалось более рискованным делом, чем химия NMC, но ставка окупилась для Tesla. NCA также был дешевле, чем NMC, потому что это еще больше снизило использование кобальта.Химия стала основой автомобилей Tesla, которые часто могут похвастаться превосходными характеристиками по сравнению с другими электромобилями.
ХимикиTesla, занимающиеся аккумуляторными батареями, также обнаружили, что добавление небольшого количества оксида кремния, например, перца в макароны, помогает уменьшить количество графита, необходимое для хранения того же количества ионов лития. Это помогло уменьшить вес батареи без ущерба для производительности и снизить ее стоимость. Модель 3 была выпущена с этим новым химическим составом и помогла Tesla создать самый доступный автомобиль на сегодняшний день.
Кобальт не нужен с LFP
Конечная цель катодных материалов нынешнего поколения — полностью отказаться от использования кобальта. Первой попыткой этого было развитие химии LFP, которая сделала использование железа доступным по очень низким ценам. Батарея хорошо себя показала по большинству показателей, но она не могла хранить столько ионов лития, сколько могли бы иметь катоды с высоким содержанием кобальта.
Однако экономическая выгода была достаточно большой, чтобы батареи LFP нашли применение в дешевых электромобилях, таких как такси, и в электрических автобусах, которым требовались аккумуляторные блоки гораздо большего размера.Поскольку автобусы нуждаются в гораздо более крупных аккумуляторных батареях, а такси должно быть как можно более дешевым, это помогло сделать самый дешевый литий-ионный аккумулятор лучшим кандидатом для другого сегмента рынка электромобилей.
Более десяти лет работы помогли LFP-батареям улучшить производительность, даже несмотря на то, что они по-прежнему уступают химическим составам катодов на основе кобальта по плотности энергии. Основным преимуществом стало создание стабильной батареи с более толстыми материалами электродов. В сложной химической смеси, которая представляет собой батарею, небольшое увеличение толщины — немалый подвиг.
В твердотельное будущее
Конечная цель анода в литий-ионной батарее — использовать металлический литий. Стремление создать этот материал привело к плачевным результатам. Металлический литий нестабилен и склонен к возгоранию. Внутри аккумулятора при зарядке и разрядке он также имеет тенденцию образовывать тонкие нити, называемые дендритами, которые могут прорезать сепаратор и контактировать с катодом. Это вызывает короткое замыкание, а затем возгорание. Пожары аккумуляторных батарей потушить гораздо труднее, чем возгорания двигателей внутреннего сгорания.
Химики-разработчики аккумуляторов десятилетиями пытались решить проблему дендритов. Одной из многообещающих попыток является использование твердого электролита для замены жидкости в системе и подавления образования дендритов. Эта технология получила новое название: твердотельный аккумулятор. Если твердотельные аккумуляторы появятся на рынке во второй половине этого десятилетия, как и ожидалось, они, вероятно, будут представлять собой большой скачок в производительности аккумуляторов, увеличивая диапазон электромобилей на 50% и сокращая время зарядки до 15. минут.
Поскольку металлический литий выглядит как многообещающий анодный материал, химики-химики снова ищут новые катодные материалы. Ожидается, что эти новые материалы, не содержащие кобальта, еще больше повысят плотность энергии, что может сделать батареи достаточно легкими для питания электрических самолетов. Литий-ионные аккумуляторы прошли долгий путь от лабораторий Exxon до переворота автомобильной промышленности.

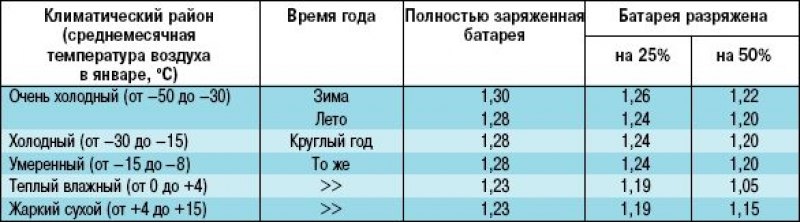
 Такими клеммами чаще всего оборудованы европейские и российские аккумуляторы. Диаметр плюсового зажима составляет 19,5 мм, минусового – 17,9 мм.
Такими клеммами чаще всего оборудованы европейские и российские аккумуляторы. Диаметр плюсового зажима составляет 19,5 мм, минусового – 17,9 мм.

 При увеличении плотности делается заключение о пригодности АКБ.
При увеличении плотности делается заключение о пригодности АКБ.