Вода с электролитами – что это такое и в чем ее польза
Независимо от того – пьете ли вы бутилированную воду или водопроводную, она, скорее всего, содержит следовые количества электролитов, таких как натрий, калий, магний и кальций.
Однако концентрация электролитов в напитках может сильно различаться. Некоторые бренды добавляют значительное количество минералов наряду с углеводами и продают свою воду в качестве спортивного напитка, в то время как другие добавляют лишь незначительное количество на вкус.
В этой статье мы рассмотрим потенциальные преимущества воды с электролитами, а также развенчаем мифы с ней связанные.
Вода с электролитами — для чего нужнаЧто такое вода с электролитами
Электролиты — это минералы, которые проводят электричество при растворении в воде. Они распределяются через жидкость в вашем теле и используют их электрическую энергию для облегчения важных функций организма.
Электролиты необходимы для:
- контроля баланса жидкости.
- регулирования кровяного давления.
- помощи вашим мышцам во время сокращения, включая сердечную мышцу.
- поддержания правильной кислотности крови (pH).
Обычные электролиты включают натрий, хлор, калий, магний и кальций. Вода с электролитами усилена этими заряженными минералами, но концентрации меняются от вида воды.
Если это не обозначено как «дистиллированная», то ваша обычная вода в бутылках обеспечивает, по крайней мере, небольшое количество электролитов.
Водопроводная вода также имеет электролиты. В среднем 1 литр водопроводной воды содержит 2-3% нормы суточного потребления для натрия, кальция и магния, но мало калия.
Напротив, такое же количество популярных спортивных напитков, обогащенных электролитом, содержит до 18% от нормы для натрия и 3% для калия, но содержит мало магния или кальция.
Читайте также: роль электролитов в организме
Электролиты являются заряженными минералами, важными для поддержания оптимальных функций организма. Обычно напитками с электролитами считаются вода и спортивные напитки.
Полезные свойства воды с электролитами
Может улучшить производительность физических упражнений
Вода, обогащенная электролитом, особенно спортивные напитки, может принести пользу спортсменам, помогая пополнять воду, электролиты и энергию, теряемую во время физических упражнений.
Во время физической активности вам нужны дополнительные жидкости, чтобы заменить воду, которая выходит с потом. Фактически, потеря воды всего на 1-2% от веса вашего тела может привести к снижению силы, скорости и фокуса.
Пот также содержит электролиты, в том числе значительное количество натрия, а также небольшое количество калия, кальция и магния. В среднем вы теряете около 1 грамма натрия с каждым литром пота.
Спортивные напитки рекомендуются на простой воде для восполнения жидкости и электролитов, если вы склонны много потеть, тренируетесь дольше одного часа или в жаркой обстановке.
Следует отметить, что спортивные напитки предназначены для спортсменов, а не для обычных людей с сидячим образом жизни. Наряду с электролитами они содержат калории из добавленного сахара. К примеру, бутылка Gatorade объемом 591 мл содержит колоссальные 30 граммов сахара.
Спортивные напитки предназначены для спортсменов и содержат электролиты вместе с углеводами для пополнения питательных веществ, потерянных при потоотделении. Они рекомендуются для длительных физических упражнений и в жаркую погоду.
Может спасти от обезвоживания во время болезни
В краткосрочной перспективе рвота и диарея обычно не являются серьезными условиями. Однако серьезные или постоянные симптомы могут быстро привести к обезвоживанию, если жидкости и электролиты не будут заменены.
Младенцы и дети особенно уязвимы к обезвоживанию от сильной рвоты и диареи. Американская академия педиатрии рекомендует использовать раствор для пероральной регидратации при первых признаках болезни для предотвращения обезвоживания.
Растворы для пероральной регидратации содержат воду, углеводы и электролиты в определенных пропорциях, которые легко усваиваются. Популярным примером является Pedialyte.
Спортивные напитки похожи, но содержат большее количество сахара. Они не рекомендуются для детей грудного и раннего возраста, поскольку они могут ухудшить диарею.
Спортивные напитки могут допускаться для более старших детей, если их разбавлять 1:1 с водой. Взрослые обычно могут пить как растворы для пероральной регидратации, так и спортивные напитки без проблем.
Важно отметить, что воды с электролитами может быть недостаточно для лечения тяжелого обезвоживания. Если диарея длится более 24 часов или если вы не можете поддерживать необходимый уровень питья, обратитесь за медицинской помощью.
Болезни, такие как рвота и диарея, могут привести к быстрой потере жидкости и электролитов. Для пополнения рекомендуется использовать пероральные регидратационные растворы.
Может помочь предотвратить тепловой удар
Горячие среды ставят вас под угрозу для различных заболеваний, связанных с теплом, которые варьируются от легкой тепловой сыпи до опасного для здоровья теплового удара.
Как правило, ваше тело управляет теплом, выделяя его через кожу и потение. Тем не менее, эта система охлаждения может начать сбой в жаркую погоду, в результате чего температура тела повысится до опасно высоких уровней.
Ключом к предотвращению заболеваний, связанных с теплом, является ограничение пребывания в тепле. Однако получение большого количества жидкости и электролитов также чрезвычайно важно, чтобы помочь телу оставаться прохладным.
В жарких условиях рекомендуется использовать водные и спортивные напитки для гидратации по сравнению с другими напитками. Напитки, содержащие кофеин, такие как газировка, кофе и чай, могут ухудшить обезвоживание, а также алкоголь.
Длительное воздействие тепла ставит вас под угрозу теплового удара. Рекомендуется использовать достаточное количество жидкости и электролитов, чтобы помочь телу оставаться прохладным.
Электролит против обычной воды
Адекватная гидратация необходима для общего состояния здоровья. Вода необходима практически для всех функций организма, включая транспортировку питательных веществ, регулирование температуры тела и промывку отходов и токсинов.
Как обычная, так и вода с электролитами, регулярно расходуется в соответствии с вашими ежедневными потребностями в жидкости, наряду с другими напитками, такими как кофе, чай, фруктовые соки и молоко.
Это распространенное неправильное представление о том, что вода с электролитами превосходит обычную воду для гидратации. В действительности это зависит от обстоятельств.
Более конкретно, вода с электролитами может быть полезной, если вы рискуете быстро потерять полезные нутриенты. Возможно, вам захочется рассмотреть напиток с улучшенным электролитом, если:
- Вы тренируетесь более одного часа.
- Вы сильно потеете во время тренировки.
- У вас рвота или диарея.
- Вы будете подвергаться воздействию тепла в течение длительного времени.
Вне спортивных состязаний, жаркой погоды и болезней обычная вода работает отлично, чтобы удовлетворить ваши ежедневные потребности в гидратации.
Хотя вода с электролитами может приносить определенные выгоды при определенных обстоятельствах, обычной воды достаточно для удовлетворения общих потребностей в гидратации.
Электролитную воду легко приготовить
Приготовление воды с электролитами является экономически эффективным и здоровым способом замены жидкости и электролитов, когда это необходимо.
Вот простой рецепт спортивного напитка из лимонного лимона, чтобы попробовать дома:
На выходе: 4 стакана (1 л)
Размер порции: 1 стакан (250 мл)
Ингредиенты:
- 1/4 ч.л. соли
- 1/4 стакана (60 мл) лимонного сока
- 1/4 стакана (60 мл) сока лайма
- 1 1/2 чашки (360 мл) несладкой кокосовой воды
- 2 стакана (480 мл) холодной воды
В отличие от купленных в магазине версий, этот рецепт обеспечивает освежающий рост электролитов без добавления сахара или каких-либо искусственных красителей или ароматизаторов.
Читайте также: вода с лимоном утром натощак — польза и вред
Заключительные мысли
Вода с электролитами усилена минералами, которые необходимо поддерживать организму, например, натрий, калий, магний и хлор.
В то время как нет необходимости пить напитки с добавлением электролитов все время, они могут быть полезны во время длительных упражнений, в жарких условиях или если у вас рвота или диарея.
Спортивные напитки и другие электролитные воды могут быть дорогими, поэтому вы можете рассмотреть домашнюю версию. Мало того, что ингредиенты доступны и дешевы, такая вода с электролитами является более полезным вариантом в отличие от промышленных продуктов.
Вам также будет интересно:
Мы будем благодарны, если вы поделитесь этой статьей в социальных сетях!
8 Напитков, богатых электролитами
1. Кокосовая вода
Кокосовая вода или кокосовый сок – это прозрачная жидкость, находящаяся внутри кокосового ореха.
За последние несколько лет она стала одним из самых популярных напитков на рынке, а теперь она разливается по бутылкам и продается по всему миру.
Кокосовая вода естественным образом содержит мало сахара и содержит различные электролиты, в том числе натрий, калий, кальций и магний.
При 46 калориях на чашку (240 мл) она также является более здоровой альтернативой сладким газированным напиткам, сокам и традиционным спортивным напиткам.
Вывод:
Кокосовая вода, естественным образом содержит мало калорий и сахара, но богата электролитами, такими как калий и магний.
2. Молоко
В дополнение к богатому содержанию электролитов, таких как кальций, натрий и калий, молоко обеспечивает организм человека здоровой комбинацией углеводов и белка. Эти два макроэлемента могут помочь вам восполнить их запасы и способствовать восстановлению мышечной ткани после тренировки.
Некоторые исследования предполагают, что эти характеристики могут сделать молоко лучшим напитком после тренировки, чем многие коммерческие спортивные напитки.
Учитывая, что польза молока зависит от содержащихся в нем электролитов, углеводов и белка, вы можете отдавать предпочтение цельному, низкожирному или обезжиренному молоку, в зависимости от ваших личных предпочтений.
Стоит отметить, что обычное коровье молоко не может быть правильным выбором для всех, особенно для тех, кто придерживается веганской диеты или не переносит молочные продукты.
Если вы не переносите лактозу, но все же хотите включить молоко в свой режим восстановления после тренировки, отдавайте предпочтение варианту без лактозы.
Между тем, если вы придерживаетесь веганской диеты или у вас аллергия на молочный белок, вам следует полностью избегать молока.
Хотя альтернативы растительного происхождения, вероятно, не принесут той же пользы, что и коровье молоко, некоторые исследования показали, что белок в соевом молоке может способствовать восстановлению мышц, в то же время обеспечивая организм электролитами, аналогично коровьему молоку.
Вывод:
Молоко является хорошим источником электролитов, а также белков и углеводов, что делает его хорошим напитком после тренировки.
3. Арбузный сок (и другие фруктовые соки)

Одна чашка (240 мл) 100% арбузного сока обеспечивает организм почти 6% от рекомендованной суточной нормы потребления (РСНП) калия и магния, в то же время предлагая небольшое количество других электролитов, таких как кальций и фосфор.
Арбузный сок также содержит L-цитруллин. При использовании в более высоких дозах эта аминокислота может улучшать транспорт кислорода и спортивные результаты.
Тем не менее текущие исследования показывают, что количество L-цитруллина в обычном арбузном соке, вероятно, недостаточно для того, чтобы оказать какое-либо измеримое влияние на физическую производительность.
Другие виды фруктовых соков также могут быть хорошим источником электролитов. Например, апельсиновый и вишневый сок также содержит калий, магний и фосфор.
Кроме того, 100% фруктовый сок является отличным источником витаминов и антиоксидантов.
Одним из основных недостатков использования фруктовых соков в качестве напитков для восполнения электролитов является то, что он обычно содержит мало натрия.
Если вы потеете в течение длительного периода времени и пытаетесь регидрировать организм напитком, который не содержит натрия, вы рискуете иметь низкий уровень натрия в крови.
Чтобы снизить этот риск, некоторые люди предпочитают готовить свои собственные спортивные напитки, используя комбинацию фруктовых соков, соли и воды.
Вывод:
Арбузный и другие фруктовые соки содержат несколько электролитов, но, как правило, имеют недостаток в натрии и содержат много сахара.
4. Смузи
Приготовление смузи – отличный способ смешать разнообразные богатые электролитами продукты в одну выпиваемую смесь.
Некоторыми из лучших источников электролитов являются цельные продукты, такие как фрукты, овощи, орехи, семена, бобовые и молочные продукты – все они могут быть смешаны при приготовлении вкусного и питательного смузи.
Если у вас расстройство желудка, и вы хотите восполнить потерянные электролиты, смузи может легче усваиваться и выглядеть более аппетитным, чем многие из вышеупомянутых продуктов в отдельности.
Смузи – также отличный вариант для тех, кто ищет восстановительный напиток после тренировки. Он может не только восполнить потерянные электролиты, но и стать хорошим продуктом для поддержания роста и восстановления мышечной ткани, если вы добавите в него некоторые богатые белком добавки.
Тем не менее смузи может быть не лучшим вариантом, если вы ищете напиток с электролитами для употребления во время изнурительных или продолжительных упражнений.
Это связано с тем, что при его употреблении вы можете чувствовать избыточную наполненность желудка, что не даст вам комфортно завершить тренировку. Таким образом, этот напиток, вероятно, лучше всего употреблять по крайней мере за 1 час до или сразу после тренировки.
Вывод:
Смузи позволяет получать электролиты из смешанных, цельных продуктов, таких как фрукты, овощи и молочные продукты. Это отличный восстановительный напиток до или после тренировки.
5. Обогащенная электролитами вода
Употребление наполненной электролитами воды может быть отличным, низкокалорийным способом пополнения электролитов и поддержания организма гидратированным.
Тем не менее не все виды электролитной воды созданы равными.
Большая часть водопроводной воды содержит около 2–3% от РСНП определенных электролитов, таких как натрий, кальций и магний.
Интересно отметить, что некоторые марки бутилированной воды с электролитами могут быть очень дорогостоящими и могут не содержать значительно больше электролитов, а в некоторых случаях даже меньше.
Тем не менее некоторые бренды специально разработаны, чтобы помочь с гидратацией и восполнением минералов, и содержат большее количество электролитов. Скорее всего, они будут стоить ваших денег, в зависимости от того, по какой причине вы пьете электролитный напиток в первую очередь.
Имейте в виду, что эти виды воды также могут содержать сахар, так как многие из них предназначены для пополнения запасов углеводов во время длительных тренировок. Если вам не нужны эти дополнительные калории сахара, отдавайте предпочтение вариантам с небольшим количеством или без добавления сахара.
Чтобы приготовить ароматизированную богатую электролитами воду самостоятельно, вы также можете попробовать добавить в бутылку с водой кусочки свежих фруктов и травы.
Вывод:
Обогащенная электролитами вода может быть отличным вариантом низкокалорийной гидратации, но помните о брендах, которые содержат большое количество добавленного сахара.
6. Электролитные таблетки

Таблетки электролитов – это удобный, недорогой и портативный способ приготовления собственного электролитного напитка, где бы вы ни находились.
Все, что вам нужно сделать, это опустить одну из таблеток в воду и встряхнуть или перемешать.
Большинство электролитных таблеток содержат натрий, калий, магний и кальций – хотя точные количества могут различаться в зависимости от бренда.
Они также имеют тенденцию быть низкокалорийными, почти не содержат сахара и имеют различные уникальные фруктовые вкусы.
Некоторые марки электролитных таблеток могут также содержать кофеин или дополнительные дозы витаминов, поэтому если вы хотите избежать каких-либо из этих дополнительных ингредиентов обязательно проверьте этикетку.
Если вы не можете найти электролитные таблетки в магазинах или надеетесь на более низкую цену, они широко доступны в Интернете.
Вывод:
Электролитные таблетки – это удобный и доступный вариант для приготовления собственного электролитного напитка. Все, что вам нужно сделать, это смешать таблетку с водой.
7. Спортивные напитки
Коммерчески продаваемые спортивные напитки, такие как Gatorade и Powerade, были одними из самых популярных электролитных напитков на рынке с 1980-х годов.
Эти напитки могут пригодиться спортсменам, тренирующимся на выносливость, которым нужна комбинация легкоусвояемых углеводов, жидкости и электролитов для поддержания гидратации, и энергии во время спортивных соревнований или тренировок.
Тем не менее коммерческие спортивные напитки также имеют некоторые серьезные недостатки. Как правило, они содержат много искусственных красителей, ароматизаторов и добавленного сахара, которые никому не нужны, будь вы спортсмен или нет.
На самом деле, порция Gatorade или Powerade объемом 355 мл содержит более 20 граммов добавленного сахара. Это более половины от рекомендуемой дневной нормы.
Кроме того, версии без сахара не могут быть лучшей альтернативой.
Хотя они не содержат добавленного сахара и имеют меньше калорий, они обычно содержат вместо этого сахарные спирты или сахарозаменители. Эти подсластители могут вызывать неприятные симптомы со стороны пищеварительного тракта, такие как газы и вздутие живота у некоторых людей.
Один из простых способов избежать менее благоприятных ингредиентов в спортивных напитках – приготовить их самостоятельно.
Просто используйте комбинацию из 100% фруктового сока, кокосовой воды и щепотки соли, чтобы приготовить более здоровый напиток с электролитами без искусственных ингредиентов и добавления сахара.
Вывод:
Коммерческие спортивные напитки могут быть полезны для восполнения электролитов во время интенсивных тренировок, но они часто содержат много сахара, искусственных красителей и ароматизаторов. Попробуйте приготовить более здоровую версию дома.
8. Педиалит (Pedialyte)
Педиалит – это коммерческий электролитный напиток, который продается для детей, но взрослые тоже могут его использовать.
Он предназначен для регидратации, когда вы испытываете потерю жидкости из-за диареи или рвоты. В нем намного меньше сахара, чем в типичном спортивном напитке, а натрий, хлорид и калий – единственные электролиты, которые в нем содержатся.
Каждая разновидность содержит только 9 граммов сахара, но ароматизированные варианты также содержат искусственные подсластители. Если вы хотите избежать искусственных подсластителей, отдавайте предпочтение неароматизированному варианту.
Вывод:
Педиалит – это регидратационная добавка, которая содержит только натрий, хлорид и калий. Он предназначен для детей или взрослых для восполнения электролитов во время приступа диареи или рвоты.
Нужно ли вам пить электролитный напиток?
Спортивные напитки и другие виды электролитных напитков часто продаются широкому кругу потребителей, но они, вероятно, не нужны большинству людей.
Фактически, регулярное употребление некоторых высококалорийных напитков с высоким содержанием сахара и электролитов может затруднить достижение ваших целей в отношении здоровья, особенно если они не используются по назначению.
Большинство здоровых, умеренно активных людей могут оставаться гидратированными и получать достаточное количество электролитов, придерживаясь сбалансированной, богатой питательными веществами диеты и выпивая много воды.
Потребность в жидкости может варьироваться в зависимости от человека, но обычно рекомендуется потреблять не менее 2–3 литров жидкости в день из комбинации продуктов питания и воды.
Тем не менее есть конкретные случаи, когда вы можете подвергнуться большему риску обезвоживания, и обычная еда и вода просто не будут его уменьшать.
Если вы занимаетесь непрерывной энергичной физической активностью более 60 минут, проводите длительные периоды времени в очень жаркой среде или испытываете диарею, или рвоту, электролитный напиток может быть необходим.
Если вы не уверены в правильности гидратации, обратите внимание на следующие признаки обезвоживания от легкой до умеренной степени:
- сухость во рту и на языке
- жажда
- вялость
- сухая кожа
- мышечная слабость
- головокружение
- темная моча
Если вы испытываете какие-либо из этих симптомов и потребляете достаточное количество жидкости, возможно, пришло время включить электролитный напиток в ваш рацион.
Если эти симптомы ухудшаются, обратитесь к врачу.
Вывод:
Большинство людей могут поддерживать водно-электролитный баланс только благодаря воде и сбалансированной диете. Тем не менее если вы занимаетесь длительной интенсивной физической активностью или испытываете рвоту, или диарею, электролитный напиток может быть оправдан.
Подведем итог
Электролиты – это минералы, которые помогают вашему телу выполнять множество жизненно важных функций, таких как гидратация, сокращение мышц, баланс pH и передача нервных сигналов.
Для правильного функционирования ваш организм должен постоянно поддерживать достаточный уровень жидкости и электролитов.
Напитки, такие как кокосовая вода, молоко, фруктовые соки и спортивные напитки, могут способствовать гидратации и электролитному балансу.
Для большинства людей сбалансированного питания и достаточного потребления воды достаточно для поддержания уровня электролитов. Однако в некоторых случаях может потребоваться использование электролитных напитков, особенно если вы испытываете быстрые потери жидкости из-за потоотделения или болезни.
Употребление большого количества воды и наблюдение за ранними признаками обезвоживания могут помочь вам определить, нужно ли вам пить электролитный напиток или нет.
Электролиты: что это и зачем они нужны организму?
Электролитами называют ионные растворы (соли), которые в природе существуют в виде минералов. Электролиты несут важную функцию гидратации организма для поддержания функции мышц и нервов. Поскольку тело человека в основном состоит из воды, важно получать эти минералы в достаточном количестве. Когда организм хорошо увлажнен, он лучше избавляется от внутренних токсинов, таких как мочевина и аммиак.
Эфирные электролиты, присутствующие в теле человека – это натрий, калий, бикарбонат, хлорид, кальций и фосфаты.
Почему электролиты так необходимы?
Когда почки функционируют в обычном режиме, они регулируют концентрацию перечисленных выше минералов в жидкости организма. В других условиях, например, при усиленной тренировке, большая часть жидкости (и минеральных электролитов) теряется. Это же может происходить при мочеиспускании, рвоте, поносе или через открытые раны.
Когда мы потеем, из нас выходит натрий, калий и хлорид. Именно поэтому спортсмены уделяют такое большое внимание поступлению электролитов после тренировки. Калий является жизненно важным минералом, ведь 90% калия находится в клеточных стенках. Важно ежедневно пополнять электролиты из жидкостей и пищевых продуктов.
Теряя жидкость, нужно не только пить воду, но и получать электролиты. Так организм быстрее увлажняется. Прием таких электролитов, как натрий, уменьшает потерю жидкости через мочеиспускание, питая мышцы, нервы и другие ткани.
Как получить электролиты естественным путем?
Стало модно восстанавливать баланс электролитов с помощью спортивных напитков, но лучший способ все-таки получать их с пищей. Сладкие спортивные напитки приводят только к быстрому пополнению минералов, но истощают организм в долгосрочной перспективе.
Продукты, которые дают организму электролиты:
Фрукты и овощи
Яблоки, кукуруза, свекла, морковь – все они насыщены электролитами. Также следует включить в рацион лаймы, лимоны, апельсины, сладкий картофель, артишоки, все виды кабачков и томатов. При возможности, лучше выбирать местные органические овощи.
Орехи и семена
Ешьте больше орехов – миндаль, кешью, грецкие орехи, арахис, фундук, фисташки содержат много электролитов. Добавьте в утреннюю кашу из овсяных хлопьев семена подсолнечника, тыквы, кунжута.
Бобовые
Фасоль, чечевица, маш являются отличным источником электролитов. Но следует помнить, что бобовые щедро сдабривают специями, чтобы избежать образования газов.
Темно-зеленые листовые овощи
Большинство зелени хорошо справляется с задачей наполнения организма минералами. Это может быть шпинат, зелень горчицы, мангольд. Все эти листовые овощи удерживают натрий, кальций, магний и также «пребиотики», которые отвечают за нормальную флору кишечника и пищеварение.
Бананы
Бананы содержат много различных минералов. Особенно богаты они калием, гораздо больше, чем любой другой продукт.
Совет: добавьте в питьевую воду щепотку гималайской соли и чайную ложку органического яблочного уксуса – и вы получите здоровую альтернативу спортивному напитку.
19.Вода как слабый электролит.Индикаторы.
Вода — один из наиболее слабых электролитов Химически чистая вода (дистиллированная) не проводит электрический ток. Но в ее составе есть небольшое количество заряженных частиц.
Название индикатора | Цвет индикатора в различных средах | ||
в кислой | в нейтральной | в щелочной | |
Метиловый оранжевый | Красный (рН < 3,1) | Оранжевый (3,1 < рН < 4,4) | Желтый (рН > 4,4) |
Метиловый красный | Красный (рН < 4,2) | Оранжевый (4,2 < рН < 6,3) | Желтый (рН > 6,3) |
Фенолфталеин | Бесцветный (рН < 8,0) | Бледно-малинов. (8,0 < рН < 9,8) | Малинов. (рН > 9,8) |
Лакмус | Красный (рН < 5) | Фиолетовый (5 < рН < 8) | Синий (рН > 8) |
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2H2O ↔ H3O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+
H2O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее:
[H+] = [OH—] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняетхарактер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
водородным показателем pH:
pH = -lg[H+] = lg (1/[H+])
Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу.
pOH = -lg[OH—] = lg (1/[OH—])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H+] = -lg(1·10-7) = 7
Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
Индикаторы − органические вещества, принимающие характерную окраску в нейтральной, кислотной и щелочной среде, в зависимости отзначения рН.
7 Водные растворы электролитов » СтудИзба
Тема 7. Водные растворы электролитов
Рассматриваемые вопросы:
1. Электролитическая диссоциация и причины ее возникновения.
2. Сильные и слабые электролиты.
3. Гидролиз солей.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
КА <=> К++А—.
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
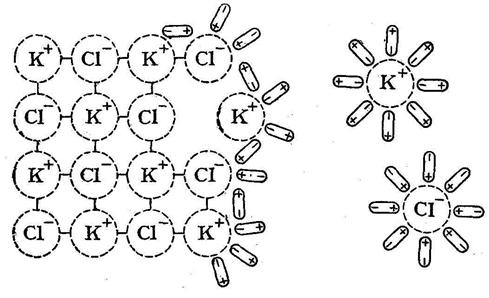
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов — гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А— в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
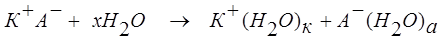 .
.
твердое жидкий раствор
вещество растворитель
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О <=> К+(Н2О)к + А—(Н2О)а.
Ассоциации К+(Н2О)к и А—(Н2О)а представляют собой гидратированные катионы и анионы.
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона 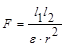 , где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
, где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
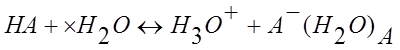 ,
,
где Н3О+ — ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с образованием отрицательных гидроксид–ионов ОН—:
МеОН + хН2О <=> Ме+(Н2О)к + ОН— + (х-к)Н2О,
где Ме+ — одновалентный катион.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 <=> Mg2+ + 2HSO4— ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 <=> Mg2+ + SO42-;
при х < у – основные соли
H2SO4 + 2Mg(OH)2 ® (MgOH)2SO4 + 2H2O;
(MgOH)2SO4 <=> 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А— + хН2О <=> К+(Н2О)к + А—(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
1. диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
2. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
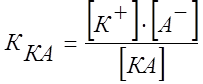 ,
,
где [К+], [A—] и [KA] — концентрации в растворе ионов 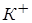 и
и 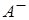 (в г-ион/л) и недиссоциированного соединения КА (в моль/л).
(в г-ион/л) и недиссоциированного соединения КА (в моль/л).
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А— в растворе равна
[К+] = [А—] = aС,
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
[КА]=(1- a)С.
Откуда 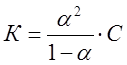 .
.
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
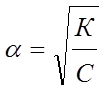 .
.
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 <=> Н+ + НСО3—
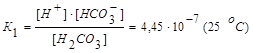 .
.
II стадия: НСО3— <=> Н+ + СО32-
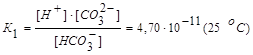 .
.
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
СН3СООН | <=> | H+ + CH3COO— | 1,76·10-5 |
NH4OH | <=> | NH4+ + OH— | 1,79·10-5 |
HNO2 | <=> | H+ + NO2— (18 °C) | 4·10-4 |
H2S | <=> | H+ + HS— | 6·10-8 |
H3PO4 | <=> | H+ + H2PO4— | 7,52·10-3 |
HF | <=> | H+ + F— | 6,61·10-4 |
HCN | <=> | H++CN— | 7,9·10-10 |
Ионообменные реакции
Реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения, называются ионообменными реакциями.
Правило Бертолле: равновесие в ионообменных реакциях смещается в сторону образования наименее диссоциированных соединений.
В соответствии с этим направление реакций ионного обмена определяется следующим эмпирическим правилом: ионные реакции протекают в сторону образования осадков, газов, слабых электролитов, комплексных ионов.
При написании уравнений ионных реакций сильные электролиты пишут в диссоциированном виде, слабые – в недиссоциированном.
Образование осадков:
AgNO3 + NaCl ® AgCl¯ + NaNO3
В растворе: Ag+ + NO3— + Na+ + Cl— ® AgCl¯ + Na+ + NO3—.
Исключим ионы, которые не взаимодействуют, тогда уравнение имеет вид:
Ag+ + Cl— ® AgCl¯.
Уравнения такого вида называются ионными.
Ионное уравнение получение гидроксида железа запишется следующим образом:
Fe3+ + 3OH— ® Fe(OH)3¯.
Образование газов:
Na2S + H2SO4 ® H2S + Na2SO4;
2Na+ + S2- + 2H+ + SO42- ® H2S + 2Na+ + SO42-;
2H+ + S2- ® H2S.
Образование слабых электролитов:
а. образование воды. Реакция, протекающая с образованием воды при взаимодействии ионов водорода (точнее, ионов гидроксония) и гидроксид–ионов, называется реакцией нейтрализации.
NaOH + HCl ® H2O + NaCl
OH— + H+ ® H2O
(H3O+ + OH— ® 2H2O).
в. образование слабого основания.
NH4+ + Cl— + K+ + OH— ® NH4OH + K+ + Cl—
NH4+ + OH— ® NH4OH.
с. образование слабой кислоты.
2СH3COO— + 2Na+ + 2H+ + SO42- ® 2CH3COOH + 3Na+ + SO42-
CH3COO— + H+ ® CH3COOH.
Ионное произведение воды
Процесс электролитической диссоциации воды протекает в две стадии: 1. образование водородных ионов и гидроксид–ионов:
Н2О <=> Н+ + ОН—
2. гидратация водородного иона с образованием гидроксония–иона:
Н+ + Н2О <=> Н3О+.
Первая стадия этого процесса протекает с поглощением тепла, вторая – с выделением его значительного количества. Поэтому практически все ионы водорода гидратированны и диссоциация воды должна изображаться следующим уравнением:
2Н2О <=> Н3О+ + ОН—.
При 22 оС степень электролитической диссоциации воды равна 1,8·10-9, то есть из 555000000 молекул воды диссоциирует одна. Следовательно, вода – очень слабый электролит, и для описания процесса ее диссоциации применим закон действующих масс:
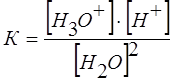 ,
,
где К — константа диссоциации воды.
[Н3О+]·[ОН—] = К·[Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+][ОН—] = Кw.
Постоянная Кw называется ионным произведением воды.
В 1 л воды, массу которой можно принять равной 1000 г, находится 1000 г/18 г = 55,5 моль вещества (ее молярная концентрация).
Следовательно, при 22 °С концентрации ионов гидроксония и гидроксид–ионов равны:
[Н3О+][ОН—] = 55,5·1,8·10-9 = 1,000·10-7 г-ион/л.
Величина Кw возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации: 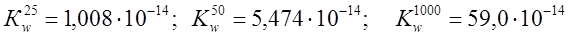 . При комнатной температуре принимают округленное значение ионного произведения воды 10-14.
. При комнатной температуре принимают округленное значение ионного произведения воды 10-14.
Водородный показатель
Водные растворы различных соединений могут давать кислую, щелочную или нейтральную реакцию. Реакция среды зависит от соотношения концентраций ионов гидроксония и гидроксид–ионов в растворе.
Если концентрации этих ионов равны между собой, то есть [Н3О+] = [ОН—], то реакция среды нейтральная. Следовательно, вода принадлежит к типичным амфотерным соединениям, совмещающим кислотные и основные свойства, выраженные в одинаковой степени.
Если концентрация ионов гидроксония больше концентрации гидроксид–ионов, то есть [Н3О+] > [ОН—], то реакция среды становится кислой. Кислотность тем выше, чем больше концентрация ионов гидроксония. Если наоборот, концентрация ионов гидроксония меньше концентрации гидроксид–ионов, то есть [Н3О+] < [ОН—], то реакция среды становится щелочной. Следовательно, по значению концентрации этих ионов можно количественно охарактеризовать реакцию среды.
Кислотность или основность раствора можно выразить, взяв вместо концентрации ионов водорода ее десятичный логарифм. Чтобы избавиться от отрицательной степени в значении концентрации ионов водорода, предложено пользоваться отрицательным значением логарифма величины [Н+], названным водородным показателем или рН:
рН = -lg[Н+];
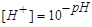
В практике принимается Kw = 10-14 (22 °С), отсюда [Н+] = 10-7 г-ион/л и рН = 7.
Соотношения между реакцией среды, концентрациями ионов и значением водородного показателя получаются следующие:
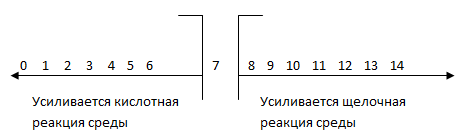
Нейтральная среда [Н3О+] = [ОН—] = 10-7 г-ион/л, рН = 7.
Кислотная среда [Н3О+] > [ОН—] > 10-7 г-ион/л, рН < 7.
Щелочная среда [Н3О+] < [ОН—] < 10-7 г-ион/л, рН > 7.
Это можно представить в виде схемы:
Гидролиз – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита.
Если соль рассматривать как продукт взаимодействия кислоты с основанием, то в зависимости от их силы все соли можно разделить на четыре типа по приведенной схеме.
Таблица: 1
Кислоты | |||
Сильные | Слабые | ||
Основания | Сильные | I: NaCl, KNO3; pH=7 гидролиз не идет | II: Na2CO3, K2S; рH > 7 |
Слабые | III: ZnCl2, Al(NO3)3; pН < 7 | IV: CH3COONH4, Al2S3 | |
Соли первого типа гидролизу не подвергаются, так как при их взаимодействии с водой слабые электролиты не могут быть получены. В системе Н2О ↔ Н+ + ОН— не нарушается равновесие. рН в растворах этих солей будет равно 7.
Рассмотрим гидролиз солей оставшихся трех типов. Соли, образованные многоосновными кислотами или многокислотными основаниями, гидролизируются ступенчато, переходя в первой фазе в кислотные или основные соли.
Гидролиз Na2CO3:
I ступень 2Na+ + CO32- + HOH <=> Na+ + HCO3— + Na+ + OH—
CO32- + HOH <=> HCO3— + OH—;
II ступень Na+ + HCO3— + HOH <=> H2CO3 + Na+ + OH—
HCO3— + HOH <=> H2CO3 + OH—.
При гидролизе Na2CO3 и других солей этого типа в растворе накапливаются ионы OH—, сообщающие ему щелочную реакцию с рН > 7. Более сильно выражена первая ступень гидролиза, чем вторая.
Гидролиз ZnCl2:
I ступень: Zn2+ + 2Cl— + HOH <=> ZnOH+ + Cl— + H+ + Cl—
Zn2+ + HOH <=> ZnOH+ + H+;
II ступень: ZnOH+ + HOH + Cl— <=> Zn(OH)2 + H+ + Cl—
ZnOH+ + HOH <=> Zn(OH)2 + H+.
При гидролизе ZnCl2 и других солей этого типа в растворе накапливаются ионы H+, сообщающие ему кислотную реакцию с рН < 7.
Гидролиз СН3СООNH4:
NH4 + CH3COO— + HOH <=> NH4OH + CH3COOH.
Соли этого типа подвергаются гидролизу относительно легко. Реакция и рН раствора определяется относительной силой образующихся оснований и кислот. В рассматриваемом случае константы электролитической диссоциации NH4OH и CH3COOH при 25 ºС соответственно равны 1,79·10-5 и 1,76·10-5, а поэтому реакция раствора практически нейтральна (рН = 7).
Процесс гидролиза солей количественно может быть охарактеризован с помощью двух величин: степени гидролиза h, константы гидролиза Кгидр.
Степенью гидролиза называется отношение количества молекул соли, подвергшихся гидролизу, к общему количеству молекул соли в растворе.
Очевидно, степень гидролиза h может изменяться в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ h £ 1 в долях единицы
0 £ h £ 100 в %
Константа гидролиза определяет состояние химического равновесия в растворе гидролизированной соли.
Например, для равновесного состояния I ступени гидролиза Na2CO3 и ZnCl2 Кгидр выразится уравнениями:
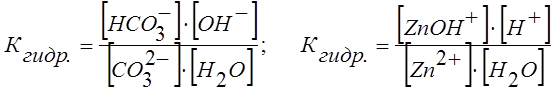 .
.
В общем случае Кгидр изменяется в следующих пределах:
гидролиз полный
отсутствует гидролиз
0 £ Кгидр £ 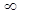 .
.
На состояние равновесия гидролиза сильно влияют различные факторы: главным образом концентрация воды в растворе и температура системы.
Как видно из общего уравнения гидролиза
соль + вода <=> основание + кислота
и уравнения константы гидролиза
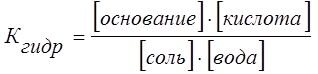
увеличение концентрации воды (или изменение концентрации соли) в растворе в силу постоянства Кгидр смещает равновесие слева направо. Поэтому разбавленные растворы солей гидролизируются полнее и быстрее, чем концентрированные, и степень гидролиза возрастает с разбавлением раствора.
Изменение температуры также резко влияет на состояние гидролитического равновесия: при повышении температуры степень гидролиза увеличивается, что объясняется резким возрастанием ионного произведения воды.
Литература
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 228-260.
2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 121-136.
3. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 52-65.
что это и как их восполнять
Экология жизни. Здоровье: Далеко не всем становится понятно что имеется в виду, когда речь заходит об электролитах. Тем временем, каждый электролит играет конкретную роль в поддержании определённой биологической функции. Давайте же проясним ситуацию.
Далеко не всем становится понятно что имеется в виду, когда речь заходит об электролитах. Тем временем, каждый электролит играет конкретную роль в поддержании определённой биологической функции. Давайте же проясним ситуацию.

Электролиты – минералы, присутствующие в крови и других жидкостях организма, несущие электрический заряд. К ним относятся:
Кальций. Представленный в наибольшем количестве минерал в нашем теле. Кальций влияет на мышечные сокращения, посылает и принимает нервные импульсы, поддерживает регулярный ритм сердца.
Хлор. Содержащийся в соли и многих овощах, хлор отвечает за поддержание здорового баланса жидкостей организма, оказывая большое значение в гидрации организма.
Магний. Способствует функционированию нервной системы, мышечным сокращениям, регулирует использование питательных веществ для производства энергии.
Фосфор. Играет важную роль в производстве АТФ — основного источника топлива для мышц. Фосфор поддерживает нормальную работу почек.
Калий. Основной акцент этот минерал делает на работу гладких мыщц, таких как сердце и пищеварительный тракт.
Натрий. Помогает осуществлять нервные импульсы и стимулирует мышечные сокращения. Кроме того, натрий контролирует кровяное давление.
Как вы могли обратить внимание, существует прочная взаимосвязь между электролитами и мышечными сокращениями\нервными сигналами. Этим объясняется то, почему нам особенно важно восполнять электролиты во время физической активности, ведь мы также теряем их с потом.
Рецепт приготовления домашнего напитка, богатого электролитами:
- 500 мл воды
- 3 ст.л. кленового сиропа
- 1 ч.л. морской соли
- лимонный сок, по вкусу
- лаймовый сок, по вкусу
Лучшим натуральным напитком, полным электролитов, по праву является кокосовая вода. Баланс жидкости и электролитов в ней удивительно схож с тем, что присутствует в нашем организме.
И, наконец…
Бонус-рецепт, в котором также представлено большое количество нужных нам электролитов:
- 1 свекла
- 1 огурец
- 1 яблоко
- 1 дюймовый кусочек имбиря
- щепотка морской соли
Взбиваем в блендере до консистенции сока. Выпиваем и наслаждаемся полезным напитком!опубликовано econet.ru
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! © econet
2 рецепта натурального питьевого электролита
Спортивные напитки на зарубежном и отечественном рынке представлены в широком ассортименте! в данной статье будут рассмотрены несколько рецептов которые можно сделать своими руками!
Питье достаточного объема чистой воды — одна из самых важных вещей, которые мы можем сделать для общего укрепления здоровья. Во время физических упражнений и физических нагрузок, когда пот вызывает потерю минералов, полезен также рецепт домашнего спортивного напитка с натуральным электролитом.
Спортивные напитки польза
Обычная вода не содержит электролитов. Тело теряет много минералов во время тренировки. Полезно добавлять электролиты и минералы для регидратации после интенсивной физической нагрузки или сильного потоотделения. Это не значит, что мы все должны пить электролитные напитки регулярно, но иногда они полезны …
Моя поучительная история …
Этот пост также может быть озаглавлен «как избежать больших больничных расходов во время отпуска». Надеюсь, вы сможете узнать из моей ошибки в этом.
Вот что случилось:
Мы с мужем наконец-то сбежали в долгожданную 10-летнюю поездку (прошло много времени после нашей настоящей годовщины… потому что дети и другие дела нас постоянно отвлекают). Мы часто плавали с маской и трубкой и планировали погружение с аквалангом.
Обычно, если мы собираемся быть на солнце, занимаясь напряженными делами, я делаю этот рецепт и беру его с собой. В этой поездке, так как дети не были с нами, я по глупости забыл некоторые ингредиенты и решил, что просто буду пить достаточно воды. Это работало нормально до одной ночи (после долгого дня подводного плавания), я пил вино на ужин и, вероятно, не хватало воды.
На следующее утро у нас не было никакой воды из-под крана, поэтому я вместо этого взял кофе и решил, что получу немного воды, когда мы дойдем до пляжа.
Сигнал Теплового истощения
Пляж был занят, поэтому им потребовалось несколько часов, чтобы принести нашу воду. В этот момент я заметил, что у меня болит голова. Я начал пить воду, но головная боль усилилась, у меня также начался учащенный пульс, головокружение и тошнота.
Мы вернулись в комнату, и я остыл, увлажнился и отдохнул. Но симптомы продолжали сохраняться, и я чувствовал слабость и головокружение в течение дня. К той ночи я понял, что, несмотря на то, что я пил много воды, у меня все еще были симптомы легкого обезвоживания и теплового истощения.
Мы решили пойти в больницу, чтобы я мог получить жидкости. Вероятно, в следующие несколько дней мне было бы хорошо с отдыхом и регидратацией, но мы приближались к концу нашей поездки, и я не хотел ложиться спать до конца наших каникул.
Международные больницы …
Во многих отношениях интернациональная больница, в которую мы обратились, была гораздо более эффективной, чем те, которые были дома. Мы быстро зарегистрировались, смогли сделать предоплату, и доктор согласился, что у меня тепловое истощение, и заказал капельницу. Он сказал, что, поскольку мои электролиты были истощены от потоотделения, у меня были проблемы с регидратацией только от воды, так как моему организму было нужно столько же минералов, сколько и жидкости. (Жидкость для внутривенного вливания является изотонической, что означает, что она имеет ту же концентрацию минералов, что и кровь.)
Врач решил вставить капельницу в мою руку, поэтому я ожидал, что для этого часто используют обычную иголку для маленьких бабочек. Но он вытащил иглу 12-го калибра (как та, которую они используют, когда ты сдаешь кровь). После самой тяжелой внутривенной вливания (а у меня было много … потому что у детей) было много жидкости, и я сразу начал чувствовать себя лучше.
Таким образом, после нескольких часов сидения в международной больнице, получавших гидратацию с помощью капельниц, я не мог не думать о том, насколько проще, дешевле и менее болезненно было бы, если бы я вспомнил ингредиенты для этого электролитного напитка во время путешествия.
Почему не обычные спортивные напитки с электролитом?


Так почему бы не выпить один из многих напитков с электролитом, доступных в наши дни (Gatorade, Powerade и т. Д.)?
У них не только много сомнительных ингредиентов, но и сделать свой собственный легко, быстро и намного здоровее.
Gatorade Facts Регулярные спортивные напитки содержат такие ингредиенты, как:
Вода, сахарозный сироп, глюкозно-фруктозный сироп, лимонная кислота, натуральный виноградный ароматизатор с другими натуральными ароматизаторами, соль, цитрат натрия, монокалийфосфат, красный 40, синий 1.
Они также обычно имеют фруктоподобный вкус, но на этикетках написано «не содержат фруктов».
Я за регидратацию, но действительно ли нужны монокалийфосфат, мистические «натуральные ароматизаторы» и искусственные красители? По своему опыту я знаю, что эти ингредиенты обычно заставляют меня чувствовать себя ужасно и просто не стоят того.
Теперь, когда для гидратации требуется больше, чем просто вода (игры в софтбол, триатлон, труд и т. Д.), Мы делаем свою собственную версию.
Рецепт натурального спортивного напитка своими руками
Кокосовая вода — одна из самых простых альтернатив спортивных напитков и может использоваться как есть.
По-видимому, кокосовая вода похожа по структуре на жидкость, используемую для внутривенной регидратации. По этой причине ходят слухи, что он использовался во время Тихоокеанской войны в качестве замены электролита IV. Это делает довольно хороший напиток естественного электролита самостоятельно или со всплеском лайма.
Кокосовая вода содержит больше калия, чем спортивные напитки, и больше натуральных источников натрия. Многие спортсмены клянутся этим в эти дни, и я имел это под рукой во время моей последней пары трудов.
Единственным недостатком кокосовой воды является цена. Если вы хотите недорогую (но все же полезную и вкусную) альтернативу, этот рецепт — следующая лучшая вещь.
Натуральный рецепт домашнего самодельного напитка (рецепт 1)
Вы можете сделать этот рецепт различными способами, но отношения являются наиболее важной частью. Основа — любая здоровая жидкость выбора, и некоторые хорошие варианты:
- Травяные чаи
- Кокосовая вода
- Чистая вода
Некоторым людям нравятся эти новые напитки Bai в качестве основы.
Чтобы превратить базовую жидкость в спортивный напиток, добавьте некоторые или все эти ингредиенты:
- Соль — высококачественная соль добавляет натрий и другие минералы
- Кальций или магний — добавление порошка магния кальция высокого качества помогает восполнить минералы
- Сок — по желанию, но при необходимости добавляет сладости и натуральный сахар
- Натуральные ароматизаторы — я не говорю о более приятном звучании названия не очень приятной добавки MSG. Добавьте натуральные ароматизаторы в виде свежего имбиря, свежих трав или даже натуральных ароматизированных экстрактов стевии
Рецепт спортивного напитка на основе электролита: основные ингредиенты (рецепт 2)
Вот основные рецепты и пропорции, которые я использую, но вы можете настроить их по своему вкусу:
Рецепт натурального спортивного электролитного напитка (со вкусом)
Экономьте деньги и избегайте искусственных ингредиентов, создав собственный рецепт натурального спортивного напитка с электролитами. Бесконечные варианты, чтобы сделать аромат, который вы любите!
Время приготовления 5 минут
Общее время 5 минут
Сервировки 4 чашки
Калории 26 ккал
Автор Кэти Уэллс
Ингредиенты
- 1 литр жидкости, такой как травяной чай из зеленого чая, кокосовая вода или обычная вода
- 1/8 -1/4 ч.л. гималайской соли
- 1 ч.л. кальция и магния в порошке
- ¼ чашка или более 100% сок по желанию
- 1-2 подсластителя TBSP, таких как мед или стевия, по желанию. Я предлагаю заварить
- лист стевии в базовую жидкость для наиболее естественного варианта
Инструкция
Заварите чай, если используете, или слегка теплой базовой жидкостью.
Добавить морскую соль и кальций, магний и перемешать.
При использовании добавить сок и подсластитель и хорошо перемешать или взболтать.
Охладить и хранить в холодильнике до готовности к использованию.
Продержится до четырех дней в холодильнике, но я предпочитаю готовить по мере необходимости.
Заметки
Мой обычный рецепт включает в себя 1 литр чая (сваренного с листьями красной малины, люцерны, крапивы и стевии), морскую соль, 1 чайную ложку порошка магния и кальция, и 4 чашки виноградного или яблочного сока. Может сделать половину партии или меньше, если это необходимо.
Питание
Обслуживание: 1 чашка | Калории: 26 ккал | Углеводы: 6,1 г | Натрия: 74 мг | Сахар: 5,8 г
Другая простая альтернатива — просто смешать порошок витамина С с водой и небольшим количеством сока, хотя это может быть немного кислым во время упражнений высокой интенсивности!
Нужны ли нам электролиты?


Рецепт спортивных напитков на основе натурального электролита. Индустрия спортивных напитков огромна! Я часто вижу, как 4-летние играют в футбол, сосут бутылки и пакеты с яркими спортивными напитками. Возникает вопрос: нужны ли нам электролиты каждый раз, когда мы тренируемся?
Существует огромная разница между тем, кто занимается спортом для здоровья, и элитным спортсменом. Спортсмены высокого уровня во время тренировок и соревнований сжигают много жидкости, электролитов и сахара в крови.
Будучи случайными спортсменами или воинами выходного дня, большинство из нас, вероятно, большую часть времени не нуждаются в спортивных напитках.
В идеальном мире мы могли бы получать достаточное количество питательных веществ только за счет диеты и не нуждались бы ни в каких добавках или добавленных напитках, подобных этому.
Вопрос о том, действительно ли нужны электролиты и спортивные напитки, индивидуален. Во многих случаях чистая вода может быть таким же хорошим вариантом. Это, безусловно, лучше, чем неоновые спортивные напитки с кукурузным сиропом с высоким содержанием фруктозы!
Эта статья была с медицинской точки зрения рецензирована доктором Скоттом Соеррисом, доктором медицины, семейным врачом и медицинским директором SteadyMD. Как всегда, это не личный медицинский совет, и мы рекомендуем вам поговорить с врачом.
