Электролиты — это… Что такое Электролиты?
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации[1].
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
- Слабые электролиты
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина «Электролит»
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
относящийся к типу «Электролитический», в котором в качестве одной из обкладок используется электролит. Конденсаторы данного типа, в отличии от других типов, обладают несколькими отличительными особенностями
- при очень маленьких габаритных размерах обладают на несколько порядков большей ёмкостью
- при проектировании электрических схем и при монтаже электролитов необходимо соблюдать полярность подключения, в противном случае они обязательно взрываются (в худшем случае) или просто вздуваются и вытекают (в лучшем)
- работают на существенно низких частотах, в пределах всего лишь нескольких десятков кГц, конденсаторы большинства других типов могут работать на частотах до десятков, сотен, тысяч мГц и выше.
Примечания
- ↑ Степень дисссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ Исключением являются специальные неполярные электролитические конденсаторы, которые представляют из себя два электролитических конденсатора в одном корпусе, включённые последовательно и обязательно встречной друг другу полярностью (плюс к плюсу или минус к минусу)
См. также
Wikimedia Foundation. 2010.
Электролит (химия) — это… Что такое Электролит (химия)?
- Электролит (химия)
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p-, d-, и f-элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина «Электролит»
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
относящийся к типу «Электролитический», в котором в качестве одной из обкладок используется электролит. Конденсаторы данного типа, в отличии от других типов, обладают несколькими отличительными особенностями
- при очень маленьких габаритных размерах обладают на несколько порядков большей ёмкостью
- при проектировании электрических схем и при монтаже электролитов необходимо соблюдать полярность подключения, в противном случае они обязательно взрываются (в худшем случае) или просто вздуваются и вытекают (в лучшем)[2]
- работают на существенно низких частотах, в пределах всего лишь нескольких десятков кГц, конденсаторы большинства других типов могут работать на частотах до десятков, сотен, тысяч мГц и выше.
Примечания
- ↑ Степень дисссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ Исключением являются специальные неполярные электролитические конденсаторы, которые представляют из себя два электролитических конденсатора в одном корпусе, включённые последовательно и обязательно встречной друг другу полярностью (плюс к плюсу или минус к минусу)
См. также
Wikimedia Foundation. 2010.
- Электролиния Экибастуз-Кокчетав
- Электролиты
Смотреть что такое «Электролит (химия)» в других словарях:
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Наводороживание ПТК при катодной поляризации (i=1500 А/м2, электролит: 250±5 г/л K2
Числа переноса катионов в водных растворах при 25 °С — Электролит Эквивалентная концентрация, моль/л 0 0,01 0,02 0,05 0,1 0,2 … Химический справочник
Электрофоретическое поведение ионов CrO42-, Cu(II), Al(III), Fe(III), Cr(III) в 0,5 М растворах сульфатов — Электролит Движение, мм CrO42 Cu(II) Al(III) Fe(III) Cr(III) Na2SO4 … Химический справочник
Электрохимия — Электрохимия раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и… … Википедия
КОЛЛОИДЫ — КОЛЛОИДЫ, КОЛЛОИДНАЯ ХИМИЯ. Коллоиды (от греч. ко 11а клей, желатина), название, данное Грэмом (Graham) группе веществ, типичными представителями которых являются желатина или гум ми арабик. Коллоидная химия является наиболее молодой хим.… … Большая медицинская энциклопедия
Тетрахлороаурат(III) водорода — Общие Т … Википедия
Цезий — 55 Ксенон ← Цезий → Барий … Википедия
Литий — Запрос «Lithium» перенаправляется сюда; см. также другие значения. Эта статья о химическом элементе. О применении в медицине см. Препараты лития. 3 Гелий ← Литий … Википедия
Книги
- Неорганическая химия. Часть I. Поверхностные явления на границе оксид/электролит в кислых средах, Горичев Игорь Георгиевич, Атанасян Т. К., Якушева Е. А.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 483 грн (только Украина)
- Неорганическая химия. Часть I. Поверхностные явления на границе оксид/электролит в кислых средах, Горичев Игорь Георгиевич, Атанасян Т. К., Якушева Е. А.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 377 руб
- Неорганическая химия Часть I Поверхностные явления на границе оксид электролит в кислых средах Учебное пособие, Атанасян Т., Гричев И., Якушева Е.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 262 руб
Электролит, понятие, свойства и виды
Электролит, понятие, свойства и виды.
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролит (определение и понятие)
Электролитическая диссоциация (ионизация)
Виды электролитов: сильные и слабые электролиты
Электролит (определение и понятие):
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролиты – вещества, расплавы или растворы которых проводят электрический ток.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. Таким образом, движение электрического тока в электролитах обусловлено ионной проводимостью.
Электролиты – это проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся растворы солей, оснований и кислот, а также вода. Кроме того, некоторые газы ведут себя как электролиты в условиях высокой температуры или низкого давления. Некоторые кристаллы (например, иодид серебра, диоксид циркония) также являются твердыми электролитами.
Соответственно неэлектролиты – вещества, расплавы и водные растворы которых не проводят электрический ток. К неэлектролитам относятся вещества с неполярной и малополярной ковалентной связью. К неэлектролитам относятся газы (двухатомные газы, благородные газы и др.), твердые вещества и органические вещества (спирты, эфиры, бензол, бензин, сахарозу и пр.).
Способность растворов или расплавов электролитов проводить электрический ток объясняется тем, что молекулы электролитов при растворении в воде или других растворителях (например, этаноле, жидком аммиаке, жидком сернистом ангидриде) либо при расплавлении распадаются на электрически положительно и отрицательно заряженные частицы — ионы. Величина заряда иона численно равна валентности атома или группы атомов, образующих ион.
Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Катионы образуют атомы водорода Н+, металлов: К+, Na+, Са2+, Fe3+ и некоторые группы атомов, например группа аммония NH4+. Анионы образуют атомы и группы атомов, являющиеся кислотными остатками, например Cl—, NO3—, SO42—, CO32—.
Ионы могут состоять из одного атома – тогда они именуются простыми ионами (Na+, Mg2+, Аl3+ и т.д.) или из нескольких атомов – тогда они именуются сложными ионами (NО3—, SO42— , РО43— и т.д.).
Электролитическая диссоциация (ионизация):
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией (или ионизацией). Процесс диссоциации носит обратимый характер. Одновременно с процессами диссоциации в растворах или расплавах электролита протекают и процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между диссоциациями (распадами) и ассоциациями. Это означает, что определенное количество молекул электролита распадается на ионы и такое же количество молекул образуется вновь из ионов. Поэтому в растворах или расплавах электролита всегда диссоциирована определённая доля молекул вещества.
Уравнение диссоциации молекулы электролита (КA) на катион (К+) и анион (А—) в общем виде записывается так:
КА ↔ K+ + A—.
Для конкретных химических соединений уравнение диссоциации выглядит следующим образом:
H ↔ H+ + NO3—,
Ba(OH)2 ↔ Ba2+ + 2OH—,
Na(NO3)2 ↔ Na2+ + 2NO3—.
Число положительных и отрицательных ионов электролита в растворе или расплаве может быть разным, но суммарный заряд катионов всегда равен суммарному заряду анионов, поэтому раствор (или расплав) в целом электрически нейтрален.
Процесс диссоциации электролитов в воде легче всего происходит у соединений с ионной связью (солей, щелочей), которые при растворении образуют гидратированные ионы. Как правило, соединения с ионной связью (соли и щелочи) диссоциируют полностью. Соединения с сильнополярной ковалентной связью диссоциируют частично. При растворении вещества с сильнополярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов.
Гидратированные ионы устойчивы. Они беспорядочно передвигаются в растворе. Однако под действием электрического тока их движение приобретает направленный характер.
Растворы электролитов обладают способностью проводить электрический ток вследствие движения ионов. Если в раствор или расплав электролита опустить электроды и на электроды подать электрический ток, то под действием электрического тока ионы приобретут направленное движение: положительно заряженные ионы (катионы) будут двигаться к катоду (отрицательному электроду), отрицательно заряженные (анионы) – к аноду (положительному электроду). Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. Направленное движение катионов и анионов в растворе или расплаве электролита в противоположных направлениях равносильно электрическому току.
Для измерения количественной характеристики электролитической диссоциации введено понятие степень диссоциации.
Степень диссоциации (α) — это отношение числа молекул, диссоциировавших на ионы (n), к общему числу молекул (N) в растворе электролита.
α = n / N.
Степень диссоциации выражается в долях или процентах.
Степень диссоциации (т.е. полнота диссоциации) электролита зависит от многих факторов: от природы электролита, температуры, концентрации и вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени. Так, диссоциация происходит только в полярном растворителе, в частности, в воде. Соли и щелочи диссоциируются полностью. С увеличением концентрации ионизация электролита идет труднее, и наоборот. Повышение температуры способствует повышению степени диссоциации, и наоборот.
Мерой способности электролитов распадаться на ионы в растворах может служить константа электролитической диссоциации (константа ионизации) (Кд).
Константа диссоциации (Кд) – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Константу диссоциации можно выразить уравнением:
Кд = (K+ ∙ A−) / KA.
где:
KA – концентрация недиссоциированного соединения в растворе;
K+ – концентрация катионов в растворе;
A− – концентрация анионов в растворе.
Константа диссоциации (Кд) показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Виды электролитов: сильные и слабые электролиты, солевые, кислотные и щелочные электролиты и пр.:
Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты.
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты – электролиты, степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF, HNO2, HCO3, HPO4, почти все органические кислоты), основания p-, d- и f-элементов, почти все малорастворимые в воде соли.
Необходимо иметь в виду, что между двумя указанными группами не существует чёткой границы: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, различаются:
– электролиты без ионов Н+ и ОН— (солевые электролиты),
– электролиты с обилием ионов Н+ (кислотные электролиты),
– и электролиты с преобладанием ионов ОН— (щелочные электролиты).
В зависимости от вида растворителя электролиты делятся на водные электролиты и неводные электролиты. Отдельно выделяется особый вид электролитов – полиэлектролиты.
В зависимости от того, какое количество ионов образуется при диссоциации молекул электролита, электролиты подразделяются на:
– симметричные электролиты. Симметричные электролиты – электролиты, при диссоциации молекул которого образуется равное число положительных и отрицательных ионов. Симметричными электролитами являются NaCl – 1,1-валентный электролит, HCl – 1,1-валентный электролит и CaSO4 – 2,2-валентный электролит;
– несимметричные электролиты. Несимметричные электролиты – электролиты при диссоциации молекул которого образуется неравное число положительных и отрицательных ионов. Несимметричным электролитом является, например, H2SO4 – 1,2-валентный электролит.
В зависимости от природы электролита выделяются:
– соли. Соли, как электролиты, диссоциируют в водном растворе с образованием иона металла в качестве катиона и иона кислотного остатка в качестве аниона. Соли диссоциируют полностью.
Например, Na(NO3)2 ↔ Na2+ + 2NO3—.
– кислоты. Кислоты, как электролиты, диссоциируют в водном растворе с образованием иона водорода H+ в качестве катиона и иона кислотного остатка в качестве аниона. Многоосновные кислоты диссоциируют ступенчато. Причем каждая последующая ступень диссоциирует сложнее, т.к. образующиеся ионы кислотных остатков являются более слабыми электролитами.
Например, фосфорная кислота диссоциирует в три ступени, потому, что имеет 3 атома водорода:
H3РО4 ↔ H+ + H2РО4—,
H2РО4— ↔ H+ + HРО42—,
HРО42— ↔ H+ + РО43—.
Общая формула диссоциация для фосфорной кислоты будет выглядеть так:
H3РО4 ↔ H+ + H2РО43—.
– основания. Основания, как электролиты, диссоциируют в водном растворе с образованием гидроксид-иона ОН— в качестве аниона и иона металла в качестве катиона.
Например, NaOH ↔ Na+ + OH—. Основания диссоциируют полностью.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 67
Электролит — это… Что такое Электролит?
Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток. Признаком электролитической проводимости в отличие от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии Э. обыкновенно обладают ничтожно малой электропроводностью. Термин Э. введен в науку Фарадеем. К. Э. до самого последнего времени относили типичные соли, кислоты и щелочи, а также воду. Исследования неводных растворов, а также исследования при очень высоких температурах значительно расширили эту область. И. А. Каблуков, Кади, Карара, П. И. Вальден и др. показали, что не только водные и спиртовые растворы заметно проводят ток, но также растворы в целом ряде других веществ, как, например, в жидком аммиаке, жидком сернистом ангидриде и т. п. Найдено также, что многие вещества и смеси их превосходные изоляторы при обыкновенной температуре, как, например, безводные окислы металлов (окись кальция, магния и др.), при повышении температуры становятся электролитическими проводниками. Известная лампа накаливания Нернста, принцип которой был открыт гениальным Яблочковым, представляет превосходную иллюстрацию этих фактов. Смесь окислов — «тельце для накаливания» в лампе Нернста, не проводящая при обыкновенной темпер., при 700° делается превосходным и притом сохраняющим твердое состояние электролитическим проводником. Можно предположить, что большинство сложных веществ, изучаемых в неорганической химии, при соответствующих растворителях или при достаточно высокой температуре могут приобрести свойства Э., за исключением, конечно, металлов и их сплавов и тех сложных веществ, для которых будет доказана металлическая проводимость. В настоящий момент указания на металлическую проводимость расплавленного йодистого серебра и др. нужно считать еще недостаточно обоснованными. Иное должно сказать о большинстве веществ, содержащих углерод, т. е. изучаемых в органической химии. Вряд ли найдутся растворители, которые сделают углеводороды или их смеси (парафин, керосин, бензин и др.) проводниками тока. Однако и в органической химии мы имеем постепенный переход от типичных Э. к типичным неэлектролитам: начиная с органических кислот к фенолам, содержащим в своем составе нитрогруппу, к фенолам, не содержащим такой группы, к спиртам, водные растворы которых принадлежат к изоляторам при небольших электровозбудительных силах и, наконец, к углеводородам — типичным изоляторам. Для многих органических, а также отчасти и некоторых неорганических соединений, трудно ожидать, чтобы повышение температуры сделало их Э., так как эти вещества раньше разлагаются от действия теплоты.
В таком неопределенном состоянии находился вопрос о том, что такое Э., до тех пор, пока не привлечена для решения его теория электролитической диссоциации (см. соответствующую статью). Относительным числом электролитически диссоциированных молекул к не распавшимся молекулам и определяется, имеем ли мы дело с типичным Э. или с типичным неэлектролитом, или с каким-либо переходным случаем. Если число этих ионов настолько мало, что ни состав их, ни относительное число не поддается никаким измерительным методам, тогда перед нами случай типичного неэлекролита. Переходные случаи — это случаи, лежащие на границе наших измерительных методов, как чисто физических, так и применяемых при химическом анализе.
Интересный вопрос возник в самое последнее время: может ли быть простое тело Э.? П. И. Вальден нашел, что растворы брома в жидком сернистом ангидриде, растворы йода в эфире и треххлористом мышьяке заметно проводят ток. Должно ли признать, что молекула йода J2 распадается на ионы электроположительный катион J. и J’ — электроотрицательный анион. Однако, уже П. И. Вальден указывает на малую вероятность такого явления и предполагает, что бром и йод дают с растворителем определенные химические соединения, которые уже, в свою очередь, распадаются на ионы.
В заключение должно упомянуть об определении Э., данном маститым Гитторфом пятьдесят лет тому назад: «Э. — это соли». Этим определением Гитторф частью предвосхитил современную теорию электролитической диссоциации, указав на то, что типичное свойство солей, которое мы теперь определяем как способность к электролитической диссоциации, должно быть признаком всякого Э. (см. Электролитическая диссоциация).
Вл. Кистяковский.
Электролиты: свойства и классификации
Электролиты – растворы, имеющие в своем составе заряженные частицы, которые принимают участие в переносе зарядов между электродом и катодом. Могут быть сильными и слабыми. Процесс распада молекул на ионы называется электролитической диссоциацией. Неэлектролиты – водные растворы, в которые вещество перешло в виде молекул с сохранением первоначальной структуры. Все молекулы вещества в таких растворах окружены гидратными оболочками (молекулами воды) и не могут переносить электрический заряд.
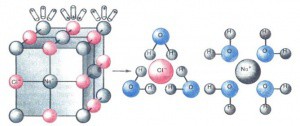
Растворение кристалла поваренной соли
Как протекает электролитическая диссоциация
Вещества-электролиты устроены за счет ионных или ковалентных полярных связей.
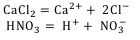
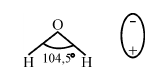
Во время растворения происходит химическое воздействие вещества с молекулами воды, в результате чего оно распадается на электроны. Молекулы воды – активные диполи с двумя полюсами: положительным и отрицательным. Атомы водорода располагаются под углом 104,5°, за счет этого молекула воды приобретает угловую форму.
Вещества, имеющие ионную кристаллическую решетку, намного легче диссоциируют, они уже состоят из активных ионов, а диполи воды во время растворения только ориентируют их. Между диполями воды и ионами электролита возникают усилия взаимного притяжения, связи кристаллической решетки ослабевают и ионы покидают кристалл.

Последовательность процессов при диссоциации растворов с ионной связью
На первом этапе молекулы вещества ориентируются около диполей воды, далее происходит гидратация, а на завершающем этапе диссоциация.
Похожим образом диссоциируют электролиты, у которых молекулы строятся за счет ковалентных связей. Разница только в том, что диполи воды превращают ковалентные связи в ионные. При этом наблюдается такая последовательность процессов:
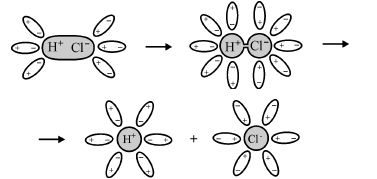
Электролитическая диссоциация полярной молекулы хлороводорода на гидратированные ионы
В растворах происходит хаотическое движение гидратированных ионов, они могут сталкиваться между собой и опять образовывать отдельные связи. Такой процесс называется ассоциацией.
Классификация электролитов
Все электролиты кроме ионов содержат молекулярные структуры, неспособные переносить разряд. Процентное содержание этих элементов оказывает прямое влияние на возможность проводить ток, параметр обозначается α и определяется по формуле:
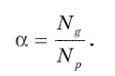
Для вычисления берется отношение количества частиц, распавшихся на ионы к общему числу растворенных частиц. Степень распада определяется опытным путем, если она равняется нулю, то диссоциация полностью отсутствует, если равняется единице, то все вещества в электролите распались на ионы. С учетом химического состава электролиты имеют неодинаковую степень диссоциации, параметр зависит от природы и концентрации раствора, чем ниже концентрация, тем выше диссоциация. Согласно данным определениям все электролиты делятся на две группы.
- Слабые электролиты. Имеют очень незначительную степень диссоциации, химические элементы почти не распадаются на ионы. К таким электролитам относится большинство неорганических и некоторые органические кислоты. Слабые электролиты расщепляются на ионы обратимо, процессы диссоциации и ассоциации по интенсивности могут сравниваться, раствор очень плохо проводит электрический ток.
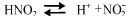
Способность к диссоциации зависит от нескольких факторов, слабые электролиты во многом определяются химическими и физическими особенностями вещества. Важное значение имеет химический состав растворителя.
- Сильные электролиты. Эти растворы в водных растворах интенсивно диссоциируют на ионы, сильные электролиты могут иметь степень диссоциации равную единице. К ним относятся почти весь перечень солей и многие кислоты неорганического происхождения. Сильные электролиты диссоциируют необратимо:

От каких факторов зависит степень диссоциации
- Природа растворителя. Степень диссоциации веществ увеличивается прямо пропорционально полярности. Чем больше полярность, тем выше активность имеют сильные электролиты.
- Температура во время подготовки раствора. Повышение температуры растворителя увеличивает активность ионов и их количество. Правда, при этом есть вероятность одновременного повышения ассимиляции. Процесс растворения веществ в растворителе должен непрерывно контролироваться, при обнаружении отклонений от заданных параметров немедленно вносятся корректировки.
- Концентрация химических веществ. Чем выше концентрация, тем больше вероятность, что после растворения образуются слабые электролиты.
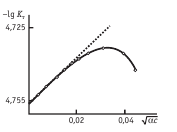
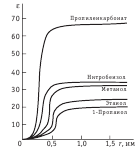
График зависимости константы диссоциации от концентрации
Главные положения теории электролитической диссоциацииСогласно существующей теории, электролитическая диссоциация позволяет растворам проводить электрический ток. В зависимости от этой способности они делятся на электролиты и неэлектролиты. Процесс распада веществ на ионы называется диссоциацией, положительно заряженные двигаются к катоду и называются катионами, негативно заряженные двигаются к аноду и называются анионами. Состав электролитов оказывает влияние на способность к диссоциации, технические нормы позволяют определять эту зависимость количественно.
С учетом получаемых после диссоциации ионов изменяется свойство электролитов. Вне зависимости от химического характера образуемых после диссоциации ионов, электролиты подразделяются на три большие классы:
1.Кислоты. В результате распада образуются анионы кислотного остатка и катионы водорода. Кислоты многоосновные могут преобразовываться по первой степени:
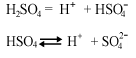
2. Основания. Электролиты, дисоциирующие на анионы гидроксогрупп и катионы металла.
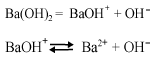
3. Соли. Электролиты диссоциируют на анионы кислотного остатка и катионы металлов. Процесс происходит в одну ступень.
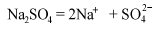
Химические свойства электролитов описываются при помощи химических уравнений и определяются свойствами образованных ионов. Для удаления вредных химических соединений, выделяемых в воздух во время диссоциации, используются химически нейтральные пластиковые воздуховоды.
Перспективы развития теории диссоциацииНа современном этапе развития теории ученые предпринимают попытки описать динамические и термодинамические свойства электролитов учитывая концепцию ионно-молекулярной структуры. Классическая теория считается примитивной, в ней ионы представляются как заряженные жесткие сферы. Главный недостаток традиционной теории – невозможность объяснить локальное снижение диэлектрической проницательности в первом приближении. Ряд растворителей поддается описанию физических свойств ступенчатой зависимостью, но протонные водные растворители имеют намного сложнее процессы релаксации.
Непримитивные модели, рассматривающие ионы в одинаковом масштабе, делятся на две группы:
- Первая. Жидкие фазы рассматриваются как максимально разупорядочные кристаллы, размеры не более пяти молекулярных диаметров.
- Вторая. Жидкости описываются как сильно неидеальные газы. Молекулы растворителя являются точными или обыкновенными диполями.
Зависимость диэлектрической проницаемости от расстояния между ионами
Неравновесные явления в растворах электролитов
Неравновесный распад объясняется несколькими физическими процессами.
- Миграцией и диффузией ионов. Обуславливается сравнительно большим количеством ионных перескоков за единицу времени в сравнении с иными направлениями.
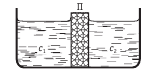
Контакт двух растворов с различными показателями концентрации
- Эквивалентной и удельной электропроводностью. Электропроводность обеспечивается миграцией ионов, замеры выполняются таким способом, чтобы исключалось влияние градиента химического потенциала.
Принципиальная схема моста переменного тока во время измерения электропроводности
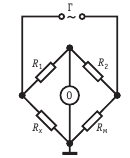
- Числом переноса. Определяется суммой электрической проворности аниона и катиона. Доля тока называется электрическим числом переноса.
Схема определения числа переноса

Перемещение ионов в среде электрического поля по статистике является усредненным процессом, ионы делают беспорядочные перескоки, а элегическое поле оказывает только определенное влияние, точно рассчитать силу и вероятность влияния невозможно. В связи с этим, аналогия диссоциации с обыкновенным поступательным движением твердых тел весьма приближенная, но она позволяет принимать правильные качественные выводы.
ЭЛЕКТРОЛИТЫ — это… Что такое ЭЛЕКТРОЛИТЫ?
в-ва, в к-рых в заметной концентрации присутствуют ионы, обусловливающие прохождение электрич. тока (ионную проводимость). Э. также наз. проводниками второго рода. В узком смысле слова Э.-в-ва, молекулы к-рых в р-ре вследствие электролитической диссоциации распадаются на ионы. Различают электролиты твердые, растворы электролитов и ионные расплавы. Р-ры электролитов часто также наз. Э. В зависимости от вида р-рителя различают Э. водные и электролиты неводные. Особый класс составляют высокомол. Э.- полиэлектролиты.
В соответствии с природой ионов, образующихся при электролитич. диссоциации водных р-ров, выделяют солевые Э. (в них отсутствуют ионы Н + и ОН —), к-ты (преобладают ионы Н +) и основания (преобладают ионы ОН —). Если при диссоциации молекул Э. число катионов совпадает с числом анионов, такие Э. наз. симметричными (1,1 -валентными, напр. КС1, 2,2-валентными, напр. CaSO4, и т. д.). В противном случае Э. наз. несимметричными (1,2-валентные Э., напр. H2SO4, 3,1-валентные, напр. А1(ОН)3, и т. д.).
По способности к электролитич. диссоциации Э. условно разделяют на сильные и слабые. Сильные Э. практически полностью диссоциированы на ионы в разбавленных р-рах. К ним относятся многие неорг. соли, нек-рые к-ты и основания в водных р-рах, а также в р-рителях, обладающих высокой диссоциирующей способностью (напр., в спиртах, амидах, кетонах). Молекулы слабых Э. лишь частично диссоциированы на ионы, к-рые находятся в динамич. равновесии с недиссоциир. молекулами. К слабым Э. относятся многие орг. к-ты и основания в водных и неводных р-рителях. Степень диссоциации зависит от природы р-рителя, концентрации р-ра, т-ры и др. факторов. Один и тот же Э. при одинаковой концентрации, но в разл. р-рителях образует р-ры с разл.
степенью диссоциации.
Электролитич. диссоциация приводит к увеличению общего числа частиц в р-ре, что обусловливает существенное различие между св-вами разбавл. р-ров электролитов и неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления р-ра и его отклонение от закона Вант-Гофа (см. Осмос), понижение давления пара р-рителя над р-ром и его отклонение от Рауля закона, увеличение изменения т-ры кипения и замерзания р-ра относительно чистого р-рителя и др.
Ионы в Э. являются отд. кинетич. единицами и участвуют в хим. р-циях и электрохим. процессах часто независимо от природы др. ионов, присутствующих в р-ре. При прохождении электрич. тока через Э. на погруженных в него электродах происходят окислит.-восстановит. р-ции, в результате чего в своб. виде выделяются в-ва, к-рые становятся компонентами Э. (см. Электролиз).
Э. по своей структуре представляют собой сложные системы, состоящие из ионов, окруженных молекулами р-рителя, недиссоциированных молекул растворенного в-ва, ионных пар и более крупных агрегатов. Св-ва Э. определяются характером ион-ионных и ион-молекулярных взаимод., а также изменением св-в и структуры р-рителя под влиянием растворенных частиц Э. В полярных р-рителях благодаря интенсивному взаимод. ионов с молекулами р-рителя образуются сольватные структуры (см. Сольватация). Роль сольватации с увеличением валентности ионов и уменьшением их кристаллографич. размеров возрастает. Мерой взаимод. ионов с молекулами р-рителя является энергия сольватации.
В зависимости от концентрации Э. выделяют область разбавленных р-ров, к-рые по своей структуре близки к структуре чистого р-рителя, нарушаемой, однако, присутствием и влиянием ионов; переходную область и область концентрир. р-ров. Весьма разбавленные р-ры слабых Э. по своим св-вам близки к идеальным р-рам и достаточно хорошо описываются классич. теорией электролитич. диссоциации. Разбавленные р-ры сильных Э. заметно отклоняются от св-в идеальных р-ров, что обусловлено электростатич. межионным взаимод. Их описание проводится в рамках Дебая-Хюккеля теории, к-рая удовлетворительно объясняет концентрационную зависимость термодинамич. св-в — коэф. активности ионов, осмотич. коэф. и др., а также неравновесных св-в -электропроводности, диффузии, вязкости (см. Электропроводность электролитов). При повышении концентрации р-ров сильных Э. возникает необходимость в учете размера ионов, а также влияния сольватационных эффектов на характер межионного взаимодействия.
В переходной концентрационной области под влиянием ионов происходит существенное изменение структуры р-рителя. При дальнейшем увеличении концентрации Э. почти все молекулы р-рителя связаны с ионами в сольватационные структуры и обнаруживается дефицит р-рителя, а в области концентрированных р-ров структура р-ра все более приближается к структуре соответствующих ионных расплавов или кристаллосольватов. Данные компьютерного моделирования и спектроскопич. исследований, в частности методом рассеяния нейтронов с изотопным замещением, свидетельствуют о значит. степени упорядоченности в концентрированных р-рах Э. и об образовании специфич. для каждой конкретной системы ионных структур. Напр., для водного р-ра NiCl2 характерен комплекс, содержащий ион Ni2+, окруженный 4 молекулами воды и 2 ионами Сl— в октаэдрич. конфигурации. Ионные комплексы связываются между собой посредством связей галоген — водород — кислород и более сложных взаимод., включающих молекулы воды.
В ионных расплавах специфика упорядочения характеризуется структурными факторами 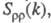
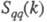 и
и 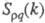 , описывающими флуктуации ионной плотности
, описывающими флуктуации ионной плотности 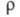 и заряда qкак ф-ции волнового числа k, к-рое с точностью до постоянной Планка hсовпадает с величиной импульса, передоваемого расплаву рассеивающей частицей, напр. нейтроном. Для бинарного электролита
и заряда qкак ф-ции волнового числа k, к-рое с точностью до постоянной Планка hсовпадает с величиной импульса, передоваемого расплаву рассеивающей частицей, напр. нейтроном. Для бинарного электролита
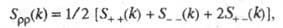
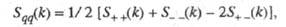
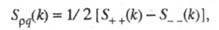
где 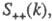
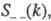
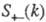 — парциальные структурные факторы, относящиеся к взаимод. катионов и анионов между собой и друг с другом. Для расплавов типа NaCl ф-ция
— парциальные структурные факторы, относящиеся к взаимод. катионов и анионов между собой и друг с другом. Для расплавов типа NaCl ф-ция 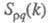 близка к нулю, вследствие чего Э. можно рассматривать как смесь двух жидкостей, одна из к-рых характеризуется упорядочением по ионной плотности через ф-цию
близка к нулю, вследствие чего Э. можно рассматривать как смесь двух жидкостей, одна из к-рых характеризуется упорядочением по ионной плотности через ф-цию 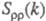 , а вторая -«зарядовым» упорядочением через ф-цию
, а вторая -«зарядовым» упорядочением через ф-цию 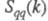 . Ф-ция
. Ф-ция 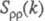 имеет типичное поведение для систем с «плотностным» упорядочением, отражая значит. степень беспорядка в расположении частиц. В отличие от этого
имеет типичное поведение для систем с «плотностным» упорядочением, отражая значит. степень беспорядка в расположении частиц. В отличие от этого 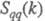 имеет резкий пик, отражающий сильное упорядочение в распределении заряда, определяемое экранированием и требованиями локальной электронейтральности. Такое упорядочение ионов приводит к возможности существования в Э. коллективных возбуждений, к-рые могут проявляться в виде пиков динамич. структурного фактора
имеет резкий пик, отражающий сильное упорядочение в распределении заряда, определяемое экранированием и требованиями локальной электронейтральности. Такое упорядочение ионов приводит к возможности существования в Э. коллективных возбуждений, к-рые могут проявляться в виде пиков динамич. структурного фактора 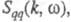 описывающего динамику флуктуации плотности заряда расплава (
описывающего динамику флуктуации плотности заряда расплава (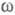 — частота, связанная с энергией, передаваемой расплаву рассеивающей частицей). Для ионных расплавов Э., катионы к-рых склонны к образованию ковалентных связей с анионами (напр., для расплава CuCl), наблюдается сильная корреляция взаимод. между анионами и довольно слабая — между катионами.
— частота, связанная с энергией, передаваемой расплаву рассеивающей частицей). Для ионных расплавов Э., катионы к-рых склонны к образованию ковалентных связей с анионами (напр., для расплава CuCl), наблюдается сильная корреляция взаимод. между анионами и довольно слабая — между катионами.
Переход от одной концентрационной области Э. в другую происходит плавно, вследствие чего рассмотренное выше деление является условным. Тем не менее в промежут. области нек-рые термодинамич. св-ва Э., напр. коэф. р-римости, претерпевают заметные изменения. Описание промежут. и концентрационной областей требует явного рассмотрения как ионов, так и молекул р-рителя и учета разл. видов взаимод. между всеми частицами в р-ре.
В зависимости от т-ры и давления выделяют низкотемепературную и высокотемпературную области св-в Э., а также области нормальных и высоких давлений. Повышение т-ры или давления в целом снижают мол. упорядоченность р-рителя и ослабляет влияние ассоциативных и сольватационных эффектов на св-ва р-ра Э. При понижении т-ры иже т-ры плавления нек-рые концентрир. Э. могут находиться стеклообразном состоянии, напр. водные р-ры LiCl.
Наряду с Э. как проводниками второго рода существуют в-ва, обладающие одновременно электронной и ионной проводимостью. К ним относятся р-ры щелочных и щел.-зем. металлов в полярных р-рителях (аммиак, амины, эфиры), а также в расплавах солей. В этих системах при изменении концентрации металла происходит фазовый переход в металлич. состояние с существенным (на неск. порядков) изменением электропроводности. При этом в электролитич. области образуется самый легкий анион -сольватированный электрон, придающий р-ру характерный синий цвет.
Э. играют важную роль в науке и технике. Они участвуют в электрохим. и многих биол. процессах, являются средой для орг. и неорг. синтеза и электрохим. произ-в. Изучение св-в Э. важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения в-в — экстракции и ионного обмена. Исследование св-в Э. стимулируется энергетич. проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты окружающей среды.
Лит.: Харнед Г., Оуэн Б., Физическая химия растворов электролитов, пер. с англ., М., 1952; Термодинамика и строение растворов. Материалы симпозиума «Химия водных систем при высоких температурах и давлениях», Иваново, 1986; March N.H., Тоsi M. P., Coulomb liquids, L.-[a.o.], 1984; см. также лит. к ст. Растворы электролитов, Электропроводность электролитов, Электролиты неводные, Электролиты твердые.
М. Ф. Головко.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
Твёрдые электролиты — это… Что такое Твёрдые электролиты?
Твёрдые электроли́ты (суперионные проводники) — кристаллические вещества с ионной природой химической связи, имеющие высокую электрическую проводимость, обусловленную движением ионов одного типа.
У суперионных проводников электропроводность при комнатной температуре составляет величину порядка 10-1 Ом-1·см-1, сравнимую с электропроводностью расплавов и концентрированных растворов жидких электролитов. Но, в отличие от металлов, проводимость которых осуществляется за счёт свободных электронов, и жидких электролитов, проводимость которых определяют как анионы, так и катионы, в твёрдых электролитах проводимость обусловлена перемещением ионов одного типа. Твёрдые электролиты сочетают свойства жидкостей (проводимость, характерную для жидкого расплава или раствора, ионную термоэдс) и твёрдых тел (механическую жесткость кристаллов).
Возможность суперионной проводимости во многом зависит от структурных особенностей материала. Большинство твёрдых электролитов — твёрдые растворы на основе ионных кристаллов. В узлах кристаллической решётки ионных кристаллов находятся заряженные ионы, образующие две подрешётки — катионную и анионную, атомы в которых, совершая колебательные движения, перемещаться по кристаллу не могут. Кристаллы со статистическим (неупорядоченным) расположением ионов по узлам решётки обладают особенно высокой ионной проводимостью. Когда количество ионов оказывается меньше количества узлов, то есть имеются вакансии, многие узлы оказываются свободными, что облегчает вероятность перескока иона из одного узла в другой. К кристаллам такого типа относятся AgI, Ag4RbI5, Ag2S, LiI и т. д. Например, в элементарной ячейке AgI на 42 позиции приходятся 2 иона Ag+, причем 12 тетраэдрических позиций являются предпочтительными. Таким образом подрешётка ионов проводимости разупорядочена, в то время как остальные ионы образуют жёсткий каркас, и их перенос возможен по обычным механизмам образования точечных дефектов (вакансий и междоузельных ионов). Ионная составляющая общей проводимости ТВЁРДЫХ ЭЛЕКТРОЛИТОВ, как правило, на 5-6 порядков больше электронной, то есть числа переноса (см. Электропроводность электролитов) ионов проводимости практически равны 1. Коэффиценты диффузии D этих ионов сравнимы с таковыми для концентрированных водных растворов и соответствуют величинам порядка 10-5 — 10-6 см2/с.
ЭЛЕКТРОЛИТЫ ТВЁРДЫЕ относят к супер-ионным проводникам и часто называют супериониками. Однако супер-ионик более общее понятие, относящееся к высокопроводящим соединениям как с ионной проводимостью, так и со смешанной ионно-электронной проводимостью. В электрохимический системах в отличие от ТВЁРДЫХ ЭЛЕКТРОЛИТОВ т.н суперионики со смешанной проводимостью выполняют роль электродов.
Если же в твёрдом электролите искусственно создать разупорядочение кристаллической решётки по одному из типов, например, в основное вещество ввести соединение, в котором анионов меньше, а катионов — столько же, в анионной подрешётке появляются вакансии, которые в отрицательно заряженной решётке можно рассматривать как положительные заряды.
Под действием внешнего напряжения в них начнут переходить анионы с достаточно большой энергией, а вакансии будут перемещаться в противоположном направлении. Возникнет электрический ток, обусловленный движением ионов только одного сорта. Но чтобы ионы могли перемещаться, энергетически близких кристаллографических позиций для размещения потенциально подвижных ионов в элементарной ячейке должно быть больше, чем самих ионов. Ионная проводимость зависит от концентрации вакансий. Но одновременно с ростом концентрации вакансий уменьшается подвижность ионов. В твёрдых растворах оксидов металлов разной валентности ток создается отрицательными ионами (анионами) кислорода. Твёрдые электролиты на основе оксидных металлов относятся к высокотемпературным электролитам. При комнатной температуре твёрдые электролиты на основе оксидных металлов проявляют свойства обычного изолятора. При нагреве подвижность анионов увеличивается очень быстро. Основная рабочая температура твёрдых электролитов на основе оксидных металлов находится в пределах между 700 и 1000°С.
Кроме твёрдых электролитов на основе ионных соединений существуют твёрдые полимерные электролиты — полимеры, в состав молекул которых входят функциональные группы, способные к диссоциации с образованием катионов или анионов, направленное движение которых внутри структуры полимера обусловливает его ионную проводимость.
ЭЛЕКТРОЛИТЫ ТВЁРДЫЕ подразделяются на электролиты с собственным структурным разупорядочением в одной из подрешёток и с примесным. К первым относятся вещества, структура которых либо уже имеет пути проводимости для ионов определённого типа, как, например, Na- -глинозем (полиалюминат натрия Na1+xAl11O17), либо приобретает их вследствие фазового перехода, как, например, AgI (β-α-переход при 420 К). Пути проводимости могут иметь вид каналов [например, в (C5H5NH)Ag5I6], щелей (например, в Na-β-глиноземе) или трехмерных сеток (например, в α-Agl).
К ТВЁРДЫМ ЭЛЕКТРОЛИТАМ с примесным разупорядочением относятся твёрдые растворы замещения, образующиеся в ионных кристаллах при легировании их ионами с валентностью, отличной от валентности основного иона. Возникающий при этом дефицит (или избыток) заряда компенсируется образованием дефектов противоположного знака. Так, в оксидах Zr, Hf, Се и Th, легированных оксидами двух- и трехвалентных металлов (Са, Y, Sc и др.), компенсация заряда примеси осуществляется кислородными вакансиями. Фторид кальция CaF2 и изоморфный ему SrF2 образуют с фторидами трехвалентных РЗЭ твёрдые растворы замещения, обладающие высокой подвижностью ионов F—. Последние легко обмениваются на ионы О2-.
Характерное свойство ТВЁРДЫХ ЭЛЕКТРОЛИТОВ — способность к замещению одних ионов проводимости на другие. Например, при выдерживании Na-β-глинозема в расплаве AgNO3 ионы Na+ может быть полностью замещены ионами Ag+. Если же Ag-β-глинозем поместить в раствор кислоты, то можно получить глинозем с высокой проводимостью по протонам — ионам Н+.
http://www.xumuk.ru/encyklopedia/2/5308.html
