Хром-алмазное композиционное покрытие
Хром-алмазное композиционное покрытие.
Хром-алмазное композиционное покрытие относится к разряду металлоалмазных покрытий. Оно обладает улучшенными характеристиками и свойствами (высокой твердостью, износостойкостью, коррозионной стойкостью, низким коэффициентом трения и пр.), в несколько раз или несколько десятков раз превосходящие свойства простого металлического хромового покрытия.
Характеристика хром-алмазного композиционного покрытия
Свойства и преимущества хром-алмазного композиционного нанопокрытия
Применение хром-алмазного композиционного покрытия
Характеристика хром-алмазного композиционного покрытия:
Хром-алмазное композиционное покрытие относится к разряду металлоалмазных покрытий. Оно обладает улучшенными характеристиками и свойствами (высокой твердостью, износостойкостью, коррозионной стойкостью, низким коэффициентом трения и пр.), в несколько раз или несколько десятков раз превосходящие свойства простого металлического хромового покрытия. Оно содержит в себе диспергированные частицы наноалмазов.
В результате нанесение покрытия повышается износостойкость:
| пресс-форм для холодного прессования металлических порошков | в 10 раз |
| инструмента для холодной вытяжки металлов | в 2,5 раза |
| металлорежущего инструмента | в 1,5-15 раз |
| режущего инструмента по стеклопластикам | в 4-10 раз |
| ножей для резки бумаг | в 4-5 раз |
| надфилей | до 10 раз |
| ножовочных полотен | в 4-6 раз |
| инструмента для остеохирургии, зубных боров | в 8-11 раз |
| фильер, ножей для мясорубок | в 3-6 раз |
| трущихся деталей ткацких станков, прядильных и мотальных машин | в 8-10 раз |
Хром-алмазные покрытия имеют хороший внешний вид – серебристо-серый с синеватым или молочно-матовым оттенком.
Свойства и преимущества хром-алмазного композиционного нанопокрытия:
– повышает поверхностную твердость и износоустойчивость деталей, хорошо выдерживает равномерно распределенную нагрузку,
– износостойкость наноалмазного хромирования по сравнению с твердым хромированием увеличивается в 2 – 5 раз,
– коэффициент трения наноалмазного хромирования по сравнению с твердым хромированием уменьшается на 15-25 %,
– хром-алмазное композиционное нанопокрытие благодаря своей более безпористой структуре имеет более высокую коррозионную стойкость,
– обладает высокой химической стойкостью в атмосфере сернистых соединений, в растворах органических и неорганических кислот, в условиях тропического климата,
– отличается термостойкостью и склонностью к пассивированию на воздухе,
– в два и более раза повышается ресурс работы деталей и узлов, работающих в условиям абразивного и коррозионного износа,
– у всего режущего инструмента наблюдается существенное снижение усилия резания, уменьшения налипания материала на режущие поверхности.
– наблюдается повышение долговечности деталей машин и механизмов, ресурса работы инструмента, экономия быстрорежущих сталей и твердых сплавов, электроэнергии и трудовых ресурсов.
Применение хром-алмазного композиционного покрытия:
Покрытия на основе хрома и наноалмазов используются для упрочнения режущего, прессового, штампового, бурового, медицинского и другого инструмента, деталей машин и механизмов, различной технологической оснастки.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 100
Черный хром | Нанесение защитных покрытий
Черное хромирование нашло применение в приборостроении для защитно-декоративной отделки деталей, которые наряду с коррозионной стойкостью должны иметь поверхность, обладающую низким коэффициентом отражения света, например в различных оптических системах. Черные хромовые покрытия можно наносить на поверхность различных металлов.
Покрытия черным хромом по сравнению с другими покрытиями черного цвета — черным никелем, оксидными или фосфатными пленками — отличаются хорошей защитной способностью, обеспечиваемой подслоем молочного или блестящего хрома, хорошей теплостойкостью и стойкостью в вакууме, а также относительно высокой износостойкостью, примерно в три-пять раз превосходящей износостойкость черного никеля, однако для работы на трение покрытие черным хромом непригодно. Для покрытия черным хромом применяются несколько электролитов.
Раствор №1. Состав, г/л: хромовый ангидрид — 300-350; уксуснокислый барий — 5-7; азотнокислый натрий — 7-10; борная кислота — 12-15. Режим работы: плотность тока ik=40-80 А/дм2; t=30…40°С; скорость наращивания хрома — 6-8 мкм/ч.
Раствор № 2. Состав, г/л: хромовый ангидрид — 250-280; криолит — 0,2-0,3; железо щавелевокислое (окисное) — 50-60. Режим работы:ik=8…15 А/дм2, t=15…20°С, время хромирования — 15-30 мин, толчок тока 30-50 А/дм2 в течение 1-2 мин
Раствор № 3. Состав, г/л: хромовый ангидрид — 280-300; аммоний фтористый — 0,2-0,3. Режим работы: (ik = 50… 100 А/дм2. t = 18…25°С, продолжительность хромирования — 2 мин.
В электролитах не допускается наличие серной кислоты Новый электролит прорабатывается током из расчета 10- 20 А×ч/л. Электролиты устойчивы в работе и обеспечивают получение равномерного черного цвета при широком диапазоне плотностей тока. Толщина слоя черного хрома обычно 1,5-2,0 мкм. Для надежности защиты от коррозии применяется подслой молочного хрома толщиной 10-15 мкм.
Подготовка изделий к хромированию обычная для декоративных покрытий. После нанесения черного хрома изделия промывают водой, сушат и подвергают термообработке в масле при температуре 110-120°С в течение 30-60 мин.
Покрытие черным хромом производятся также из электролита с добавкой ДХТИ-50.
Существенное влияние на отражательную способность черного хромового покрытия оказывает шероховатость поверхности основного металла. Коэффициент отражения на полированной поверхности достигает 10%, в то время, как на пескоструйной поверхности он снижается до 1-4 %
Покрытие черным хромом с успехом применено для защитно-декоративной отделки стволов охотничьих ружей. Атмосферные коррозионные испытания, проведенные в районе Батуми, показали, что при ранее применявшемся оксидировании с использованием «ржавого лака» уже после 24 ч испытаний появились первые признаки коррозии, а образцы, покрытые черным хромом, не изменились после испытаний в течение месяца. Тамбовский завод гальванического оборудования наготовил автоматическую линию для черного хромирования стволов охотничьих ружей с источником тока ВАКГ-6/12 3200/1600
Для расширения диапазона декоративных свойств хромовых покрытий предложен электролит, позволяющий наносить синие хромовые покрытия Электролит имеет следующий состав, г/л: хромовый ангидрид — 250-400; кремнефтористый калий — 15-20; едкий натр — 15-20; тетраборнокислый натрий- 15-20; сахар — 1-3.
Похожие материалы
Хром — Википедия
| Хром | |
|---|---|
| ← Ванадий | Марганец → | |
| Твёрдый металл голубовато-белого цвета | |
 | |
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3[2] Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Хром — элемент 6-й группы (по устаревшей классификации — побочной подгруппы 6-й группы) 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам.
Происхождение названия[править | править код]
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История[править | править код]
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл ( Воклен получил карбид хрома). Он прокалил зелёный оксид Cr2O3 с углём и выделил тугоплавкий металл (с примесью карбидов). Сам оксид Cr2O3 Воклен получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4.
Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах ХХ в.
Хром является довольно распространённым элементом в земной коре (0,03 % по массе)[3]. Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения[править | править код]
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[4], Бразилии, на Филиппинах[5].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире)[5].
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2+4C→Fe+2Cr+4CO{\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2{\displaystyle {\mathsf {4Fe(CrO_{2})_{2}+8Na_{2}CO_{3}+7O_{2}\rightarrow 8Na_{2}CrO_{4}+2Fe_{2}O_{3}+8CO_{2}}}}
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr2O7+2C→Cr2O3+Na2CO3+CO{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+2C\rightarrow Cr_{2}O_{3}+Na_{2}CO_{3}+CO}}}
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+2Al→Al2O3+2Cr+130kcal{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr+130kcal}}}
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72−+14H++12e−→2Cr+7h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+14H^{+}+12e^{-}\rightarrow 2Cr+7H_{2}O}}}
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 8.5[6], один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы[править | править код]
Известны изотопы хрома с массовыми числами от 42 до 67 (количество протонов 24, нейтронов от 18 до 43) и 2 ядерных изомера.
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83.789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Среди искусственных изотопов самый долгоживущий 51Cr (период полураспада 27 суток). Период полураспада остальных не превышает одних суток.
Характерные степени окисления[править | править код]
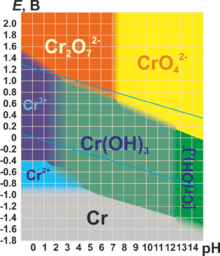
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены[7].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество[править | править код]
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)[править | править код]
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- 2Cr3+→Zn,HCl[H]2Cr2+{\displaystyle {\mathsf {2Cr^{3+}{\xrightarrow[{Zn,HCl}]{[H]}}2Cr^{2+}}}}
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[8]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)[править | править код]
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3++3Nh4+3h3O→Cr(OH)3↓+3Nh5+{\displaystyle {\mathsf {Cr^{3+}+3NH_{3}+3H_{2}O\rightarrow Cr(OH)_{3}\downarrow +3NH_{4}^{+}}}}
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3++3OH−→Cr(OH)3↓{\displaystyle {\mathsf {Cr^{3+}+3OH^{-}\rightarrow Cr(OH)_{3}\downarrow }}}
- Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3+2NaOH→2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH\rightarrow 2NaCrO_{2}+H_{2}O}}}
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6]+3h3O2→2Na2CrO4+2NaOH+8h3O{\displaystyle {\mathsf {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O}}}
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O{\displaystyle {\mathsf {2Cr_{2}O_{3}+8NaOH+3O_{2}\rightarrow 4Na_{2}CrO_{4}+4H_{2}O}}}
Соединения хрома (+4)[править | править код]
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)[править | править код]
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42−+2H+→Cr2O72−+h3O{\displaystyle {\mathsf {2CrO_{4}^{2-}+2H^{+}\rightarrow Cr_{2}O_{7}^{2-}+H_{2}O}}}
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72−+2OH−→2CrO42−+h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+2OH^{-}\rightarrow 2CrO_{4}^{2-}+H_{2}O}}}
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- h3CrnO3n+1→h3O+nCrO3{\displaystyle {\mathsf {H_{2}Cr_{n}O_{3n+1}\rightarrow H_{2}O+nCrO_{3}}}}
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2++CrO42−→BaCrO4↓{\displaystyle {\mathsf {Ba^{2+}+CrO_{4}^{2-}\rightarrow BaCrO_{4}\downarrow }}}
- 2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7+14HCl→2CrCl3+2KCl
Хромирование — Санкт-Петербург — Гальваника, вакуумное хромирование.
Хромирование применяется для деталей автомобилей, мотоциклов, велосипедов, станков, сантехники, медтехники и всякого рода приборов.
Так же широко распространено хромирование пластика, стекла, керамики, а именно:
- сувенирная продукция
- POS-материалы
- парфюмерия (колпачки, крышки, тара)
- алкогольная продукция (пробки, стеклянные бутылки)
- вывески (логотипы)
- мебельная фурнитура
Группа компаний «Хром-Пром» предлагает
Гальваническое хромирование и Вакуумное хромирование.


В чем разница и где лучше всего применять тот или другой вид хромирования?
Гальваническое хромирование – идеальный вариант, если материал изделия — металл, а к покрытию заявлены высокие требования. В результате электролитического процесса на выходе получается зеркальная блестящая ровная поверхность. Такое хромирование характеризуется высокими антикоррозийными качествами, электропроводностью, твердостью и износостойкостью, выдерживает высокие температуры.

Чаще всего данный вид хромирования применяется в сфере промышленности и восстановлении хрома ретро автомобилей. Мы работаем по технологии: медь-никель-хром, которая применялась в СССР для получения максимального качества и долговечности. На нашем предприятии установлены автоматические гальванические линии, это дает максимальную производительность и возможность выполнять миллионные тиражи.
Вакуумное хромирование или вакуумная металлизация – используется в первую очередь как декоративный тип хромирования. Область применения чаще всего сувенирная продукция, рекламная (промо-стенды, вывески, подарочная упаковка), тара ПЭТ, стеклотара, мебельная фурнитура, элементы интерьера и сантехники.
Вакуумное напыление происходит в специальных вакуумных камерах — под воздействием электромагнитного поля напыляется тонкий слой различных металлов. После металлизации деталь покрывается защитным слоем лака.

Преимущества вакуумного хромирования — его низкая цена и визуальная идентичность гальваническому хрому. Но не стоит забывать, что оно декоративное и идеально там, где к изделию не применяются высокие требования к износостойкости.
Для защиты от коррозии стальных трущихся деталей хромирование с подслоем непригодно из-за низких механических свойств многослойного покрытия. В этом случае возможно применение беспористых хромовых покрытий достаточной толщины, наносимых непосредственно на сталь без подслоя меди и никеля. Беспористость покрытия достигается применением режима молочного хромирования, полировкой детали перед и после хромирования и пропиткой хромового покрытия уплотняющими составами с пассивирующими или гидрофобными свойствами. Хорошими защитными свойствами обладает молочный хром толщиной 20 мкм, осажденный из универсального электролита при температуре 70°С и плотности тока 30 А/дм2. По имеющимся данным, такое покрытие показало удовлетворительную защиту некоторых деталей паровых турбин, валиков водяного насоса автомобильного двигателя, медицинских инструментов. Молочный хром не имеет структурной пористости, однако нельзя исключить возможность образования в нем пор по причинам, не зависящим от структуры. Такими причинами могут быть неметаллические включения в основном металле, выходящие на хромируемую поверхность, неудаленные остатки загрязнений на этой поверхности, оседание инородных частиц из электролита и др. Поэтому для деталей, эксплуатирующихся в агрессивных условиях, например в морской атмосфере, целесообразно увеличить толщину покрытия до 40—50 мкм и полировать поверхность детали до и после хромирования. Для повышения износостойкости молочного хромового покрытия предлагается перекрывать его блестящим хромом толщиной 20— 50 мкм .[20]. С этой целью хромирование осуществляется последовательно в двух ваннах со стандартным электролитом. Первым осаждается слой молочного хрома толщиной 20 мкм при температуре 70°С и катодной плотности тока 30 А/дм2. Затем деталь (не промывая) переносят в ванну с более низкой температурой электролита и наносят слой блестящего хрома при температуре 50°С и катодной плотности тока 50 А/дм2. Необходимо указать, что все однослойные хромовые защитные покрытия должны наноситься по возможности равномерно и, но всяком случае контроль их толщины следует производить магнитным толщиномером в углублениях рельефа хромированной поверхности и в других местах, где толщина покрытия минимальна. В этих местах толщина хрома должна соответствовать заданному значению. Высокая стойкость хрома при нагреве позволяет использовать хромирование для защиты от окисления полированных деталей, которые необходимо термически обработать при высокой температуре. Молочный хром толщиной 8—10 мкм обеспечивает такую защиту при закалке деталей. После термообработки хром снимается анодным растворением в растворе щелочи, не содержащем хлоридов. Такое же покрытие применяется для защиты стальных деталей от цементации и нитроцементации вместо гораздо более трудоемкого и длительного омеднения. Примером эффективности хромирования для защиты от окисления является хромирование стальных кожухов для термопар, устанавливаемых в нагревательных печах. Покрытие слоем хрома толщиной 30—40 мкм повысило срок службы кожухов в три — пять раз. Пропитка хрома. Устранение структурной или случайной пористости хромовых покрытий путем заполнения пор уплотняющими составами является эффективным методом повышения защитной способности однослойного хромового покрытия достаточной толщины. Уже первые попытки пропитки хромового покрытия льняным маслом при температуре 120°С дали значительное увеличение защитной способности блестящих хромовых покрытий. Исследования пропитки блестящего хромового покрытия (толщиной от 10 до 40 мкм) пассивирующими растворами на основе нитратов, хроматов и фосфатов полимеризующимися материалами (льняным маслом и клеем БФ-2), смазками АМС-3 показали, что наиболее эффективна пропитка льняным маслом, клеем БФ-2 и смазкой АМС-3. Как видно из табл., эти пропиточные материалы существенно повысили защитную способность хромовых покрытий при толщине последних 40—50 мкм. Дальнейшие исследования, направленные на заменульняного масла, показали также хорошую эффективность ннгибированной смазки К-17. Таблица. Результаты коррозионных испытаний стальных хромированных образцов с пропиткой пор различными наполнителями
В работе показано, что значительное повышение защитной способности хрома достигается при пропитке покрытия гидрофобной кремнийорганической жидкостью ГФЖ.136-94. На образцах с комбинированным покрытием Хмол25Хтв100, пропитанных этой жидкостью, после двухлетних испытаний в очень жестких условиях коррозии не было, в то время как на образцах, не пропитанных жидкостью ГФЖ136-94, коррозионные разрушения были на 2—2,5 % поверхности. Основным требованием технологии пропитки является полное удаление влаги из пор. Это достигается наилучшим образом при погружении деталей в пропитывающую жидкость, нагретую до 110— 120°С. Такой нагрев помимо удаления влаги обычно снижает вязкость жидкости, облегчая заполнение ею пор. Можно также непосредственно перед пропиткой нагревать деталь до указанной температуры. Повышение защитной способности хромовых покрытий достигается также путем фосфатирования хромированных деталей с последующей пропиткой в 3—5 %-ной бензиновом растворе жидкости ГФЖ136-94. После пропитки и сушки детали прогревают при 110— 130°С в течение 45—60 мин. В области защиты от коррозии перспективным направлением является применение сплавов хрома [9]. В этом направлении представляет интерес сплав хрома с молибденом, исследованный М. А. Шлугером с сотрудниками. При содержании молибдена в сплаве 1,4 % слой сплава толщиной 0,5—0,6 мкм после испытаний в гидростате в течение 168 ч, имел на поверхности образцов одну точку коррозии, а покрытие чистым хромом такой же толщины имело 140 точек. Испытания в течение 10 сут в 3 %-ном растворе хлористого натрия также выявили значительные преимущества сплава: на образцах, покрытых хромом, коррозии подверглось 62 % поверхности, в то время, как на сплаве были только 2 точки. Ориентировочная рекомендация условии эксплуатации для разных хромовых покрытий приведена в табл., которая составлена по ГОСТ 14623—69, где не указаны условия хромирования, обеспечивающие необходимую защитную способность покрытия. Представляется, что использование современных методов повышения стойкости покрытий (увеличения толщины, пропитки, полирование до и после хромирования, микротрещиноватый хром, специальные подслои никеля) позволит расширить области применения хромовых покрытий по сравнению с приведенными в таблице. Таблица. Условии эксплуатации стальных хромированных деталей.
| ||||
