Батарейки: солевая VS щелочная (алкалиновая)
Есть много вещей, без которых сложно представить современный мир, и одна из них – батарейки. Они используются в огромном количестве электронных устройств: в часах, фонарике, детской игрушке, фотоаппарате, пульте дистанционного управления, компьютерной мыши, и много где еще и, практически каждый человек время от времени сталкивается с необходимостью их приобретения и замены.
Но что мы о них знаем? Все знают, что есть батарейки пальчиковые и мизинчиковые. Еще бывают «для часов». Однако этой информации недостаточно для правильного выбора.
С размерами батареек все более или менее понятно. Вы просто не поставите в прибор неподходящую батарейку! А что вы знаете о типах батареек? Эти знания просто необходимы для правильного выбора элемента питания!
Существуют основных 4 типа батареек: солевые, щелочные или алкалиновые, литиевые и ртутные. Чаще всего мы делаем выбор между солевыми и щелочными батарейками, так как они представлены в одних формах, например пальчиковый или мизинчиковые. Поэтому поговорим именно о них.
Поэтому поговорим именно о них.
Главным достоинством солевых батареек, выделяющим их среди всех остальных видов источников питания, является их дешевизна.
Но не спешите покупать их для фотоаппарата! Эти батарейки предназначены для устройств с низким энергопотреблением, таких как пульты дистанционного управления, в том числе детскими игрушками, часы, электронные термометры. Их малое потребление можно узнать из того, что они способны работать без замены батарейки многие месяцы. Покупать щелочные батарейки для таких устройств бессмысленно – вы заплатите гораздо больше денег, а прибавка во времени работы если и будет, то небольшая.
Поэтому если Вам нужна батарейка в подобный прибор, смело делайте выбор в пользу солевых батареек.
Щелочные батарейки нужно использовать в тех приборах, которым требуется высокий ток: фонарь, фотоаппарат, машинка на радиоуправлении, электробритва и т.п. Узнать такое устройство можно по наличию моторчика или яркой лампы.
От некоторых солевых батареек такие устройства могут и вовсе не заработать, ведь им нужен большой ток, который солевые батарейки выдать не могут в силу своей природы.
Тип батарейки вы узнаете по маркировке на ней.
Маркировка | Тип батарейки |
R | Солевая |
LR | Щелочная |
Солевые и щелочные батарейки в чем разница
Устройства, работающие на батарейках имеются сейчас практически у каждого, рано или поздно они садятся и нам приходится либо покупать их, либо пытаться перезарядить.
В магазинах можно встретить очень дешёвые соляные батарейки и значительно более дорогие алкалиновые. В чём причина разницы в цене? Чем различаются эти два вида компактных источников тока. Что лучше покупать солевые батарейки или алкалиновые? Ответы на эти вопросы вы найдёте в данной статье.
Солевые батарейки маркируются, как “R”, в частности, солевая пальчиковая, как R6.
У алкалиновых батареек на маркировке имеется буква “L”, например LR6 обозначает алкалиновую пальчиковую батарейку. На корпусе у щелочных имеется надпись «Alkaline». Последнее слово и переводится с английского, как «щёлочь».
Никелированный корпус щелочной батарейки служит токоотводом положительно заряженного электрода.
Алкалиновые батарейки сохраняют свою пригодность для использования в среднем 3-5 лет, соляные – не больше двух.
Устройствами на щелочных батарейках без проблем можно пользоваться на морозе, работоспособность соляных при отрицательных температурах стремится к нулю.
По удельной ёмкости соляные батарейки уступают щелочным в несколько раз, при малоточной нагрузке, в 4-10 раз.
Соляные батарейки могут использоваться только для приборов с малым электропотреблением, например, в настенных часах, или пульте ДУ.
В фотоаппаратах, офисной технике, дистанционно управляемых детских игрушках и других устройствах с аналогичной мощностью, соляные источники тока использовать не получится, точнее можно, но прослужат они в раз 10 меньше, чем алкалиновые.
Щелочные батарейки допускают перезарядку, по крайней мере, не взрываются вовремя её проведения и работают после такой процедуры значительный срок. Попытки перезарядить солевые батарейки, категорически запрещены, т. к. последние при этом взрываются.
Если солевые батарейки такие плохие, то зачем их выпускают?
Всё упирается в простоту производства, его низкую себестоимость и, как следствие, цену. Ну, и ещё в стремление граждан сэкономить даже копейки. Как говорилось выше, для настенных часов и других устройств с малым электропотреблением солевые батарейки вполне подходят, при этом стоить будут в разы дешевле алкалиновых.
Если вы ещё окончательно не решили, что для вас лучше: солевые батарейки или алкалиновые, надеюсь видео поможет.
Сегодня батарейки это такой же продукт первой необходимости, как и зубная паста или салфетки, без них не будет работать пульт, ночник, фонарик, калькулятор, часы и многое другое.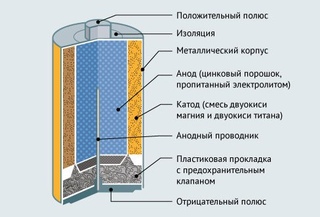 Если вы сейчас сядете и посчитаете, сколько же приборов питается от этих маленьких элементов, то возможно удивитесь, практически половине устройств необходимо покупать батарейки. Как часто придется менять, зависит от грамотного подхода к выбору батареек. Почему элементы питания одной фирмы работают месяц, а другой пол года? Дело даже не в цене. Как правило, в магазине покупатель первым делом смотрит на форму и размер, может еще и на производителя. Лишь единицы подбирают батарейки по химическому составу, напряжению, емкости, проверяют сроки годности.
Если вы сейчас сядете и посчитаете, сколько же приборов питается от этих маленьких элементов, то возможно удивитесь, практически половине устройств необходимо покупать батарейки. Как часто придется менять, зависит от грамотного подхода к выбору батареек. Почему элементы питания одной фирмы работают месяц, а другой пол года? Дело даже не в цене. Как правило, в магазине покупатель первым делом смотрит на форму и размер, может еще и на производителя. Лишь единицы подбирают батарейки по химическому составу, напряжению, емкости, проверяют сроки годности.
– Щелочные (алкалайновые) батарейки. Универсальные как по цене, так и по сроку службы батарейки, занимающие большую долю рынка . В качестве электролита используется гидроксид калия, от чего у батареек такое название. Щелочные батарейки хранятся до пяти лет, имеют большую емкость, чем предшественники. У данного вида снижены риски протечки, долгая работоспособность при низких температурах и минимальная скорость саморазряда. Маркируются щелочные элементы питания надписью ALKALINE, что в переводе с английского значит щелочные. Рекомендуются для использования в приборах с умеренной нагрузкой, таких как: детские игрушки, ночники, радио, пульты ДУ и т.п.
Маркируются щелочные элементы питания надписью ALKALINE, что в переводе с английского значит щелочные. Рекомендуются для использования в приборах с умеренной нагрузкой, таких как: детские игрушки, ночники, радио, пульты ДУ и т.п.
– Литиевые батарейки. Появились сравнительно недавно, находятся выше по ценовой категории. С развитием всевозможных гаджетов и портативных устройств начал расти спрос на элементы питания, выдерживающие интенсивное потребление тока в длительный промежуток времени. Литиевые батарейки отвечают всем требованиям потребителя: долгий срок хранения и службы, устойчивость к температурам (высоким и низким), легкие по весу, не протекают. Следует отметить, литиевые батарейки обладают постоянным напряжением и высокой энергоплотностью, которую не обеспечит ни один предшественник. Подходят для оборудования с высоким энергопотреблением: фонари, вспышки, фотоаппараты, портативные колонки. Маркируются надписью на корпусе «Lithium».
Довольно редко встречаются ртутные и серебряные элементы питания, хотя по своим свойствам они схожи и мало чем уступают литиевым.
Недостатками ртутных элементов питания считается небезопасность использования при повреждении целостности конструкции, сложности с утилизацией.
ААА (мизинчиковые или R03/LR03) – цилиндрические батарейки, тоньше элементов АА, но могут применяться в тех же приборах.
С (R14/LR14) и D (R20/LR20) – похожие по форме и размеру элементы, по сравнению с АА и ААА очень громоздкие и тяжелые. Сегодня производители редко прибегают к установке данных элементов питания, так как размеры гаджетов становятся все меньше и компактнее, батарейки соответственно тоже.
Крона (6F22 / 6LR61) – данный элемент питания отличается от предыдущих размерами, формой и самым высоким напряжением 9V. Контакты батарейки находятся с одной стороны. Применяется в современных приборах крайне редко.
Важные особенности– Саморазряд. Это потеря емкости батареи за период хранения, поэтому у каждого элемента питания есть срок годности. За время хранения (без использования) батарейки емкость может сократиться до 30%, так же многое зависит от температуры хранения. Происходит это из-за медленного протекания химических процессов внутри батарейки, т.е. процесс протекает все время, просто в рабочем режиме химические реакции проходят быстрее, а в состояние покоя медленнее. Когда покупаете батарейки, обязательно смотрите на дату производства, чем она свежее, тем больше емкость соответствует заявленной.
За время хранения (без использования) батарейки емкость может сократиться до 30%, так же многое зависит от температуры хранения. Происходит это из-за медленного протекания химических процессов внутри батарейки, т.е. процесс протекает все время, просто в рабочем режиме химические реакции проходят быстрее, а в состояние покоя медленнее. Когда покупаете батарейки, обязательно смотрите на дату производства, чем она свежее, тем больше емкость соответствует заявленной.
– Напряжение. В зависимости от вида и типа батарейки варьируется напряжение, которое она обеспечивает. Стандартное напряжение бюджетных элементов питания 1,5V, литиевые батарейки обеспечивают напряжение в 3V. Самым мощным элементом питания следует считать Крону, напряжение составляет 9V.
– Емкость. Показатель, определяющий количество «электричества» с батарейке, срок службы элемента питания напрямую зависит от емкости. Как рассчитать время выработки батарейки?
Для расчета важно знать два параметра: заряд и потребляемый ток. Допустим заряд батарейки 3 Ач и установлена она в устройство с потреблением тока 250 мАч (0,25Ач), рассчитываем сколько часов проработает батарейка: 3 Ач / 0,25 Ач = 12 часов.
Допустим заряд батарейки 3 Ач и установлена она в устройство с потреблением тока 250 мАч (0,25Ач), рассчитываем сколько часов проработает батарейка: 3 Ач / 0,25 Ач = 12 часов.
Фактический срок службы может не совпадать с рассчетным по ряду причин:
• Температура внешней среды
• Саморазряд
• Режимы использования
• Ток отсечки
Важно: просто выбросить отработанную батарейку в мусорное ведро не правильно!
На упаковке или корпусе всегда присутствует обозначение -не выбрасывать вместе с бытовым мусором. Если в вашем городе есть пункт приема, то не поленитесь сделать мир чуточку чище.
- Какая разница между солевыми и алкалиновыми батарейками
- Как выбрать соляную лампу
- Что такое бертолетовая соль
Солевые батарейки старше алкалиновых
Первую батарейку изобрел итальянский физик Алессандро Волта в 1800 году, и она была солевой. Его открытие заключалось в том, что он соединил металлические диски из цинка и серебра и намоченный солевым раствором картон. С тех пор ученые усовершенствовали дизайн и состав батареек.
С тех пор ученые усовершенствовали дизайн и состав батареек.
В 1820 году британский ученый Джон Даниэль разработал батарейки, в которых в качестве электролита можно было использовать сульфат цинка и меди. Мощность таких устройств составляла 1,1 вольт, и их могло хватить на 100 лет при использовании в дверных звонках, телефонах и других приборах.
Алкалиновые батарейки были впервые разработаны в конце 19 – начале 20 века учеными Томасом Эдисоном и Вольдемаром Юнгнером. Широкой публике они были представлены только в 1960 году. Первые продаваемые алкалиновые батарейки содержали небольшое количество ртути. В современных ее количество сокращено до минимума.
Как работают батарейки
Чтобы понять, в чем разница между алкалиновыми и солевыми батарейками, следует обратиться к общему принципу работы этих устройств. Когда к батарейке подключается прибор, происходит реакция, в результате которой появляется электрическая энергия. Такую реакцию называют электрохимической.
Внутри батарейки движутся электроны, создавая электрический ток, от которого и питаются приборы. Анод и катод разделены электролитом, то есть изолятором. Электроны собираются вокруг анода, отрицательно заряженного конца батарейки. Они перемещаются к катоду, когда два противоположных конца батарейки соединяет провод снаружи. Как только прибор отключают, соединение пропадает, а вместе с ним и электрический ток. Анод в батарейках – это цинк, а катод – диоксид магния.
Анод и катод разделены электролитом, то есть изолятором. Электроны собираются вокруг анода, отрицательно заряженного конца батарейки. Они перемещаются к катоду, когда два противоположных конца батарейки соединяет провод снаружи. Как только прибор отключают, соединение пропадает, а вместе с ним и электрический ток. Анод в батарейках – это цинк, а катод – диоксид магния.
Разница в работе солевых и алкалиновых батареек
Самыми распространенными солевыми батарейками являются цинковые. В цинковой солевой батарейке электролит состоит из соли – хлорида цинка.
В целом по эффективности работы алкалиновые батарейки превосходят солевые в 5-7 раз.
В отличие от солевых, в алкалиновых батарейках в качестве электролита вместо раствора соли используется раствор щелочи (гидрат окиси калия). Алкалиновые батарейки более работоспособные по сравнению с солевыми. Секрет в том, что в них вместо цинкового корпуса используется порошок из того же металла, а щелочь, взаимодействуя с катодом и анодом, производит больше энергии. Ярким примером алкалиновой батарейки является Duracell.
Ярким примером алкалиновой батарейки является Duracell.
Цинковые солевые батарейки работают при температуре от -20 до +70оС. Их стандартные размеры АА и ААА, и их можно использовать в самых разных устройствах, от карманных фонариков до настенных часов. Срок их годности составляет в среднем 2 года.
Средняя мощность батарейки составляет 1,5 вольта.
Щелочные (они же алкалиновые) батарейки прослужат дольше. Их можно хранить до 10 лет. Благодаря щелочному электролиту они работают лучше при низких температурах. По размерам они ничем не отличаются от солевых.
До недавнего времени алкалиновые батарейки невозможно было перезаряжать, но в последнее время это стало возможно. Такие батарейки не только можно заряжать снова и снова, но они способны удерживать заряд на многие годы. В этом большое экологическое преимущество таких батареек.
Алкалиновые батарейки лучше отвечают потребностям современного рынка, так как потребляемые им мощности постоянно возрастают.
- Почему алкалиновые батарейки работают намного дольше обычных солевых?
- Как правильно выбрать батарейку
- Zinc Chloride Battery Vs. Alkaline
- How Batteries Work, Marshall Brain, Charles W. Bryant and Clint Pumphrey
- What is an Alkaline Battery?
Виды батареек по размерам и химическому составу: шпаргалка CHIP
Какие батарейки лучше — алкалиновые или солевые? Ни те и не другие. В этой статье мы разберемся в химическом составе и типоразмерах батареек, которые используются в бытовой электронике. Читайте нашу шпаргалку по этим двум вопросам.
Виды батареек по химическому составу
В быту «батарейками» называют гальванические элементы, которые создают электрический ток за счет химической реакции. Гальванические элементы производят электрическую энергию благодаря реакциям между двумя металлами в растворе электролита. Один металл является «минусом», другой «плюсом». Между ними протекает реакция окисления (на «минусе») и восстановления (на «плюсе»), за счет которой и возникает ток.
Гальванические элементы производят электрическую энергию благодаря реакциям между двумя металлами в растворе электролита. Один металл является «минусом», другой «плюсом». Между ними протекает реакция окисления (на «минусе») и восстановления (на «плюсе»), за счет которой и возникает ток.
Традиционно с химической точки зрения батарейки разделяют на виды в зависимости от того, какие металлы или какой тип электролита в них используется.
Солевые батарейки
Это старейший тип батареек, разработанный компанией Eveready еще в 20-х годах прошлого века. В качестве «минуса» в нем используется цинк, а в качестве «плюса» — двуокись марганца. Электролит, который обеспечивает протекание реакции — хлорид аммония. Это соль, поэтому батарейка называется солевой.
Солевые батарейки имеют международную маркировку R. Такие батарейки подходят для устройств, не требующих большой мощности питания: детских игрушек, пультов ДУ для телевизоров, часов, ручных фонариков, небольших радиоприемников.
Преимущества
дешевизна
маленький вес
возможность возобновить работу батарейки после разряда
Недостатки
невысокая выработка тока
не работают при минусовых температурах
небольшой срок хранения
проблемы с герметичностью
и быстрая разрядка при неиспользовании
Щелочные батарейки
Щелочные батарейки также называются алкалиновыми (от французского alcaline — щелочной). Они также состоят из марганца и цинка, но в качестве электролита, в котором протекает реакция, в них используется гидроксид калия. Это щелочь, поэтому у батарейки такое название.
Щелочная батарейка маркируется буквами LR. Эти батарейки подходят для устройств со средним и высоким потреблением тока, таких как ручные прожекторы, плееры и диктофоны, фотоаппараты.
Преимущества
большая емкость, чем у солевых
могут работать при низких температурах
герметичны
малая скорость саморазряда — могут храниться до 7 лет
Недостатки
цена чуть выше
более тяжелый вес
одноразовые — после выработки заряда использоваться больше не могут
Ртутные батарейки
В этих батарейках в качестве «минуса» служит цинк, а «плюса» — оксид ртути.
Ртутные батарейки в наше время используются очень редко из-за общеизвестного факта: ртуть токсична. Однако еще в недалеком прошлом они активно применялись в электронных часах, весах, медицинской технике — слуховых аппаратах, кардиостимуляторах.
Преимущества
стабильность напряжения
большая ёмкость
высокая энергоплотность
стойкость к перепаду температур
долгое время хранения
Недостатки
ядовитость ртути при нарушении герметичности
дороговизна
Серебряные батарейки
Есть и такие. В них роль «минуса» опять играет цинк, а роль «плюса» — оксид серебра. Реакция с выделением электрического тока протекает при помощи щелочного электролита — гидроксида калия или натрия.
Международная маркировка серебряной батарейки — SR. Используются они в тех же сферах, что и ртутные, и по достоинствам и недостаткам практически им аналогичны. Главное преимущество серебряных батареек перед ртутными — безопасность: серебро нетоксично, и при нарушении герметичности корпуса нет риска отравления. Главный минус — серебряные батарейки дороже всех остальных видов батареек.
Используются они в тех же сферах, что и ртутные, и по достоинствам и недостаткам практически им аналогичны. Главное преимущество серебряных батареек перед ртутными — безопасность: серебро нетоксично, и при нарушении герметичности корпуса нет риска отравления. Главный минус — серебряные батарейки дороже всех остальных видов батареек.
Литиевые батарейки
Наконец, последний тип батареек — литиевый. У этих батареек в качестве «плюса» используется литий, а вот «минус» и электролит могут быть представлены различными веществами: диоксид марганца, монофторид углерода, пирит, тионилхлорид и другие.
Литиевые батарейки могут использоваться в разной портативной электронике и имеют маркировку CR. Они объединяют в себе все преимущества предыдущих типов и, по факту, являются самым хорошим гальваническим элементом питания. Но по сравнению с щелочными и солевыми элементами литиевые батарейки дороговаты (хотя в зависимости от используемых веществ цена может сильно различаться).
Преимущества
легкость
долгое время хранения (до 12 лет)
термическая стойкость
стабильное напряжение
высокая энергоплотность и энергоемкость
Недостатки
высокая стоимость
Как видите, литиевые батарейки — это единственный тип, у которого достоинства решительно перевешивают недостатки. Поэтому рекомендуем попробовать:
Виды батареек по размерам
Батарейки с одним и тем же химическим составом могут иметь разный размер и форму (типоразмер). Мы составили для вас таблицу-шпаргалку по типоразмерам батареек, чтобы вы точно разобрались, батарейки AA и AAA — это пальчиковые и мизинчиковые?
Цилиндрические батарейки
| Типоразмер | Бытовое название | Ширина, мм | Возможный химический состав | Внешний вид | |
| A (23) | Мини-мизинчиковая | 10,5 | 28,9 | Солевые, щелочные | |
| AA (03) | Пальчиковая | 14,5 | 50,5 | Солевые, щелочные, литиевые | |
| ААА (6) | Мизинчиковая | 10,5 | 44,5 | Солевые, щелочные, литиевые | |
| AAAA (40) | Маленькая мизинчиковая | 8,3 | 42,5 | Солевые, щелочные | |
| С (14) | Средняя | 26,2 | 50 | Солевые, щелочные | |
| D (20) | Большая | 34,2 | 61,5 | Солевые, щелочные | |
| РР3 | Крона | 26,5 | 48,5 | Солевые, щелочные, литиевые |
Замена отжившей цилиндрической батарейки, таким образом, не представляет особой трудности. Достаточно сопоставить маркировку химического состава и типоразмера — и она должна быть представлена на корпусе нужной вам батарейки. Например:
- R23 — солевая A;
- LR03 — щелочная AA;
- СR6 — литиевая AAA.
А вот ртутные и серебряные элементы, как правило, представлены в круглом формате — ее в быту называют «таблеткой». Круглые батарейки имеют великое множество типоразмеров, не подчиняющихся единому стандарту.
На фото — многочисленные размеры круглых батареек.Производители выпускают их такого размера, как им угодно, поэтому замена отжившей батарейки часто представляет заметную проблему. Впрочем, хорошо то, что использование таких элементов ограничено крайне узким кругом устройств. Наша рекомендация: прочтите маркировку на корпусе батарейки и поищите элементы с аналогичной маркировкой в интернете или ближайшем магазине.
Читайте также:
Фото: Pixabay, Wikimedia Commons
Типоразмеры и отличие от Солевых
Когда устройство, работающее на батарейках, имеет значительную мощность, то возникает необходимость в приобретении элементов питания, которые способны обеспечивать прибор необходимым током, в течение длительного времени.
Алкалиновые батарейки хорошо справляются с этой задачей, поэтому, несмотря на более высокую стоимость, они пользуются большой популярностью у покупателей.
Что из себя представляет алкалиновая батарея
Щелочной или алкалиновый(alkaline переводится с английского, как щелочь) источник питания представляет собой элемент, в котором в качестве катода применяется диоксид марганца, а анодную функцию выполняет цинковый порошок.
В качестве электролита в составе этого типа батарей используется раствор гидроксида калия, который является щёлочью, что и отразилось на названии этого типа элементов питания.
Щелочные батареи могут выпускаться различных типоразмеров. Величина разности потенциалов на выводах также может существенно отличаться, поэтому прежде чем приобретать элемент питания необходимо правильно подобрать тип алкалиновой батареи.
Разновидности и типоразмеры алкалиновых (щелочных) батарей
Прежде всего щелочные батарейки различаются по типу корпуса. В основном на прилавках магазинов представлены щелочные изделия следующих типов:
Таблетки (монетки). Этот тип щелочных элементов питания представляет собой диск, диаметр которого может быть от 4,8 до 30 мм. Изделие имеет металлический корпус, поэтому могут быть успешно использованы в устройствах, работающих в неблагоприятных условиях.
Компактность – основное преимущество этого типоразмера щелочных батарей, поэтому наиболее часто их устанавливают в наручные часы, брелоки сигнализаций и слуховые аппараты.
Мизинчиковые батарейки (AAA). Мизинчиковые батарейки представляют собой цилиндр, диаметр которого равен 10,5 мм. Длина изделия – 44,5 мм, а вес — около 14 г.
Щелочные батарейки этого типа имеют на корпусе обозначение alkaline battery ААА, поэтому их несложно будет отличить от солевых или литиевых. Применяют мизинчиковые батарейки в фонариках, игрушках, радиоприёмниках и пультах дистанционного управления.
Пальчиковые батарейки (АА). Эта категория алкалиновых батареек является самой распространённой. Используются пальчиковые батарейки в часах, радиоприёмниках, фонариках, детских игрушках, пультах ДУ и других устройствах, где необходим значительный ток разряда при минимальных размерах элемента питания. Наиболее часто щелочные изделия этого типа выпускаются с напряжением 1,5 вольта.
Крона. Щелочная батарейка типа «Крона» представляет собой элемент питания, напряжение которого на выводах составляет 9v. Достоинства этого типа заключается в том, что при относительно небольших габаритах изделие позволяет обеспечить прибор повышенным напряжением. Элемент используется в пультах ДУ, электроизмерительных приборах, детских игрушках.
Бочонки. Большие бочонки позволяют обеспечить электроэнергией приборы, потребляющие большой ток, без подключения их к электрической сети. Наиболее часто элементы питания этого типа применяются в музыкальных проигрывателях, детских игрушках, фонариках.
Отличить щелочную батарейку от солевой совсем несложно. На корпусе изделия должна быть маркировка LR, которая указывает на наличие щелочного электролита внутри корпуса.
Какие батарейки лучше алкалиновые или солевые
Щелочные батарейки лучше солевых изделий по многим параметрам. Прежде всего, изделия этого типа предпочитают обычным батарейкам по причине значительно большей ёмкости. Разница в продолжительности работы элементов может достигать более 5 раз.
Если необходимо использовать электрическое устройство на морозе, то в этом случае также необходимо устанавливать в прибор алкалиновые батарейки, которые эффективно работают при температуре до — 20 градусов. Солевые батарейки становятся неработоспособными при любой отрицательной температуре.
Во время сильного разряда из корпуса солевой батарейки может вытечь электролит, что может привести к порче электрического устройства. Щелочные элементы практически лишены такого недостатка.
Преимущества и недостатки алкалиновых батарей
Среди преимуществ щелочных источников питания можно назвать следующие:
- Низкий саморазряд.
- Возможность работы при отрицательной температуре воздуха.
- Продолжительный срок годности.
- Хорошо переносят относительно большие токи разряда.
- Равномерный разряд батареи.
К недостаткам этого типа батарей относятся:
- Относительно большой вес изделия.
- Высокая стоимость.
Значительно более высокая цена изделия компенсируется продолжительным периодом эксплуатации. К недостаткам таких изделий можно также невозможность использовать его повторно.
Сравнение AAA и AAМожно ли заряжать алкалиновые батарейки
Если щелочная батарейка разрядилась, то её необходимо утилизировать. Не следует пытаться восстановить элемент питания с помощью зарядного устройства.
Подобные действия могут привести к разгерметизации корпуса батареи. Разрыв изделия может привести к травмам или возгоранию, поэтому категорически запрещается заряжать алкалиновые батарейки.
Популярные производители и их особенности
Гарантировано приобрести качественную продукцию можно только в том случае, если покупать щелочные батарейки известных производителей. На сегодняшний день наибольшим спросом пользуются маргацево щелочные элементы следующих производителей:
- Energizer – достоинство алкалиновых элементов питания от известного американского производителя электротехники заключается в том, что изделие позволяет поддерживать необходимое напряжение в устройстве, на протяжении всего времени эксплуатации изделия.
- Duracell – щелочные элементы питания этой фирмы обладают минимальным саморазрядом и максимальной ёмкостью при стандартных размерах.
- Panasonic – батареи этого производителя отличаются стабильной отдачей электроэнергии, а также повышенной ёмкостью и устойчивостью работы при отрицательной температуре воздуха.
- Сamelion – щелочные изделия этой фирмы производятся в Китае, но качество изделий очень достойное. Батареи Сamelion хорошо переносят глубокий разряд, и сохраняют номинальное напряжение в течение всего срока эксплуатации.
Многие производители щелочных батарей поставляют на рынок качественные изделия, поэтому можно смело приобретать элементы питания таких фирм, как gp, smartbuy, космос, varta и др. Важно при покупке не нарваться на подделку, поэтому покупать батарейки следует только в проверенных торговых точках.
Остались вопросы по Щелочным Батарейкам или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полным и точным.
состав, их сходства и отличия
Практически в каждом доме есть устройства, работающие на батарейках, поэтому представить сегодня жизнь без них невозможно. До недавнего времени использовались преимущественно солевые, но ближе к концу двадцатого века начали приобретать популярность более мощные, алкалиновые батарейки. Между тем история этих помощников насчитывает больше двухсот лет и развитие технологий сопровождалось видоизменением этих миниатюрных друзей человека. Давайте разберемся в чем различия солевых и алкалиновых батареек, какими они обладают достоинствами и недостатками, где используются.
История возникновения
Первая батарейка была изобретена в 1800 году, физиком из Италии – Алессандро Волта. Её устройство выглядело как соединенные оцинковано-серебряные диски с намоченным в солевом растворе картоном. Это позволило создать первый аккумулятор слабой мощности солевого типа. Через 20 лет, изобретатель Джон Даниэль смог разработать более мощную батарейку в 1.1 Вольт с применением сульфатов: металлов меди и цинка. Это позволило создать практически «вечную» батарейку для устройств тех времен.
Первую алкалиновую батарейку изобрели американские ученые Вольдемар Юнгнер, и Томас Эдисон в начале двадцатого века, но приобрели популярность они только к середине этого же века. В них использовалась ртуть, но в сегодняшних аналогах её содержание снижено до минимальных значений.
В чем различия солевых и алкалиновых батареек
В первую очередь эти два вида отличаются друг от друга способом работы и составом. Солевые батарейки изготавливаются с использованием солей хлоридов в виде основного электролита. В алкалиновых же вместо солевого раствора используется щелочной раствор гидрата окиси калия, поэтому их так же называют щелочными. Они имеют повышенную работоспособность благодаря использованию вместо оцинкованного корпуса порошкообразного металла. Взаимодействие катода и анода с щелочью позволило повысить в несколько раз количество производимой энергии. Самым популярным производителем алкалиновых аккумуляторов является компания Duracell.
Еще одним различием алкалиновых или солевых батареек – срок годности. Оцинкованные батарейки с использованием соли могут сохранять свою работоспособность в температурном интервале от -20 до +70 градусов по Цельсию. Батарейки этой категории используются в устройствах, не требующих много энергии. Отдельно следует выделить срок годности солевой батарейки, который не превышает двух лет. Алкалиновые же способны работать в большем температурном диапазоне, хорошо функционируя даже при значительном морозе и имеют срок годности до десяти лет, а с недавнего времени появилась возможность их зарядки.
Преимущества алкалиновых перед солевыми
Благодаря своему составу, алкалиновые аккумуляторы в несколько раз превосходят своих младших братьев – солевых АКБ. Достоинств первых большое количество, важнейшим из которых является возможность подзарядки современных моделей. Другие характерные особенности и различия батареек из соли и щелочи:
- Одно из основных различий, срок годности – 2-3 года солевых, 5-10 алкалиновые.
- При полной разрядке первых, они приходят в непригодность, в то время как щелочные элементы питания аккумуляторы способны работать при минимальном уровне разряда.
- Диапазон температур – щелочные батарейки способны работать в мороз.
- Разница в цене – наименьшую имеют солевые АКБ, щелочные стоят в несколько раз дороже, из-за сложности изготовления и большого количества преимуществ перед первыми.
- Производительность солевой в 4-10 раз меньше чем алкалиновой.
- Наилучшие результаты алкалиновая АКБ показывает при равномерной работе и потреблении мощности, в то время как солевая лучше при сильной нагрузке.
Явным лидером считается алкалиновая батарейка, но её недостаток перечеркивает все достоинства – высокая цена может значительно ударить по кошельку.
Внимание! На батарейках алкалинового типа нанесена надпись Alkaline Battery или маркировка щелочных: LR. У солевых маркировка состоит из одной буквы – R/ Это позволяет отличить солевые батарейки от щелочных и наоборот.
Если требуется АКБ в слабое устройство, то чаще приобретают солевые, они дешевле и способны работать достаточное время в настенных часах, будильниках, пультах. Но вне зависимости от преимуществ алкалиновой аккумуляторной батареи, вне конкуренции, лидером остается, литиевая батарейка, но цена на неё превышает в несколько десятков раз аналоги других разновидностей. Солевые отличаются от щелочных в первую очередь своим составом и строением – давайте разберемся в особенностях устройства этих помощников.
Что такое солевая батарейка
В устройстве солевой батарейки используются следующие материалы: цинк в роли катода, двуокись марганца в роли анода и хлорид аммония в роли электролита.
Электрический ток вырабатывается благодаря взаимодействию электролитов, анодов и катодов. После его образования, он переносится на токосниматель внутри АКБ, а после в разные концы батарейки на электроды – что позволяет передать заряд электрического тока устройству, в котором используется солевой АКБ в роли элемента питания.
Солевая батарейка имеет мощность 1.5В. Стандартными размерами считаются АА и ААА (пальчиковый и мизинчиковый), но бывают и другие габариты: C, D, 6F22. Этот вид аккумулятора дешевле аналогов в несколько раз и имеет маленький вес, но обладает низкими энергетическими показателями. Так же солевые АКБ способны окисляться, из-за плохой герметичности.
Соляные батарейки подходят для использования в устройствах с низким энергопотреблением:
- Миниатюрных роботах, игрушках для подростков и похожих приборах.
- В слабых и средних по мощности фонариках.
- В электронных часовых механизмах различного типа, например, настенных и настольных.
- Устройствах дистанционного управления или пультах для телевизоров, ресиверов и проигрывателей;
- В небольших радиоприемниках карманного типа.
Лучшими производителями солевых аккумуляторов считаются: GP, Sanyo, Фотон, Космос, Энергия. Определить солевую батарейку можно по специальной маркировке «R» с рядом стоящей цифрой.
Что такое алкалиновая или щелочная батарейка
В составе аккумуляторных батареек алкалинового или щелочного типа, используются: размельченный в порошок цинк в роли анода, в роли катода диоксид марганца, а электролитом является щелочной материал – гидроксид калия.
Принцип работы полностью идентичен солевой батарейке. Напряжение в алкалиновой АКБ тоже совпадает – 1.5В. К стандартным размер относятся: АА, ААА, LR20, LR14, 6F22, но существуют и другие габариты. Данный аккумулятор имеет большую емкость, переносит низкие температуры, долгий срок хранения, но стоит дороже солевого и тяжелее его.
Щелочные или алкалиновые батарейки подходят для использования в устройствах со средним и высоким энергопотреблением:
- в мощных фонариках и требовательных к электрическому заряду детских игрушках;
- различных аудиоплеерах и радиоприемниках, как карманного, так и настенного типа;
- диктофонах и карманных MP3-плеерах;
- современных фотоаппаратах и видеокамер;
- автомобильных устройствах;
- в пультах для дистанционного управления.
Лучшие производители аккумуляторов с применением щелочи: Energizer, Duracell, Toshiba, Sony. Главным отличием от солевой служит маркировка LR или надпись «alkaline battery». Но многие задаются вопросом, можно ли заряжать алкалиновые батарейки и как это делать.
Можно ли заряжать?
Зарядить солевую или алкалиновую батарейку невозможно, более того – это опасно для жизни, аккумулятор может взорваться при попытке сделать это. Единственное что можно сделать, это увеличить срок эксплуатации. В случае с солевыми – их бьют друг об друга, что позволяет элементам внутри прийти в движение и незначительно повысить заряд. Щелочные батарейки можно попробовать переставить местами – изменяя источники питания. Но пытаться зарядить не нужно – это бесполезно.
Важно! Обычные батарейки содержат в себе опасные элементами – поэтому с целью подзарядки их нельзя разбирать, вскрывать, делать надрезы на корпусе.
Существуют способы «реанимировать» алкалиновую батарейку – но их могут производить только специалисты с определенным уровнем знаний и умений, а также при условии наличия определенных инструментов, в том числе вольтметра.
Сходства
Не смотря на различие в составах, мощности и условий хранения, солевые и щелочные АКБ имеют ряд сходств, что часто приводит к путанице у покупателя, и он может приобрести батарейку «не того» типа:
- Одинаковые габариты и размеры – они выглядят идентично друг другу и внешних сходств между ними нет.
- Возможность использования в одних и тех же устройствах – различием будет только срок службы, обычно в несколько раз короче у солевых.
- Одинаковое напряжение в 1.5В.
- Невозможность подзарядки – заряжать можно только литиевые АКБ, если попытаться зарядить солевую или щелочную батарейку может произойти взрыв.
- Нельзя выбрасывать в мусорную урну – АКБ приносит большой вред природе и их нужно утилизировать согласно законодательству.
В развитых странах для утилизации батареек этих двух типов открываются специальные приемники отработанных элементов, в которых можно получить скидку за сдачу АКБ. На специализированном заводе аккумуляторы разбирают, извлекая все опасные вещества и элементы, с целью последующей переработки.
Ежегодно производится около 11 миллиардов аккумуляторных батареек солевого и щелочного типа. При этом всё чаще крупнейшие компании отказываются от производства первых, для возможности большего количества изготовления вторых.
Типоразмеры аккумуляторных батареек
Щелочные и солевые батарейки имеют одинаковые габариты и имеют схожие типоразмеры. Производите изготавливают несколько десятков типов различных аккумуляторов, но у современных продавцов и покупателей популярны лишь часть из них.
Пальчиковые (АА) – самые популярные аккумуляторы и наиболее распространенные на планете. Применяются в различных сферах жизни как элемент питания. Часто используются внутри устройств различных часовых механизмов, детских и подростковых игрушек, в старых пультах, фонариках различной мощности.
Мизинчиковые (ААА) – диаметр этих аккумуляторов около сантиметра, длина 44.5, а вес до 14г (зависит от производителя). Применение достаточно широкое – современные пульты для дистанционного управления, аудиоплееры, небольшие и средние по мощности фонарики, детские игрушки и миниатюрные роботы.
Монетки/Таблетки – так же популярный типоразмер, который различается в диаметре изделий от 4 до 30 миллиметров. Применяются для питания наручных пейджеров и часов, различных брелоков, пультов сигнализации, игрушек, слуховых аппаратов и других устройствах, где требуется максимально миниатюрный элемент питания.
Крона – мощный элемент питания, имеющий на выходе напряжение в 9В. При небольшом габарите, эти АКБ способны дать достаточно много электрического тока. Чаще всего применяются в пультах для дистанционного управления, точных электроизмерительных приборов, в том числе медицинских, в дорогих детских игрушках.
Бочонок – большие аккумуляторы, позволяющие обеспечивать достаточным количеством энергии приборы, которые требуют подключение к электросети. Чаще всего используются в музыкальных магнитофонах и радио приемниках, мощных фонариках, двигающихся детских игрушках.
Вывод
Батарейки с применением солевых элементов имели наибольшую популярность до 1960 года, но после того как щелочные АКБ попали на полки магазинов, alkaline battery обогнали salt battery по продажам, не смотря даже на превосходящую в несколько раз цену. Связанно это в первую очередь с повышенной мощностью, которая позволяла при одинаковом заряде в 1.5В использовать одно и тоже устройство в 5-10 раз дольше, чем при использовании солевого аккумулятора.
Но возможно исчезновение с прилавков магазинов, как солевых, так и щелочных/алкалиновых аккумуляторных батарей, в связи с появлением литиевых, которые можно подзаряжать в отличии от соли и щелочи, а маркировку и уровень мощности получилось сохранить такой же. Использование батарейки в устройствах приходит к своему логическому заключению – наступает эра аккумуляторов, которые держат больший заряд, легко подзаряжаются и менее опасны для окружающей среды. Пока аккумуляторы используются только в дорогостоящих приборах, но это же было и с батарейками. Через несколько десятилетий произойдет очередной технический прорыв, который позволит производителям удешевить аккумуляторы, и они станут такими же обыденными, как солевые или щелочные батарейки.
Какие батарейки прослужат дольше?
Досадно, когда батарейки в фотоаппарате «сдыхают» в самый ответственный момент. Или садятся на середине любимой песни. От чего зависит длина жизни элемента питания? Вместе со специалистами Mосковской электротехнической испытательной лаборатории «Комсомолка» проверила работоспособность самых популярных марок батареек.
Выявляем «долгоиграющие»
Самые распространенные типы бытовых элементов — солевые и щелочные. Последние легко отличить по более высокой цене и надписи «alkaline» на корпусе.
Для экспертизы мы выбрали наиболее ходовые батарейки — «пальчиковые». Три образца — солевые (Samsung, Philips, Panasonic), один — щелочной (Duracell), все со сроком годности до 2005 — 2009 годов.
Для начала специалисты испытательной лаборатории поочередно проверили наших «подопытных кроликов» в обычной детской игрушке — электромеханическом роботе.
Дольше всего (107 минут) пластмассовый монстр гудел и двигался с батарейками Duracell, тогда как самых долгоиграющих солевых Philips хватило только на 20 минут. Затем свеженькие «пальчики» из той же партии ждало испытание посерьезнее — цифровой фотоаппарат Casio с жидкокристаллическим дисплеем. В режиме непрерывной съемки со вспышкой солевых элементов хватило лишь на один-два кадра, после этого камера попросту отрубилась. На щелочных Duracell экспертам удалось сделать несколько десятков снимков (результаты испытания — в нашей таблице).
Солевые или щелочные?
Век солевых батареек недолог, но зато и цена у них в 2 — 4 раза ниже, чем у щелочных.
Емкость солевых батареек составляет 400 — 800 мАч, щелочных — 1500 — 3000 мАч, таким образом, за большую цену мы получаем и гораздо более долговечную батарейку.
Значит ли это, что мы должны повально отказаться от солевых элементов и перейти на «щелочь»? Конечно, каждый решает сам. По мнению экспертов, для некоторых устройств дешевенькие солевые батарейки покупать все-таки выгодно. Это приборы со средним потреблением тока, которыми мы пользуемся не так уж и часто, — например, карманные фонарики, мелкие детские игрушки и т. д. А вот для штучек с высокими затратами энергии — цифровых камер, CD-плейеров, тд — солевые элементы бесполезны: тут же «сдыхают».
Доверяй известным фирмам
Батарейки неизвестных производителей лучше не покупать — непонятно, как будет вести себя такой «абориген». Уважающие себя фирмы стараются снабдить свои батарейки разборчивой информацией на корпусе и четко пропечатанным сроком годности (для батареек он составляет 5 — 7 лет). Тот же Duracell, к примеру, отличается лаконичной двухцветной окраской, на фоне которой серебристо-белым или черным цветом выполнены легкочитаемые надписи. К тому же Duracell не выпускает солевых батареек, поэтому проблем с расшифровкой символов электрохимической системы у покупателя не возникает. Так же хорошо читается информация и на белом корпусе Samsung; Panasonic можно отличить по сине-черному дизайну, на фоне которого — белые надписи и зеленое яблоко. Philips — в зелено-голубой «одежке». Правда, на испытанных нами батарейках Panasonic и Philips (оба образца сделаны в Польше) надписи читались плохо, особенно срок годности.
КСТАТИПодзарядка запрещена!
Еще дольше, чем солевые и щелочные батарейки, работают аккумуляторы. По виду они — близнецы-братья батареек, но отличаются тем, что их можно подзаряжать от сети. От своих собратьев они отличаются более высокой ценой и надписью на упаковке «rechargeable» (заряжаемые). А что случится, если взять да и подзарядить обычные батарейки от подзарядки для аккумуляторов? От имени Клуба потребителей, уже проделавшего такой опыт, советуем: воздержитесь! Через пару часов батарейки взорвутся и заляпают своим содержимым все вокруг.
Досадно, когда батарейки в фотоаппарате «сдыхают» в самый ответственный момент. Или садятся на середине любимой песни. От чего зависит длина жизни элемента питания? Вместе со специалистами Mосковской электротехнической испытательной лаборатории «Комсомолка» проверила работоспособность самых популярных марок батареек.
Какую выбрать батарейку?
Рынок стандартных элементов питания, или то, что в обиходе мы называем батарейками, очень велик. Пульт от телевизора, плеер, фотовспышка, детская игрушка – все питается за счет батареек. Да и сами батарейки бывают разные: “пальчиковые” (AA, LR6), “мизинчиковые” (AAA, LR03), “бочонки” (C, LR14; D, LR20), “крона” (6LR61) и так далее. Сегодня мы рассмотрим одни из самых популярных батареек – “пальчиковые” AA, LR6. Элементов питания LR6 существует три основных вида — солевые, щелочные и литиевые.
ТЕКСТ: Дмитрий ЛУКИН
Солевые элементы питания
Батарейки с солевым электролитом, они же цинк-углеродные – самые дешевые химические источники тока из имеющихся в продаже.
Представляет собой такая батарейка цинковый цилиндрический контейнер, который служит и корпусом и “минусом” одновременно. В центре контейнера находится графитовый стержень (положительный электрод), он же “плюс”. Вокруг анода размещен слой диоксида марганца, а оставшееся пространство между ним и стенками контейнера заполнено пастой из хлорида аммония и хлорида цинка, разведенных в воде. Состав этой пасты может варьироваться: в маломощный батарейках превалирует хлорид аммония, в более мощных (Heavy Duty) – хлорид цинка.
В процессе работы батарейки цинк постепенно окисляется, в контейнере появляются маленькие дырочки, из которых начинает сочиться электролит и батарейка может испортить технику. Во времена СССР это было весьма распространенное явление. В современных батарейках цинковый контейнер надежно упакован в дополнительную внешнюю оболочку. Но, тем не менее, надолго оставлять севшую батарейку в приборе не стоит.
Применительно к данному виду батареек слово “мощный” условно: в фотоаппарате — «мыльнице” их хватит на 3-4 кадра, а в ламповом фонаре на 15 минут работы. Эти батарейки идеальны для работы в пультах ДУ, часах, электронных термометрах.
Щелочные элементы питания
Alkaline в переводе с английского – щелочь, поэтому этот тип батареек в народе называют алкалиновые. Эти батарейки более дорогие.
Отрицательный полюс щелочной батарейки состоит из цинкового порошка, что позволяет увеличить скорость протекания химической реакции, а значит, и отдаваемый батарейкой ток. Положительный полюс состоит из диоксида марганца. Основное же отличие от солевой батарейки – тип электролита. В щелочных батарейках электролитом является гидроксид калия.
Щелочные батарейки хорошо подходят для устройств с энергопотреблением от десятков до сотен миллиампер. Правда, у батареек этого типа есть один существенный недостаток – большое внутреннее сопротивление. То есть, если нагрузить батарейку действительно большим током, ее напряжение сильно просядет, а значительная часть энергии будет расходоваться на нагрев самой батарейки. Этот тип элементов питания идеален для работы аудио плеера, цифрового фотоаппарата, радиоприемника. Если цифровой фотоаппарат на солевых батарейках может даже не включиться, то щелочных хватит на 40 минут полноценной работы.
Литиевые элементы питания
Последний тип широко распространенных батареек – литиевые. Основное преимущество литиевой батарейки заключается в меньшем внутреннем сопротивлении по сравнению со щелочными: их емкость мало зависит от тока нагрузки. Если их поставить в цифровой фотоаппарат, то щелочные “умрут” через 40 минут, а литиевые проживут три часа.
Литиевые батарейки крайне долговечны – допустимый срок хранения 15 (!) лет, при этом сроке батарейка потеряет всего 10% емкости. Литиевые батарейки могут работать при отрицательных температурах, а в солевых и щелочных батарейках замерзает электролит и они перестают работать.
Минусом литиевых батареек является крайне высокая цена, они в три – пять раз дороже щелочных.
СОЛНЕЧНЫЙ ВЫБОР
В переводе с немецкого языка, одно из основных значений слова SONNEN – это «солнечный». И действительно, вся продукция, выпускаемая под данной торговой маркой, оставляет позитивные, яркие впечатления. Торговая марка SONNEN принадлежит немецкой компании Brauberg Brands GmbH (Германия). Изделия ТМ SONNEN полностью отвечают запросам потребителей как в плане надежности изготовления, длительного срока эксплуатации, так и в отношении привлекательной стоимости.
Продукция производится на крупнейших заводах – мировых лидерах в своих сферах специализации. Перечень товаров бренда включает только те позиции, которые пользуются наибольшим спросом у конечного потребителя. В основе философии бренда лежат четыре основных принципа – честность, ответственность, открытость и профессионализм. Cоздатели марки стремятся к тому, чтобы потребитель, попробовав продукцию один раз, запомнил ее, оценил по достоинству и совершал покупки неоднократно.
Техника SONNEN – это постоянно пополняемый модельный ряд товаров в группах бытовая техника, портативная электроника и аксессуары. При неизменном росте качества и применении новых технологий в производстве, техника SONNEN выступает в сегменте «доступная цена – высокое качество» и регулярно радует потребителей новинками дизайна и форм.
«САМСОН» ШАГАЕТ ПО СТРАНЕ
Эксклюзивным дистрибьютором марки SONNEN на российском рынке является группа компаний «Самсон» – крупнейший оператор на рынке дистрибуции товаров для офиса и школы.
Компания более 20 лет осуществляет оптовые и мелкооптовые поставки товаров по всей территории Российской Федерации.
Транспортно-складская служба, входящая в структуру компании, располагает собственным автопарком – более 200 единиц автотранспорта грузоподъёмностью до 10 тонн; широкой сетью региональных складов в крупных городах России (Москва, Санкт-Петербург, Воронеж, Волгоград, Нижний Новгород, Ростов-на-Дону, Самара, Саратов, Казань, Новосибирск, Пермь, Ставрополь, Уфа), общей площадью 100 000 м2 с объёмом товарных запасов, позволяющим бесперебойно поставлять товар клиентам с максимальным коэффициентом выполнения заказа.
На сегодняшний день общая численность сотрудников компании составляет около 2 500 человек. Компания сотрудничает с 5 000 активных клиентов из 82 регионов РФ.
Группа компаний «Самсон» обеспечивает своим клиентам оптовые поставки товаров в любую точку Российской Федерации и предоставляет преимущества комплексных программ по поддержке и развитию продаж клиентов в любом из каналов сбыта.
Официальный дистрибьютор SONNEN в России — группа компаний «Самсон»
В чем разница между щелочными и нещелочными батареями?
Неперезаряжаемые сухие аккумуляторные батареи подразделяются на несколько категорий: по буквенным обозначениям, по напряжению и по применению. Однако химическая классификация, которая различает сухие батареи, заключается в том, является ли батарея щелочной или нещелочной, или, точнее, является ли ее электролит основанием или кислотой. Разница заключается не только в химическом составе, поскольку щелочные батареи имеют другую мощность и рабочие характеристики, чем их нещелочные собратья.
TL; DR (слишком долго; не читал)
Нещелочные батареи содержат кислотный электролит, а щелочные батареи используют основу в качестве электролита.
Основные сведения об аккумуляторах
Аккумулятор — это электрохимический элемент, преобразующий химическую энергию в электрическую. Типичная батарея с сухими элементами состоит из положительно заряженного анода, отрицательно заряженного катода и электролита, который реагирует с анодом и катодом во время электрохимической реакции, называемой реакцией окисления-восстановления.Анод имеет тенденцию терять электроды — окисляется — тогда как катод имеет тенденцию получать электроны или восстанавливается.
Избыток электронов на отрицательном катоде — отрицательный вывод батареи — и недостаток электронов на положительном аноде — положительный вывод батареи — создают электрическое давление, называемое напряжением. Когда аккумулятор помещается в цепь, электроны протекают как ток между катодом и анодом, выполняя полезную электрическую работу. Затем батарея перезаряжается с помощью дополнительных окислительно-восстановительных реакций до тех пор, пока анод и катод в конечном итоге химически не истощатся, что приведет к разрядке батареи.
Основы электролита
Электролит — это химическое вещество, которое содержит свободные ионы, обладающие электропроводностью. Примером электролита является обычная поваренная соль, состоящая из положительно заряженных ионов натрия и отрицательно заряженных ионов хлорида. Электролит батареи — это кислота или основание, которые диссоциируют на положительно и отрицательно заряженные ионы, которые вступают в реакцию с анодом и катодом, когда батарея подвергается окислительно-восстановительной реакции.
Щелочная батарея
Химически типичная щелочная батарея с сухими элементами имеет цинковый анод и катод из диоксида марганца.Электролит представляет собой некислотную основную пасту. Типичным электролитом, используемым в щелочных батареях, является гидроксид калия. Физически типичная щелочная батарея состоит из стальной банки, заполненной диоксидом марганца в ее самой внешней внутренней катодной области и заполненной цинком и электролитом в самой центральной внутренней анодной области. Электролит, окружающий анод, опосредует химическую реакцию между анодом и катодом.
Нещелочная батарея
Химически типичная нещелочная батарея с сухими элементами имеет цинковый анод и катод из угольного стержня / диоксида марганца.Электролит обычно представляет собой кислотную пасту. Типичный электролит состоит из смеси хлорида аммония и хлорида цинка. Физически типичная нещелочная батарея сконструирована как обратная сторона щелочной батареи. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень / диоксид марганца занимает внутреннюю область в качестве катода. Электролит смешивается с катодом и опосредует химическую реакцию между катодом и анодом.
Better Batteries
По общему мнению, химически щелочная батарея имеет небольшое преимущество в производительности по сравнению с нещелочной батареей.Однако нещелочные батареи надежны, менее дороги и взаимозаменяемы с использованием щелочных батарей. На электронные устройства с надписью «Используйте только щелочные батареи» обычно распространяется гарантия в условиях, когда требуется быстрое и сильное потребление тока от батареи. Одним из примеров этого может быть вспышка на фотоаппарате, где требуется быстрая подзарядка.
Аккумуляторы | Безграничная химия
Сухая батареяВ сухих батареях используется иммобилизованный электролит, который сводит к минимуму влажность и обеспечивает превосходную портативность.
Цели обучения
Обсудите рабочие компоненты сухой аккумуляторной батареи и их основные преимущества
Основные выводы
Ключевые моменты
- Батарея содержит электрохимические элементы, которые могут накапливать химическую энергию для преобразования в электрическую.
- Сухая батарея аккумулирует энергию в виде иммобилизованной электролитной пасты, что сводит к минимуму потребность в воде.
- Общие примеры батарей с сухими элементами включают угольно-цинковые батареи и щелочные батареи.
Ключевые термины
- катод : электрод электрохимической ячейки, на которой происходит восстановление.
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- анод : электрод электрохимической ячейки, на которой происходит окисление.
Определение сухой ячейки
В электричестве аккумулятор — это устройство, состоящее из одной или нескольких электрохимических ячеек, которые преобразуют накопленную химическую энергию в электрическую.Сухая ячейка — это один из многих общих типов электрохимических ячеек.
В сухом элементе электролит иммобилизован в виде пасты с достаточным количеством влаги для протекания тока. В отличие от влажного элемента, сухой элемент может работать в любой ориентации, не проливаясь, поскольку он не содержит свободной жидкости. Эта универсальность делает его пригодным для портативного оборудования. Для сравнения: первые батареи с жидкими элементами обычно представляли собой хрупкие стеклянные контейнеры со свинцовыми стержнями, свисающими с открытого верха. Поэтому с ними нужно было осторожно обращаться, чтобы избежать утечки.Разработка батарей с сухими элементами позволила значительно повысить безопасность и портативность батарей.
Обычная сухая батарея — это угольно-цинковая батарея, в которой используется элемент, который иногда называют элементом Лекланше. Ячейка состоит из внешнего цинкового контейнера, который действует как анод. Катод представляет собой центральный углеродный стержень, окруженный смесью углерода и диоксида марганца (IV) (MnO 2 ). — \ rightarrow 2 \ text {NH} _3 (\ text {g}) + \ text {H} _2 (\ text {g}) [/ latex]
Оксид марганца (IV) в ячейке удаляет водород, производимый хлоридом аммония, в соответствии со следующей реакцией:
[латекс] 2 \ text {MnO} _2 (\ text {s}) + \ text {H} _2 (\ text {g}) \ rightarrow \ text {Mn} _2 \ text {O} _3 (\ text { s}) + \ text {H} _2 \ text {O} (\ text {l}) [/ latex]
Совместный результат этих двух реакций имеет место на катоде.- [/ латекс]
Следовательно, общее уравнение для ячейки:
[латекс] \ text {Zn} (\ text {s}) + 2 \ text {MnO} _2 (\ text {s}) + 2 \ text {NH} _4 (\ text {aq}) \ rightarrow \ text {Mn} _2 \ text {O} _3 (\ text {s}) + \ text {H} _2 \ text {O} (\ text {l}) + \ text {Zn} _2 + 2 \ text {NH} _3 (\ text {g}) [/ latex]
Потенциал указанной выше реакции составляет 1,50 В.
Другим примером сухих элементов питания является щелочная батарея. Щелочные батареи почти такие же, как угольно-цинковые батареи, за исключением того, что в качестве электролита используется гидроксид калия (КОН), а не хлорид аммония.В некоторых более современных типах так называемых «высокомощных» батарей, которые имеют гораздо меньшую емкость, чем стандартные щелочные батареи, хлорид аммония заменен хлоридом цинка.
Ртутный аккумулятор
БатареиMercury были обычными электрохимическими батареями, которые были выведены из массового использования в США в соответствии с Законом о батареях 1996 года.
Цели обучения
Обсудить применение ртутно-оксидной батареи
Основные выводы
Ключевые моменты
- Ртутные батареи были очень распространены в 20 веке и использовались во многих обычных малых и больших приборах.
- Преимущества ртутной батареи включают длительный срок хранения и стабильное выходное напряжение.
- Ртутные батареи используют соединение ртути в качестве катода с цинковым анодом.
- Наряду с другими батареями, которые основаны на тяжелых металлах, ртутные батареи были выведены из обращения в соответствии с Законом о батареях, который направлен на уменьшение воздействия одноразовых батарей на окружающую среду.
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
Ртутная батарея, также называемая батареей из оксида ртути или ртутным элементом, представляет собой неперезаряжаемую электрохимическую батарею. Эти батареи использовались в форме кнопочных элементов для часов, слуховых аппаратов и калькуляторов, а также в более крупных формах для других устройств, включая рации.
Батарейка для часов Mercury : Батарейки Mercury удобны из-за своего размера. Это маленькая ртутная батарейка для часов.
БатареиMercury обладают преимуществами длительного срока хранения до 10 лет и стабильного выходного напряжения. Хотя эти батареи были очень распространены в середине 20-го века, Закон об управлении ртутьсодержащими и перезаряжаемыми батареями (Закон о батареях), принятый в США в 1996 году, в значительной степени отказался от ртутных батарей из-за проблем, связанных с окружающей средой.
В батареяхMercury в качестве катода используется либо чистый оксид ртути, либо смесь оксида ртути с диоксидом марганца. Ячейки с оксидом ртути сконструированы с цинковым анодом, катодом из оксида ртути и гидроксидом калия или гидроксидом натрия в качестве электролита. Поскольку оксид ртути не является проводником, с ним примешивается немного графита. Это помогает предотвратить скопление ртути в крупные капли. Во время разряда цинк окисляется до оксида цинка, а оксид ртути восстанавливается до элементарной ртути.В элемент помещается немного дополнительного количества оксида ртути, чтобы предотвратить выделение газообразного водорода в конце срока его службы.
В ртутных батареях в качестве электролита используется гидроксид натрия или гидроксид калия. Ячейки с гидроксидом натрия имеют почти постоянное напряжение при низких токах разряда, что делает их идеальными для слуховых аппаратов, калькуляторов и электронных часов. Ячейки с гидроксидом калия, в свою очередь, обеспечивают постоянное напряжение при более высоких токах, что делает их пригодными для приложений, требующих скачков тока, таких как фотоаппараты со вспышкой и часы с подсветкой.Ячейки с гидроксидом калия также лучше работают при более низких температурах.
Закон о батареях
В 1996 году в США был принят Закон о ртутьсодержащих и аккумуляторных батареях (Закон о батареях; публичный закон 104-142). Предполагаемая цель закона заключалась в сокращении содержания тяжелых металлов в городских отходах, ручьях и грунтовых водах. Это произошло в результате утилизации ртути в одноразовых батареях, а также других токсичных металлов, таких как свинец из свинцово-кислотных батарей и кадмия в аккумуляторных батареях.Таким образом, закон стремился поэтапно отказаться от использования ртути в батареях из-за нанесенного ею ущерба окружающей среде.
Свинцовая аккумуляторная батарея
Свинцово-кислотные аккумуляторы вырабатывают большие токи и сохраняют заряд в течение длительного времени, что делает их незаменимыми для транспортных средств.
Цели обучения
Вспомните химическую реакцию, которая происходит в свинцовых аккумуляторных батареях
Основные выводы
Ключевые моменты
- Свинцово-кислотные батареи, также известные как свинцовые аккумуляторные батареи, могут накапливать большой заряд и обеспечивать высокий ток в течение коротких периодов времени.
- Базовая конструкция свинцово-кислотных аккумуляторов не претерпела значительных изменений с 1859 года, когда их разработал Планте, хотя некоторые улучшения были внесены Форе.
- Свинцово-кислотные аккумуляторы можно заряжать, что важно при их использовании в автомобилях.
- Разрядка накопленной энергии зависит от того, как положительная, так и отрицательная пластины превращаются в сульфат свинца (II), а электролит теряет большую часть растворенной серной кислоты.
Ключевые термины
- лигносульфонат : водорастворимые анионные полиэлектролитные полимеры; они являются побочными продуктами производства древесной массы с использованием сульфитной варки.
Свинцовые батареи
Свинцовая аккумуляторная батарея, также известная как свинцово-кислотная батарея, является самым старым типом аккумуляторных батарей и одним из наиболее распространенных устройств хранения энергии. Эти батареи были изобретены в 1859 году французским физиком Гастоном Планте, и они до сих пор используются во множестве приложений. Большинство людей привыкло использовать их в транспортных средствах, где они могут обеспечивать высокие токи для запуска.
Хотя батареи надежны, у них ограниченный срок службы, они тяжелы при транспортировке и содержат токсичные материалы, которые требуют специальных методов удаления по окончании срока службы.Свинцово-кислотные батареи имеют умеренную удельную мощность и хорошее время отклика. В зависимости от используемой технологии преобразования энергии батареи могут перейти от приема энергии к мгновенной подаче энергии. Свинцово-кислотные аккумуляторы подвержены влиянию температуры и должны поддерживаться в надлежащем состоянии для достижения максимального срока службы.
Разработка свинцовой батареи
В конструкции свинцово-кислотного элемента Планте положительная и отрицательная пластины были сделаны из двух спиралей свинцовой фольги, разделенных листом ткани и скрученных.Ячейки изначально были малой вместимостью. Требовался медленный процесс «формовки» для коррозии свинцовой фольги, образования диоксида свинца на пластинах и придания им шероховатости для увеличения площади поверхности. Пластины Планте все еще используются в некоторых стационарных приложениях, где на пластинах имеются механические канавки для увеличения площади поверхности.
Свинцовая аккумуляторная батарея : Схема, показывающая, как свинцовая аккумуляторная батарея состоит из шести последовательно соединенных двухвольтовых элементов. Также показан состав каждой ячейки.
Конструкция из клееных пластин Камиллы Альфонса Фор типична для современных автомобильных аккумуляторов. Каждая пластина состоит из прямоугольной свинцовой сетки. Отверстия решетки заполнены пастой из красного свинца и 33-процентной разбавленной серной кислоты. Эта пористая паста позволяет кислоте реагировать со свинцом внутри пластины, что увеличивает площадь поверхности. После высыхания пластины складываются с помощью подходящих разделителей и вставляются в аккумуляторный контейнер. Обычно используется нечетное количество пластин, с отрицательной пластиной на одну больше, чем положительной.Каждая альтернативная пластина подключается.
Паста содержит технический углерод, сульфат бария и лигносульфонат. Сульфат бария действует как затравочный кристалл для реакции сульфата свинца в свинец. Лигносульфонат предотвращает образование твердой массы отрицательной пластиной во время цикла разряда, а вместо этого позволяет формировать длинные игольчатые кристаллы. Технический углерод противодействует эффекту ингибирования образования, вызванному лигносульфонатами.
Химия разряда
В разряженном состоянии как положительная, так и отрицательная пластины становятся сульфатом свинца (II) (PbSO 4 ).Электролит теряет большую часть растворенной серной кислоты и превращается в основном в воду. Процесс разряда управляется проводимостью электронов от отрицательной пластины обратно в ячейку на положительной пластине во внешней цепи.
Отрицательная реакция пластины: Pb (s) + HSO 4 — (водн.) → PbSO 4 (s) + H + (водн.) + 2e —
Положительная реакция пластины: PbO 2 (с) + HSO 4 — (водный) + 3H + (водный) + 2e — → PbSO 4 (с) + 2H 2 O (л)
Комбинируя эти две реакции, можно определить общую реакцию:
Pb (с) + PbO 2 (с) + 2H + (вод.) + 2HSO 4 — (вод.) → 2PbSO 4 (с) + 2H 2 O (л)
Зарядная химия
Аккумулятор этого типа можно заряжать.В заряженном состоянии каждая ячейка содержит отрицательные пластины из элементарного свинца (Pb) и положительные пластины из оксида свинца (IV) (PbO 2 ) в электролите примерно 4,2 М серной кислоты (H 2 SO 4 ). . Процесс зарядки осуществляется за счет принудительного удаления электронов с положительной пластины и принудительного введения их в отрицательную пластину источником заряда.
Отрицательная реакция пластины: PbSO 4 (с) + H + (вод.) + 2e — → Pb (с) + HSO 4 — (вод.)
Положительная реакция пластины: PbSO 4 (с) + 2H 2 O (л) → PbO 2 (с) + HSO 4 — (водный) + 3H + (водный) + 2e –
Объединение этих двух реакций дает полную реакцию, обратную реакции разряда:
2PbSO 4 (с) + 2H 2 O (л) → Pb (с) + PbO 2 (с) + 2H + (водн.) + 2HSO 4 — (водн.)
Обратите внимание, что реакция зарядки прямо противоположна реакции разряда.
Другие аккумуляторные батареи
Спрос на многие разновидности аккумуляторных батарей обусловлен их более низкой стоимостью и меньшим воздействием на окружающую среду.
Цели обучения
Обсудить общие характеристики аккумуляторов
Основные выводы
Ключевые моменты
- Перезаряжаемые батареи накапливают энергию за счет обратимой химической реакции, которая позволяет снова сохранять заряд после разрядки батареи.
- Перезаряжаемые батареи имеют более низкую общую стоимость использования и меньшее воздействие на окружающую среду, чем одноразовые батареи, что может быть причиной того, что спрос на аккумуляторные батареи в США растет намного быстрее, чем спрос на неперезаряжаемые батареи.
- Общие типы аккумуляторных батарей: свинцово-кислотные, никель-кадмиевые (NiCd), никель-металлогидридные (NiMH), литий-ионные (Li-ion), литий-ионные полимерные (LiPo) и перезаряжаемые щелочные батареи.
Ключевые термины
- вторичный элемент : электрический элемент, который можно перезаряжать, поскольку он преобразует химическую энергию в электрическую с помощью обратимой химической реакции.
- Плотность энергии : количество энергии, которое может храниться относительно объема батареи.
Аккумуляторы
Перезаряжаемая батарея — это тип электрической батареи, состоящей из одного или нескольких электрохимических элементов. Он известен как вторичный элемент, потому что его электрохимические реакции электрически обратимы. Другими словами, после того, как накопленный заряд был истощен, химические реакции батареи могут произойти снова, в обратном порядке, чтобы сохранить новый заряд.Спрос на аккумуляторные батареи в США растет вдвое быстрее, чем спрос на неперезаряжаемые батареи, отчасти потому, что аккумуляторные батареи оказывают меньшее воздействие на окружающую среду и общую стоимость использования, чем одноразовые.
Сетевые накопители энергии используют перезаряжаемые батареи для выравнивания нагрузки. Выравнивание нагрузки включает в себя хранение электроэнергии для использования в период пиковой нагрузки. Заряжая батареи в периоды низкого потребления электроэнергии для использования в периоды высокого спроса, выравнивание нагрузки помогает устранить необходимость в дорогостоящих пиковых электростанциях и помогает снизить стоимость генераторов в течение большего количества часов работы.
Конструкция аккумуляторной батареи
Как и все батареи, аккумуляторные батареи состоят из анода, катода и электролита. Во время зарядки материал анода окисляется, образуя электроны, а катод восстанавливается, потребляя электроны.
Зарядка аккумулятора : Схема зарядки аккумулятора.
Эти электроны составляют ток во внешней цепи. Электролит может служить простым буфером для внутреннего потока ионов между электродами, как в литий-ионных и никель-кадмиевых элементах, или он может быть активным участником электрохимической реакции, как в свинцово-кислотных элементах.
Типы аккумуляторных батарей
В аккумуляторных батареях обычно используется несколько различных комбинаций химикатов. Различные типы включают свинцово-кислотные, никель-кадмиевые (NiCd), никель-металлогидридные (NiMH), литий-ионные (Li-ion), литий-ионные полимерные (LiPo) и перезаряжаемые щелочные батареи.
Свинцово-кислотные батареи
Свинцово-кислотные батареи, изобретенные в 1859 году французским физиком Гастоном Планте, являются старейшим типом аккумуляторных батарей. Их способность обеспечивать высокие импульсные токи означает, что элементы поддерживают относительно большое отношение мощности к весу.Эти особенности, наряду с их низкой стоимостью, делают их привлекательными для использования в автомобилях, требующих больших токов.
Никель-металлогидридные батареи
Никель-металлгидридная батарея, сокращенно NiMH или Ni-MH, очень похожа на никель-кадмиевый элемент (NiCd). В NiMH батареях используются положительные электроды из оксигидроксида никеля (NiOOH), как и в NiCd, но в отрицательных электродах вместо кадмия используется сплав, поглощающий водород. Аккумулятор NiMH может иметь емкость в два-три раза больше, чем аккумулятор NiCd аналогичного размера, а его плотность энергии приближается к плотности литий-ионного элемента.
Литий-ионные батареи
Литий-ионный аккумулятор — это семейство перезаряжаемых аккумуляторов, в которых ионы лития перемещаются от отрицательного электрода к положительному во время разряда и обратно при зарядке. Отрицательный электрод обычного литий-ионного элемента сделан из углерода. Положительный электрод представляет собой оксид металла, а электролит представляет собой соль лития в органическом растворителе. Это один из самых популярных типов аккумуляторных батарей для портативной электроники, с одной из лучших плотностей энергии и лишь медленной потерей заряда, когда они не используются.Литий-ионные аккумуляторы дороже никель-кадмиевых аккумуляторов, но работают в более широком диапазоне температур, при этом они меньше и легче. Они хрупкие и поэтому нуждаются в схеме защиты для ограничения пикового напряжения.
Литий-ионные полимерные батареи
Литий-ионные полимерные (LiPo) батареи обычно состоят из нескольких идентичных вторичных ячеек, включенных параллельно, чтобы увеличить ток разряда. Они часто доступны в серии «упаковок» для увеличения общего доступного напряжения.Их основное отличие от литий-ионных аккумуляторов заключается в том, что их электролит из литиевой соли не содержится в органическом растворителе. Вместо этого он находится в твердом полимерном композите, таком как полиэтиленоксид или полиакрилонитрил. Преимущества LiPo по сравнению с литий-ионной конструкцией включают потенциально более низкую стоимость производства, приспособляемость к большому разнообразию форм упаковки, надежность и прочность. Их главный недостаток — меньший заряд.
Щелочные батареи
Существуют также перезаряжаемые формы щелочных батарей, которые представляют собой тип первичных батарей, зависящих от реакции между цинком (Zn) и диоксидом марганца (MnO 2 ).Они производятся полностью заряженными и способны сохранять заряд в течение многих лет, дольше, чем большинство никель-кадмиевых и никель-металлгидридных аккумуляторов, которые саморазряжаются. Перезаряжаемые щелочные батареи также могут иметь высокую эффективность перезарядки и оказывать меньшее воздействие на окружающую среду, чем одноразовые элементы.
Литий-ионный аккумулятор
Литий-ионные батареи — это перезаряжаемые батареи, обычно используемые в бытовой электронике; они полагаются на миграцию Li + .
Цели обучения
Обсудите химические превращения, происходящие в литий-ионной батарее во время зарядки и разрядки
Основные выводы
Ключевые моменты
- Превосходная плотность энергии, отсутствие эффекта памяти и только медленная потеря заряда, когда они не используются, делают литий-ионные батареи обычным явлением для использования в бытовой электронике, военных, электромобилях и аэрокосмической отрасли.
- Анод обычно представляет собой литийсодержащее соединение, а катод обычно представляет собой углеродсодержащее соединение.
- Реакция разрядки основана на том, что ион лития из электролита извлекается с катода и перемещается к аноду, в то время как в реакции зарядки происходит обратное.
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
Литий-ионные батареи (литий-ионные батареи или LIB) — это семейство аккумуляторных батарей, в которых ионы лития перемещаются от отрицательного электрода к положительному во время разряда. Ионы движутся по обратному пути, когда батарея заряжается. В литий-ионных батареях в качестве электродного материала используется соединение лития.
Применение литий-ионных батарей
Литий-ионные батареи широко используются в бытовой электронике.Они являются одними из самых популярных типов аккумуляторных батарей для портативной электроники, потому что они имеют одну из лучших плотностей энергии и только медленную потерю заряда, когда они не используются.
Литий-ионный аккумулятор для ноутбука : Литий-ионный аккумулятор подходит для использования в портативной электронике, включая ноутбуки.
Помимо бытовой электроники, LIB также становятся все популярнее для военных, электромобилей и аэрокосмической отрасли. Исследования дают поток улучшений традиционной технологии LIB с упором на плотность энергии, долговечность, стоимость и безопасность.
Типы литий-ионных батарей
Химический состав, производительность, стоимость и характеристики безопасности зависят от типа LIB. В портативной электронике в основном используются LIB на основе оксида лития-кобальта (LCO), которые обладают высокой плотностью энергии, но имеют хорошо известные проблемы безопасности, особенно при повреждении. Литий-железо-фосфатные (LFP), литиево-марганцевые (LMO) и литий-никель-марганцевые-кобальтовые (LiNMC) аккумуляторы обладают меньшей плотностью энергии, но более длительным сроком службы и собственной безопасностью. Эти химические составы или химические составы широко используются для питания электрических инструментов и медицинского оборудования.
Зарядка и разрядка
Три участника электрохимических реакций в литий-ионной батарее — это анод, катод и электролит. И анод, который представляет собой литийсодержащее соединение, и катод, который представляет собой углеродсодержащее соединение, являются материалами, в которые ионы лития могут мигрировать. Электролит представляет собой соль лития в органическом растворителе. Когда литиевая ячейка разряжается, положительный ион лития извлекается из катода и вставляется в анод, высвобождая накопленную энергию в процессе.Когда аккумулятор заряжается, происходит обратное.
Материалы для катодов и анодов
Самый популярный катодный материал — графит. Анод обычно представляет собой один из трех материалов: слоистый оксид (например, оксид лития-кобальта), полианион (например, фосфат лития-железа) или шпинель (например, оксид лития-марганца). Электролит обычно представляет собой смесь органических карбонатов, таких как этиленкарбонат или диэтилкарбонат, содержащих комплексы ионов лития.
В литий-ионной батарее ионы лития транспортируются к катоду или аноду и от них. Переходный металл, кобальт (Co), окисляется с Co 3+ до Co 4+ во время зарядки и восстанавливается с Co 4+ до Co 3+ во время разряда.
Топливные элементы
Топливные элементы — отличная альтернатива батареям, но они все еще находятся на ранней стадии разработки.
Цели обучения
Обсудить работу типичного топливного элемента
Основные выводы
Ключевые моменты
- Топливный элемент — это устройство, которое преобразует химическую энергию топлива в электричество посредством химической реакции с кислородом или другим окислителем.
- Батареи работают в замкнутой системе, а топливные элементы требуют пополнения своих реагентов.
- Использование водорода в качестве основного источника топлива в топливных элементах имеет несколько плюсов и минусов, которые делают его спорным для массового использования.
- Топливные элементы состоят из трех смежных сегментов: анода, электролита и катода.
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- топливный элемент : устройство, преобразующее химическую энергию топлива в электричество посредством химической реакции с кислородом или другим окислителем.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
- аккумулятор : устройство, вырабатывающее электричество в результате химической реакции между двумя веществами.
Введение и история
Топливный элемент — это устройство, которое преобразует химическую энергию топлива в электричество посредством химической реакции с кислородом или другим окислителем.Наиболее распространенным топливом является водород, но иногда используются углеводороды, такие как природный газ и спирты. Топливные элементы отличаются от батарей тем, что для их работы требуется постоянный источник топлива и кислорода, но они могут производить электричество непрерывно, пока есть эти входы. Разработка миниатюрных топливных элементов может стать дешевой, эффективной и многоразовой альтернативой батареям.
Уильям Гроув разработал первые неочищенные топливные элементы в 1839 году. Первое коммерческое использование топливных элементов было в космических программах НАСА для выработки энергии для зондов, спутников и космических капсул.В настоящее время топливные элементы используются в качестве основного и резервного источника питания для коммерческих, промышленных и жилых зданий, а также в удаленных или труднодоступных районах. Они используются для привода транспортных средств на топливных элементах, включая автомобили, автобусы, вилочные погрузчики, самолеты, лодки, мотоциклы и подводные лодки.
Устройство и функции топливного элемента
Существует много типов топливных элементов, но все они состоят из анода, который является отрицательной стороной, катода, который является положительной стороной, и электролита, который позволяет зарядам перемещаться между двумя сторонами топливного элемента.
Топливный элемент : Топливный элемент преобразует химическую энергию топлива в электричество посредством химической реакции с кислородом или другим окислителем. Однако использование водорода в качестве основного источника топлива в топливных элементах имеет несколько плюсов и минусов, которые делают его спорным для массового использования.
Электроны притягиваются от анода к катоду через внешнюю цепь, производя электричество постоянного тока. Топливные элементы классифицируются по используемому электролиту, что является основным различием между различными типами топливных элементов.Отдельные топливные элементы создают относительно небольшие электрические потенциалы, около 0,7 вольт, поэтому элементы «уложены друг на друга» или размещены последовательно для увеличения напряжения. Помимо электроэнергии, топливные элементы производят воду, тепло и, в зависимости от источника топлива, очень небольшие количества диоксида азота и другие выбросы. Энергоэффективность топливного элемента обычно составляет 40-60 процентов; он может достигать 85 процентов, если отходящее тепло улавливается для использования.
Несмотря на разнообразие типов топливных элементов, все они работают одинаково.На границах трех разных сегментов происходят две химические реакции. Конечным результатом этих двух реакций является потребление топлива, образование воды или углекислого газа и создание электрического тока, который можно использовать для питания электрических устройств, обычно называемых «нагрузкой».
На аноде катализатор окисляет топливо, обычно водород, превращая топливо в положительно заряженный ион и отрицательно заряженный электрон. Электролит — это вещество, специально разработанное таким образом, чтобы ионы могли проходить через него, а электроны — нет.Освободившиеся электроны проходят по проводу, создавая электрический ток. Ионы проходят через электролит к катоду. Там ионы воссоединяются с электронами, и два реагируют с третьим химическим веществом, обычно кислородом, с образованием воды или углекислого газа.
Плюсы и минусы топливных элементов
Использование водородных топливных элементов в некоторых приложениях вызывает споры. Прежде всего, поскольку энергия, используемая для производства водорода, сравнима с энергией в водороде , это неэффективно и, следовательно, дорого.Если бы для производства водорода использовались обычные электростанции, в лучшем случае не было бы положительных изменений в текущих уровнях загрязнения. Другие типы топливных элементов не сталкиваются с этой проблемой. Например, биологические топливные элементы берут глюкозу и метанол из пищевых отходов и превращают их в водород и пищу для бактерий, которые его расщепляют.
Однако у водородных топливных элементов есть несколько преимуществ. Если электричество, произведенное из чистых возобновляемых источников энергии, таких как солнечная и ветровая энергия, используется для производства водорода, энергия может храниться легче, чем в больших аккумуляторных комплексах.
Есть и практические проблемы, которые необходимо преодолеть. Хотя использование топливных элементов в потребительских товарах возможно в ближайшем будущем, большинство современных конструкций не будут работать, если их перевернуть. Кроме того, существующие топливные элементы нельзя масштабировать до небольшого размера, необходимого для портативных устройств, таких как сотовые телефоны. Современные конструкции также требуют вентиляции и поэтому не могут работать под водой. Их нельзя использовать в самолетах из-за риска утечки топлива через вентиляционные отверстия. Наконец, еще не созданы технологии для безопасной заправки топливных элементов потребителей.
Топливный элемент в автомобиле : Топливный элемент является потенциальным источником энергии для автомобилей, которые не работают на бензине. Однако, хотя топливные элементы предлагают чистую возобновляемую энергию, есть несколько препятствий на пути их широкого распространения.
| A123 Systems (США) . Производит литий-ионные аккумуляторы нового поколения с фосфатным положительным электродом нанометрового размера, разработанные в M.I.T |
| A&T Battery Company (Япония) .Совместное предприятие Asahi Chemical и Toshiba по производству литий-ионных аккумуляторов. В 2000 году Toshiba приобрела долю Asahi |
| ATL (Amperex Technology Ltd, Гонконг) . Производит литий-ионные полимерные аккумуляторы |
| БАК (Китай) . Подписал соглашение с A123 на производство новых литий-ионных аккумуляторов на основе фосфата (см. Выше) |
| BYD Battery (Китай) . Производит все типы аккумуляторов. Сейчас занимает 3-е место в мире по производству |
| Duracell (США) .Производитель небольших первичных батарей, использующих щелочные марганцевые, литиевые, оксид серебра и системы с воздушными элементами. Перепродает аккумуляторы других производителей. Подразделение Gillette |
| Cobasys (США) . Ранее Ovonic Battery. Производит никель-металлгидридные аккумуляторы |
| E-One Energy (Тайвань) . В 2000 году приобрела NEC-Moli Energy, первого производителя литиевых аккумуляторных батарей (система Li-MoS 2 ). Производство литий-ионных элементов начато в 1994 г. |
| Energizer Battery Company (США) .Ранее Eveready. Основной производитель первичных батарей: Zn – C, стандартные щелочные батареи, оксид серебра, литиевые и воздушные элементы. |
| Fuji Electrochemical (Япония) . Один из первых производителей Zn – C и щелочных батарей. Сейчас также производит литий-ионные и литий-ионные элементы. Настоящее название: FDK |
| GP Batteries (Гонконг) . Производит несколько основных и перезаряжаемых элементов под названием Gold Peak |
| Hitachi – Maxell (Япония) .Производит Zn – C, щелочные и различные батарейки для монет и кнопок. Крупный производитель небольших тионилхлоридных ячеек для резервного копирования памяти. Производит литий-ионные элементы |
| Japan Storage Battery (JSB, Япония) . Крупнейший производитель свинцово-кислотных элементов в Японии. Совместное предприятие с SAFT для Ni – Cd и Ni – MH. Производит литий-ионные элементы со своей дочерней компанией GS-Melcotec. В 2002 году Sanyo приобрела 51% GS |
| LG Chemical (Корея) . Производит литий-ионные аккумуляторы |
| Lishen Battery (Китай) .Производит большинство типов аккумуляторов |
| Matsushita Industrial Battery Company (Япония) . Полнофункциональный поставщик аккумуляторов, производящий свинцово-кислотные, Ni-Cd, Zn-C, щелочные, цинк-воздушные, Li-CF x , Li-MnO 2 , Ni-MH, литий-ионные и цинк – оксид серебра. Продукция Matsushita обеспечивает внутренний рынок OEM для аккумуляторов. Рынки под маркой Panasonic и стремятся стать крупнейшим производителем аккумуляторов в мире |
| NEC (Япония) .Производит литий-ионные элементы, в том числе с LiMn 2 O 4 катодами |
| Polaroid (США) . Изготавливает тонкие плоские ячейки Zn – C для использования в упаковках из пленки |
| Promeon, Division of Medtronics (США) . Производитель Li – I 2 , Li – SOCl 2 , Li – SVO и Li – MnO 2 элементов для имплантируемых и других медицинских применений |
| Rayovac (США) . Первичные элементы: Zn – C, щелочные, цинк – оксид серебра, Li – CF x и воздушные системы.В 1993 году представила перезаряжаемые щелочные элементы. |
| Renata (Швейцария) . Производит миниатюрные элементы для часовой промышленности |
| SAFT (Франция) . Специализируется на промышленных, OEM и военных батареях, включая все аккумуляторные. Приобретен компанией Tadiran (Израиль) в 2000 г. |
| Samsung (SDI, Корея) . Основной поставщик первичных и усовершенствованных аккумуляторных батарей |
| Sanyo (Япония) .Крупнейшая в мире аккумуляторная компания. Один из первых производителей Ni – Cd и Ni – MH элементов, претендует на 40% Ni – Cd и 70% на мировых рынках Ni – MH. Также крупный производитель литий-ионных аккумуляторов |
| Seiko (Япония) . Производит элементы для монет и кнопок в ряде систем, в основном для внутреннего использования в часах |
| Sony EnergyTec (Япония) . Производство небольших размеров высококачественных Zn – C и щелочных элементов, а также монетных и кнопочных элементов с анодами из Zn и Li. Первоначальный разработчик литий-ионных аккумуляторов, которые используются во всех продуктах Sony |
| Tadiran (Израиль, США) .В основном производит первичные литиевые батареи |
| TCL Hyperpower Batteries (Китай) . Производит разные типы аккумуляторов, в том числе Li-ion |
| Toshiba (Япония) . Крупный производитель Zn – C и щелочных элементов, а также Ni – MH, Ni – Cd и цинка – воздуха. Приобретена доля Asahi Chemical в A&T (см. Выше) для литий-ионных элементов в 2000 г. |
| Ultralife Batteries (США) . Приобретена технология Eastman Kodak Li – MnO 2 для первичных батарей.Производит первичные литиевые батареи и литий-ионные батареи |
| Valence Technology (США) . Производитель литий-ионных (в том числе полимерных) аккумуляторов с марганцевой шпинелью и LiFePO 4 положительных электродов |
| Varta Microbatteries (Германия) . Производитель миниатюрных батарей (несколько систем) для мобильной связи, медицинского и электронного оборудования |
| Wilson Greatbatch (США) . Производитель литиевых батарей для медицинского и специализированного коммерческого применения.Первый производитель батарей для имплантируемых дефибрилляторов |
| Yuasa Battery (Япония) . Производитель Pb – кислотных (также SLA), Ni – Cd и Ni – MH |
Управление бытовыми батареями
Управление бытовыми батареямиБытовые батареи, широко известные как сухие батареи, состоят из анода, катода и электролита. Анод — это положительный вывод, катод — отрицательный вывод, а электролит — это химический раствор, через который электроны текут от анода к катоду, создавая электрический заряд.В катодах и анодах используются различные металлы. В следующем резюме представлена общая информация о химическом составе и способах утилизации бытовых батарей .
Никель-кадмиевые батареи
Никель-кадмиевые батареи состоят из никелевого катода, кадмиевого анода и щелочного раствора для электролита. Эти батареи являются перезаряжаемыми и используются как в традиционных цилиндрических батареях, так и в самых разнообразных аккумуляторных блоках. Батарейные блоки используются в таких устройствах, как беспроводные телефоны, видеокамеры, ручные пылесосы и беспроводные электроинструменты.Кадмий — токсичный металл, который может представлять угрозу для здоровья человека и окружающей среды. Никель-кадмиевые батареи имеют химический символ Ni-Cd.
Никель-кадмиевые батареи подлежат обязательной переработке в Коннектикуте. Call2Recycle — это организация производителей аккумуляторов, которая разработала программу сбора и переработки своих никель-кадмиевых аккумуляторов. Программа финансируется Call2Recycle. Производители батарей выкупают кадмий после его переработки для использования в батареях следующего поколения.Эти никель-кадмиевые батареи могут быть переработаны в ряде участвующих точек розничной продажи, включая большинство магазинов Radio Shack и Walmart. Для получения информации о том, где утилизировать никель-кадмиевые батареи в вашем регионе, позвоните по телефону 1-800-8BATTERY или войдите на веб-сайт Call2Recycle по адресу www.call2recycle.org.
Щелочные и угольно-цинковые батареи
Щелочные и угольно-цинковые батареи обычно содержат катод из диоксида марганца и цинковый анод. Электролит в щелочной батарее обычно представляет собой гидроксид калия или гидроксид натрия, тогда как в углеродно-цинковой батарее электролитом является хлорид аммония или хлорид цинка.Они составляют около 70% рынка аккумуляторов. Раньше ртуть добавлялась для предотвращения коррозии и образования газообразного водорода. Недавние законы ограничили допустимые уровни ртути в щелочных и угольно-цинковых батареях. Сегодня щелочные батареи, представленные на рынке, должны содержать ртуть с нулевым добавлением ртути.
Возможности утилизации щелочных батарей ограничены. Основным препятствием для переработки щелочных батарей было присутствие ртути. С появлением ртути с нулевым добавлением ртути экономические показатели переработки щелочных батарей должны быть более благоприятными, и мы можем увидеть больше предприятий по переработке.Преимущества утилизации аккумуляторов заключаются в экономии энергии при повторном использовании продукта по сравнению с добычей нетронутого ресурса.
Щелочные и угольно-цинковые батареи можно утилизировать вместе с обычным мусором, если нет возможности утилизации на месте. INMETCO, предприятие по утилизации металлов в Пенсильвании, перерабатывает щелочные и угольно-цинковые батареи. (724) 758-2800.
Маленькие герметичные свинцово-кислотные батареи
Маленькие герметичные свинцово-кислотные батареи являются перезаряжаемыми и используются в видеокамерах, беспроводных телефонах и электроинструментах.Они содержат катод из диоксида свинца или сульфата свинца, свинцовый анод и сернокислый электролит. Эти небольшие герметичные свинцово-кислотные батареи могут быть переработаны в ряде участвующих точек розничной торговли, включая большинство магазинов Radio Shack и Walmart. Для получения информации о том, где утилизировать небольшие герметичные свинцово-кислотные батареи в вашем регионе, позвоните по телефону 1-800-8BATTERY или войдите на веб-сайт Call2Recycle по адресу www.call2recycle.org/.
Литий-ионные батареи
Литий-ионные батареи— это перезаряжаемые батареи, которые чаще всего используются в цифровых фотоаппаратах, сотовых телефонах и портативных компьютерах.Они содержат металлический оксид лития в качестве катода и углеродный материал в качестве анода. Электролит представляет собой соль лития. Полностью разряженные литиевые батареи не представляют опасности и могут быть безопасно выброшены в мусор. Однако они могут быть переработаны в рамках программы RBRC. Позвоните по телефону 1-800-8BATTERY или войдите на сайт Call2Recycle по адресу www.call2recycle.org/.
Металлогидрид никеля
Никель-металлогидридные батареи более безопасны для окружающей среды, чем никель-кадмиевые, из-за отсутствия токсичного кадмия.Анод — это металлический сплав, поглощающий водород, а катод — оксид никеля. Электролит — гидроксид калия. Эти батареи являются перезаряжаемыми и используются в видеокамерах, электроинструментах и сотовых телефонах. Они имеют многие из тех же рабочих характеристик, что и никель-кадмий. Они обозначены символом NiMH.
Батарейки из оксида серебра
Батарейки из оксида серебра — это кнопочные элементы, обычно используемые в часах, калькуляторах и слуховых аппаратах. Они содержат цинковый анод, катод из оксида серебра и щелочной раствор для электролита.Эти батареи подлежат переработке из-за ценности серебра. Большинство ювелирных магазинов утилизируют батарею из оксида серебра, когда вы приносите часы для замены батареи.
Литиевые батарейки
Литиевые батареи— это кнопочные элементы, которые используются в основном для фотоаппаратов и содержат литиевый анод, а также различные типы катодов и электролиты. Литиевые батареи в настоящее время не перерабатываются. Литий — это металл с высокой реакционной способностью, и при его сборе с другими кнопочными элементами он может представлять опасность, если не полностью разряжен.Полностью разряженная литиевая батарея преобразует литий в различные соединения лития, которые являются инертными и нетоксичными. Литиевые батареи не содержат ртути. Если установлено, что литиевая батарейка полностью израсходована, ее можно безопасно выбросить в обычную мусорную корзину.
Воздушно-цинковые батареи
Воздушно-цинковые батареи — это кнопочные элементы, используемые в основном для слуховых аппаратов. У них есть цинковый анод, кислород из атмосферного воздуха, который действует как катод, и щелочной раствор как электролит.В настоящее время существует ограниченная переработка имеющихся в наличии воздушно-цинковых батарей (INMETCO будет перерабатывать батареи таблеточного типа — 724 758-2800).
Для получения дополнительной информации свяжитесь с Томом Метцнером по телефону (860) 424-3242 или по почте:
Министерство энергетики и охраны окружающей среды
79 Elm Street
Hartford, CT 06106-5127
Контент Последнее обновление: январь 2020 г.
17.5 Батареи и топливные элементы — химия
Цели обучения
К концу этого раздела вы сможете:
- Батареи классифицируются как первичные или вторичные
- Перечислите некоторые характеристики и ограничения аккумуляторов
- Дайте общее описание топливного элемента
Батарея — это электрохимический элемент или серия элементов, вырабатывающих электрический ток.В принципе, в качестве аккумулятора можно использовать любой гальванический элемент. Идеальная батарея никогда не разряжалась бы, не вырабатывала постоянного напряжения и была способна выдерживать экстремальные температуры и влажность окружающей среды. Настоящие аккумуляторы обеспечивают баланс между идеальными характеристиками и практическими ограничениями. Например, масса автомобильного аккумулятора составляет около 18 кг или около 1% от массы среднего автомобиля или малотоннажного грузовика. Этот тип батареи будет обеспечивать почти неограниченное количество энергии, если используется в смартфоне, но будет отклонен для этого приложения из-за своей массы.Таким образом, ни одна батарея не является «лучшей», и батареи выбираются для конкретного применения с учетом таких вещей, как масса батареи, ее стоимость, надежность и текущая емкость. Батареи бывают двух основных типов: первичные и вторичные. Далее описаны несколько батарей каждого типа.
Посетите этот сайт, чтобы узнать больше об аккумуляторах.
Первичные батареи — это одноразовые батареи, потому что они не подлежат перезарядке. Обычная первичная батарея — это сухой элемент (рис. 1).{-} [/ latex] с общим потенциалом элемента, который изначально составляет около 1,5 В, но уменьшается по мере использования батареи. Важно помнить, что напряжение, подаваемое батареей, одинаково независимо от ее размера. По этой причине все батареи D, C, A, AA и AAA имеют одинаковое номинальное напряжение. Однако более крупные батареи могут доставить больше молей электронов. Поскольку цинковый контейнер окисляется, его содержимое в конечном итоге вытекает, поэтому этот тип батареи не следует оставлять в любом электрическом устройстве на длительное время.
Рис. 1. На схеме показано поперечное сечение батареи фонарика, углеродно-цинкового сухого элемента.Посетите этот сайт, чтобы узнать больше о угольно-цинковых батареях.
Щелочные батареи (рис. 2) были разработаны в 1950-х годах отчасти для решения некоторых проблем с производительностью сухих цинк-угольных элементов. Они производятся, чтобы быть точной заменой сухих угольно-цинковых элементов. Как следует из названия, в этих типах батарей используются щелочные электролиты, часто гидроксид калия.{\ circ} = +1.43 \; \ text {V} \ end {array} [/ latex]
Щелочная батарея может обеспечивать в три-пять раз больше энергии, чем угольно-цинковые сухие элементы аналогичного размера. Щелочные батареи склонны к утечке гидроксида калия, поэтому их также следует снимать с устройств для длительного хранения. Некоторые щелочные батареи можно перезаряжать, но большинство — нет. Попытки перезарядить щелочную батарею, которая не является перезаряжаемой, часто приводят к разрыву батареи и утечке электролита гидроксида калия.
Рис. 2. Щелочные батареи были разработаны как прямая замена угольно-цинковых (сухих) батареям.Посетите этот сайт, чтобы узнать больше о щелочных батареях.
Вторичные батареи перезаряжаемые. Это типы батарей, которые используются в таких устройствах, как смартфоны, электронные планшеты и автомобили.
Никель-кадмиевые батареи или NiCd (рис. 3) состоят из никелированного катода, кадмиевого анода и электрода из гидроксида калия.{-} (aq) \\ [0.5em] \ hline \\ [- 0.25em] \ text {total:} & \ text {Cd} (s) \; + \; \ text {NiO} _2 (s) \; + \; 2 \ text {H} _2 \ text {O} (l) & \ text {Cd (OH)} _ 2 (s) \; + \; \ text {Ni (OH)} _ 2 (s) \ end {array} [/ latex]
Напряжение составляет от 1,2 В до 1,25 В по мере разряда батареи. При правильном обращении никель-кадмиевый аккумулятор можно заряжать около 1000 раз. Кадмий — это токсичный тяжелый металл, поэтому никель-кадмиевые батареи нельзя открывать или выбрасывать в обычный мусор.
Рис. 3. Никель-кадмиевые батареи имеют конструкцию типа «желеобразный», которая значительно увеличивает ток, который может выдать батарея, по сравнению с щелочной батареей аналогичного размера.{-} \; + \; x \; \ text {C} _6 & x \; \ text {LiC} _6 \\ [0.5em] \ hline \\ [- 0.25em] \ text {total:} & \ текст {LiCoO} _2 \; + \; x \; \ text {C} _6 & \ text {Li} _ {x \; — \; 1} \ text {CoO} _2 \; + \; x \; \ текст {LiC} _6 \ end {array} [/ latex]С коэффициентами, представляющими моль, x составляет не более примерно 0,5 моля. Напряжение батареи составляет около 3,7 В. Литиевые батареи популярны, потому что они могут обеспечивать большой ток, легче, чем сопоставимые батареи других типов, вырабатывают почти постоянное напряжение при разряде и медленно теряют заряд при хранении.
Рис. 4. В литий-ионной батарее заряд протекает между электродами, когда ионы лития перемещаются между анодом и катодом.Посетите этот сайт для получения дополнительной информации о литий-ионных батареях.
Свинцово-кислотная батарея (рис. 5) — это тип аккумуляторной батареи, используемой в вашем автомобиле. Он недорогой и способен производить большой ток, необходимый для автомобильных стартеров. {- } \\ [0.{-} & \ text {PbSO} _4 (s) \; + \; 2 \ text {H} _2 \ text {O} (l) \\ [0.5em] \ hline \\ [- 0.25em] \ text {общее:} & \ text {Pb} (s) \; + \; \ text {PbO} _2 (s) \; + \; 2 \ text {H} _2 \ text {SO} _4 (aq) & 2 \ text {PbSO} _4 (s) \; + \; 2 \ text {H} _2 \ text {O} (l) \ end {array} [/ latex]
Каждая ячейка выдает 2 В, поэтому шесть ячеек соединены последовательно, чтобы получить 12-вольтовый автомобильный аккумулятор. Свинцово-кислотные батареи тяжелые и содержат едкий жидкий электролит, но часто по-прежнему являются предпочтительными батареями из-за их высокой плотности тока. Поскольку эти батареи содержат значительное количество свинца, их всегда следует утилизировать надлежащим образом.
Рис. 5. Свинцово-кислотный аккумулятор в вашем автомобиле состоит из шести ячеек, соединенных последовательно, чтобы обеспечить напряжение 12 В. Их низкая стоимость и высокий выходной ток делают их отличными кандидатами для питания автомобильных стартеров.Посетите этот сайт для получения дополнительной информации о свинцово-кислотных аккумуляторах. {-} \\ [0.{2-} \\ [0.5em] \ hline \\ [- 0.25em] \ text {total:} & 2 \ text {H} _2 \; + \; \ text {O} _2 & 2 \ text {H } _2 \ text {O} \ end {array} [/ latex]
Напряжение составляет около 0,9 В. КПД топливных элементов обычно составляет от 40% до 60%, что выше, чем у обычного двигателя внутреннего сгорания (от 25% до 35%), и в случае водородного топливного элемента дает только вода в качестве выхлопа. В настоящее время топливные элементы довольно дороги и содержат функции, которые приводят к их выходу из строя через относительно короткое время.
Перейдите по этой ссылке, чтобы узнать больше о топливных элементах.
Батареи — это гальванические элементы или серия элементов, вырабатывающих электрический ток. Когда элементы объединяются в батареи, потенциал батареи является целым числом, кратным потенциалу отдельной ячейки. Батареи бывают двух основных типов: первичные и вторичные. Первичные батареи предназначены для одноразового использования и не подлежат перезарядке. Сухие элементы и (большинство) щелочные батареи являются примерами первичных батарей. Второй тип перезаряжаемый и называется вторичным аккумулятором. Примеры вторичных батарей включают никель-кадмиевые (NiCd), свинцово-кислотные и литий-ионные батареи.Топливные элементы похожи на батареи в том, что они генерируют электрический ток, но требуют постоянного добавления топлива и окислителя. Водородный топливный элемент использует водород и кислород из воздуха для производства воды и обычно более эффективен, чем двигатели внутреннего сгорания.
Химия: упражнения в конце главы
- Каковы желаемые качества электрической батареи?
- Перечислите некоторые моменты, которые обычно учитываются при выборе батареи для нового приложения.
- Рассмотрим батарею, состоящую из одного полуэлемента, состоящего из медного электрода в растворе 1 M CuSO 4 и другого полуэлемента, состоящего из свинцового электрода в 1 M Pb (NO 3 ) 2 раствор. {\ circ} = -0.{\ circ} = +0,53 \; \ text {V} \ end {array} [/ latex]
Подойдет ли этот аккумулятор для смартфонов? Почему или почему нет?
- Почему батареи выходят из строя, а топливные элементы — нет?
- Объясните, что происходит с напряжением батареи при использовании батареи, используя уравнение Нернста.
- Используя информацию, полученную до сих пор в этой главе, объясните, почему электроника с батарейным питанием плохо работает при низких температурах.
Глоссарий
- щелочная батарея
- первичная батарея, в которой используется щелочной (часто гидроксид калия) электролит; спроектирован так, чтобы быть точной заменой сухого элемента, но с большим накоплением энергии и меньшей утечкой электролита, чем типичный сухой элемент
- аккумулятор
- гальванический элемент или серия ячеек, вырабатывающих ток; по идее любой гальванический элемент
- сухая камера
- первичная батарея, также называемая угольно-цинковой батареей; может использоваться в любой ориентации, поскольку в качестве электролита используется паста; имеет тенденцию к утечке электролита при хранении
- топливный элемент
- устройств, вырабатывающих электрический ток при непрерывной добавке топлива и окислителя; эффективнее двигателей внутреннего сгорания
- свинцово-кислотный аккумулятор
- аккумуляторная батарея, состоящая из нескольких ячеек; свинцово-кислотный аккумулятор, используемый в автомобилях, имеет шесть ячеек и напряжение 12 В
- литий-ионный аккумулятор
- очень популярная аккумуляторная батарея; использует ионы лития для проведения тока, легкий, перезаряжаемый и создает почти постоянный потенциал при разряде
- никель-кадмиевый аккумулятор
- (NiCd аккумулятор) вторичная батарея, в которой используется кадмий, который является токсичным тяжелым металлом; тяжелее литий-ионных батарей, но с аналогичными характеристиками
- первичная батарея
- одноразовый неперезаряжаемый аккумулятор
- аккумулятор
- аккумулятор с возможностью подзарядки
Решения
Ответы на упражнения в конце главы по химии
2. {\ circ} = 0.{\ circ} = 0,7996 \; \ text {V} \ end {array} [/ latex]; (б) 3,5 × 10 15 ; (в) 5.6 × 10 −9 M
6. Батареи автономны и имеют ограниченный запас реагентов, которые нужно расходовать до того, как они сойдут с мертвой точки. В качестве альтернативы, побочные продукты реакции аккумулятора накапливаются и мешают реакции. Поскольку топливный элемент постоянно пополняется реагентами, а продукты удаляются, он может продолжать работать до тех пор, пока поступают реагенты.
8. E ячейка , как описано в уравнении Нернста, имеет член, прямо пропорциональный температуре.При низких температурах этот член уменьшается, что приводит к более низкому напряжению элемента, подаваемому батареей на устройство — тот же эффект, что и разряженная батарея.
Щелочно-металлические батареи: предотвращение выхода из строя
Перезаряжаемые батареи, содержащие электрохимические элементы с анодами из щелочных металлов, являются многообещающей альтернативой обычным литий-ионным батареям.Однако стабильность и срок службы этих элементов уменьшаются из-за механизмов отказа, включая электроосаждение дендритных наростов на аноде, образование внутренних коротких замыканий и потери электролита в результате реакций между электролитом и высокореактивным анодом.
Предоставлено: Юрий Гармаш / Getty
Для защиты анодов в электрохимические ячейки могут быть встроены межфазные твердые электролиты (SEI); однако они не должны мешать переносу ионов в клетках.В статье Nature Energy Линден Арчер и его коллеги сообщают об использовании искусственного SEI, который не только защищает анод от этих механизмов отказа, но также позволяет сохранять заряд. Искусственный SEI получают путем нанесения Sn на анод из Li или Na. «Если эти электрохимически активные покрытия Sn предназначены для облегчения быстрого переноса заряда между электролитом и лежащим под ним анодом из щелочного металла, можно будет устранить основную причину отказа без ущерба для общей емкости электрода», — говорит Арчер.
«Ключевым нововведением в нашей системе является создание гибридных анодов, в которых Sn-покрытия пассивируют щелочной металл»
Для получения Sn-покрытия на анодах в карбонатный электролит добавляют Sn-содержащую соль. «Благодаря простой химии ионного обмена между Sn-содержащей солью и анодом из Li или Na, можно создавать электрохимически активные покрытия Sn, а толщина покрытий регулируется концентрацией соли-носителя в растворе. , — объясняет Арчер.Аноды, покрытые оловом, имеют очень большую плотность тока обмена, то есть ионы щелочных металлов легко перемещаются между электролитом и нижележащим электродом из щелочного металла. «Путем прямых визуальных исследований электроосаждения Sn на анодах Li, а также на заведомо нестабильных электродах Na, наше исследование показывает, что покрытия Sn действительно могут задерживать грубое дендритное электроосаждение щелочных металлов и, в то же время, ограничивать их паразитные реакции. с компонентами электролита », — говорит Арчер.
«Ключевым нововведением в нашей системе является создание гибридных анодов, в которых Sn-покрытия пассивируют щелочной металл, а также способны накапливать значительные количества заряда в результате реакций легирования», — заявляет Арчер. Преимущество этого подхода заключается в том, что при условии, что материалы покрытия обладают высокой внутренней способностью накапливать Li, например Sn, Si и In, межфазные границы, сформированные на аноде, могут быть спроектированы с такой толщиной, которая оптимизирует их защитную функцию, не добавляя при этом значительного увеличения общий вес электрода.
Об этой статье
Цитируйте эту статью
Stoddart, A. Щелочные металлические батареи: предотвращение выхода из строя. Nat Rev Mater 3, 18021 (2018). https://doi.org/10.1038/natrevmats.2018.21
Скачать цитату
Почему батареи протекают?Когда вы открываете мертвого фонариком вы можете обнаружить разноцветный шрам.Белая пудровая гадость и коррозия клемм. Углеродно-цинковая батарея фонарика состоит из цинкового банка с диоксидом марганца и жидкостью. Жидкость — вода с растворенный в нем хлорид аммония или хлорид цинка. Батарея протекает, когда цинковая банка растворена. Жидкость в этот момент может содержать хлорид аммония. и хлорид цинка. Также в качестве разделителя используется крахмальная паста, и это также может вытекать. Когда батарея полностью разряжена выбрасываемые продукты реакции включают гидроксид марганца, цинк-аммоний. хлорид, аммиак, хлорид цинка, оксид цинка и вода. Итак, для углеродного цинка Аккумуляторная белая гадость представляет собой смесь этих соединений и крахмала. Ни один из они токсичны, фактически все они могут быть использованы в качестве удобрений. Но ПОЧЕМУ они протекают? В заряд батареи происходит в результате химической реакции, в которой потребляется цинк.Цинк может со временем растворяться из-за основных реакций и других побочных реакций, поэтому вероятность протечки выше, если его оставить для разряда, даже если он мертвым, как когда ваш пятилетний ребенок оставляет фонарик включенным и прячет его под его кровать. Щелочные батарейки очень похожи на угольно-цинковые батареи. Они используют диоксид марганца и металлический цинк. в качестве реактивных материалов, но они используют щелочной гидроксид калия раствор электролита вместо слабокислого хлорида аммония.Продуктами реакции являются оксид марганца и оксид цинка с побочными продуктами гидроксид марганца и гидроксид цинка. Итак, белый остаток состоит из оксид марганца, оксид цинка, гидроксид калия, гидроксид цинка и марганец гидроксид. Вскоре после просачивания гидроксид калия вступает в реакцию с углеродом. диоксид в воздухе с образованием карбоната калия. Опять же, ни один из этих химикатов токсичен, и все это можно использовать в качестве удобрений. Некоторые люди посмотрят паспорт безопасности материала и увидят, что там электролит гидроксида калия и предупредить вас, что он вызывает коррозию и может съесть вашу кожу и ослепить вас.Свободной жидкости нет, она вся абсорбируется в компоненты батареи. Если порезал аккум и размазал черный порошка диоксида марганца на руках, вы можете почувствовать скользкость, так как Щелок превращает кожный жир в мыло. Но как уже говорилось выше, несколько часов Воздействие атмосферного углекислого газа преобразует КОН в K2CO3, который совершенно безопасно. КОН хорошо растворим, а карбонат калия — нет. так много, что является тестом, чтобы увидеть, произошла ли реакция.В фонарике проникновение СО2 происходит медленно, поэтому КОН успевает разъедать внутренности фонарик. Но ПОЧЕМУ щелочные батареи протекают? Есть побочные реакции, при которых образуется газообразный водород — в основном
цинк расщепляет воду. Этот газ будет повышать давление и
в конечном итоге вентилируйте, вытесняя с собой часть жидкого электролита.
Производители когда-то использовали ртуть для образования нереактивной пленки на цинке.
чтобы предотвратить это, но, конечно же, из-за правительственного мандата ртуть больше не
используется в щелочных батареях. |
