устройство, виды и принцип работы АКБ, а также срок службы и характеристики батареи
Электрические аккумуляторные батареи применяются в любом автомобиле и представляют собой автономный источник питания. АКБ накапливает энергию, которая затем питает бортовую сеть, когда это необходимо, и подает ток на стартер для запуска двигателя.
Назначение аккумулятора в автомобиле
Автомобильный аккумулятор принято обозначать аббревиатурой АКБ, что значит аккумуляторная кислотная батарея. Не все батареи относятся к этому типу, но в автомобилях наиболее распространены именно они.

 Автомобильный аккумулятор
Автомобильный аккумуляторАккумулятор является важным компонентом в работе любого транспортного средства. Он выполняет следующие основные функции:
- Подача электроэнергии на стартер для запуска двигателя. Аккумулятор способен в течение 30 секунд подавать пусковой ток или ток холодной прокрутки на стартер, который, в свою очередь, запускает двигатель.
- Питание бортовой сети в случае недостаточной мощности (производительности) генератора.
- Автономное питание бортовой сети автомобиля.
Каждый аккумулятор имеет определенную емкость и заряд. При работе двигателя всю нагрузку на электропитание берет на себя генератор. Он же заряжает аккумулятор во время движения. Если мощности не хватает, подключается батарея. Определенное время АКБ может обеспечить автономное питание.
Генератор выходит на оптимальный режим производительности при достижении двигателем частоты вращения коленчатого вала 1600-1800 об/мин и более.
Располагается АКБ, как правило, в подкапотном пространстве автомобиля или закреплен на раме в случае крупного грузового транспорта. Это связано с тем, что кислота, находящаяся внутри, очень агрессивна и опасна для здоровья. Она может просочиться через корпус или выделиться в виде газа. С аккумулятором следует обращаться осторожно.
Более безопасны необслуживаемые АКБ, внутри которых нет жидкого электролита. Такие батареи практически не выделяют вредных паров и их можно использовать где угодно. Среди альтернативных мест размещения аккумулятора можно выделить багажное отделение и под сиденьем водителя.
Параметры АКБ
Обычная автомобильная батарея выдает напряжение в 12В. Этого хватает для питания бортовой сети. Для большегрузных автомобилей используются батареи с напряжением в 24В. По сути, это две обычные батареи, которые последовательно соединены. Емкость АКБ измеряется в Ампер-часах (А*ч). Для легкового транспорта емкость батареи находится в пределах 40-130 А*ч. Емкость показывает, какое время аккумулятор сможет давать энергию при нагрузке. Но эти величины измеряются при определенной нагрузке и при определенной температуре – 20°C. При других условиях параметры могут меняться.
Также важным показателем является ток холодной прокрутки или пусковой ток. Разные модели способны выдавать от 250А до 1300А. Ток холодной прокрутки – это то напряжение, которое способен отдать АКБ в течение 30 секунд при температуре 18°C. В иных условиях данный параметр может поменяться, например, зимой.
Устройство аккумулятора
На с
Принцип работы и устройство аккумулятора автомобиля
Исправно работающая аккумуляторная батарея — такой же неотъемлемый атрибут, как рулевое управление или колёса с нормальным давлением в шинах. Они выпускаются сегодня в разных интерпретациях, требуют определённого ухода и отличаются конструктивными особенностями.
Назначение аккумулятора в автомобиле
Главные функции, которые призван выполнять автомобильный аккумулятор, заключаются в том, чтобы запускать двигатель машины и ещё обеспечивать током некоторые приборы-потребители. Это источник тока, который относится к возобновляемым, то есть, ёмкость батареи может и должна восстанавливаться, если она исправна. Каждая АКБ превращает электроэнергию в химическую, а впоследствии этот процесс происходит в обратном порядке.
Более всего это устройство востребовано на этапе запуска двигателя внутреннего сгорания. Однако аккумулятор также отвечает за работоспособность и питание всего электрооборудования на борту транспортного средства. Как только запущен мотор, то питание приборов осуществляется уже за счёт генератора, который одновременно заряжает и аккумулятор, ведь каждый запуск приводит к уменьшению его ёмкости.
За последние годы автомобили всех марок активно насыщаются электроприборами, системами климатического контроля, звука и видео, а все они питаются за счёт бортового электрического тока. Если генератор не справляется с его поставкой, то дополнительно идёт подпитка от батареи. Однако ключевая задача её заключается всё-таки в подаче тока для запуска стартера. Наибольший разряд АКБ случается в холодное время года, когда и возникает большинство проблем у автолюбителей.
Параметры АКБ
Необходимость знать основные параметры аккумулятора важна не только на этапе его покупки, но и в процессе обслуживания. Одной из ключевых характеристик считается ёмкость этого оборудования, которая даст информацию о длительности его бесперебойной работы. Для измерения используется такая единица, как ампер-часы, показывающая срок, в течение которого изделие может работать без дозаряда, расходуя свою ёмкость. На само значение ёмкости оказывают влияние внешние факторы: температура окружающего воздуха, сила тока и особенности конструкции.

Другой важный критерий называют пусковой силой тока АКБ. Для того чтобы его узнать, измеряют значение, которое обеспечивает батарея при температуре 18 по Цельсию. Именно показатель пусковой силы тока берут во внимание, когда хотят определить исправность оборудования. Нормальное напряжение обычно находится около отметки в 12,6 В, но может колебаться в пределах 13–14 В, в зависимости от модели.
Каждая банка должна давать напряжение порядка 2В, а измерить его можно при помощи специальной нагрузочной вилки. Она устанавливает сопротивление, которое приходится на каждую из банок, учитывая также их ёмкость.
Важно помнить: перезарядка тоже нежелательна для аккумулятора, как и слабый заряд. Если не отключить вовремя зарядное устройство, это может спровоцировать закипание электролита.
Мощность заряда батареи можно получить, перемножив между собой напряжение и силу пускового тока. Однако, чтобы говорить о мощности, следует ещё учитывать температуру воздуха за окном машины. Слишком холодая погода отрицательно влияет на мощность. Потребуется больше тока для запуска, а потому зимой нужна большая мощность, нежели в тёплое время года.
Чтобы узнать детальные характеристики, лучше обратиться к маркировке — как правило, она наносится на корпусе изделия. На ней можно найти производителя и год выпуска, товарный знак и тип аккумулятора, вес, количество банок и другие необходимые стандарты. Основным материалом может выступать эбонит, термопласт или пластмасса, прошедшая специальную обработку. Вес батареи не относится к базовым характеристикам и может даже отличаться от того значения, что заявил производитель. Это может произойти из-за того, что свинцовые пластины взаимодействуют с электролитом и постепенно разрушаются.
Устройство аккумулятора
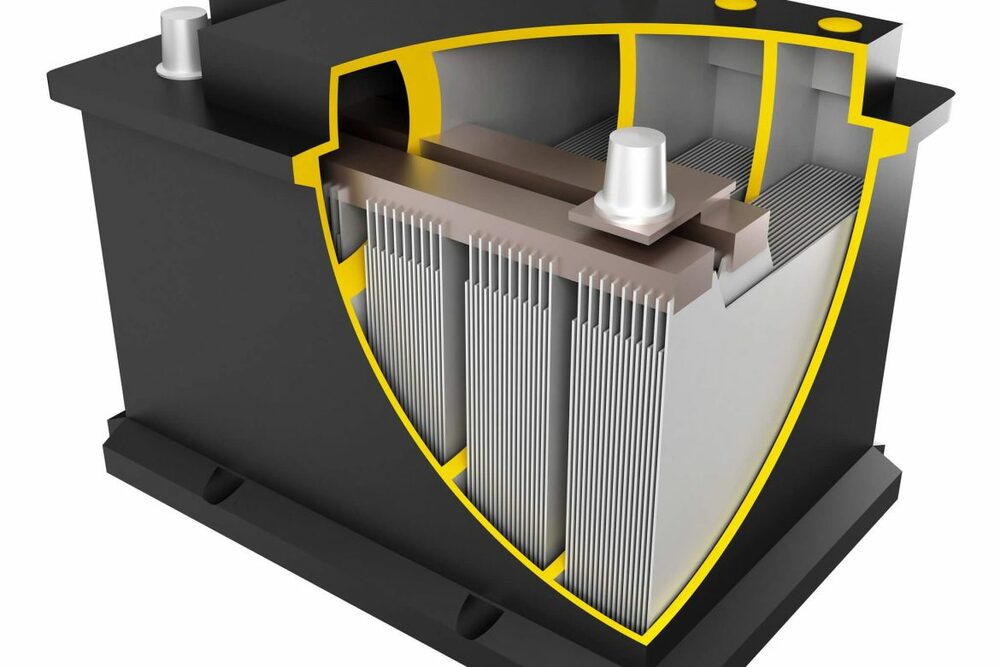
Разберёмся далее, как устроен автомобильный аккумулятор. Он состоит из нескольких гальванических элементов, которые ещё принято называть банками. Они находятся в отдельных ячейках изолированно друг от друга. Каждая из таких ячеек содержит в себе блок с электродами, часть из которых аноды, а другая часть — катоды. Полублок состоит из большого количества тонких пластин, которые обладают сетчатой структурой. Чтобы разделить между собой анод и катод, применяется специальный материал-сепаратор.

В полость заливают раствор разбавленной серной кислоты, которая хорошо проводит электрический ток. В традиционных аккумуляторах требовалось доливать дистиллированную воду. Из-за вступания в реакцию молекул кислорода и водорода плотность электролита постепенно повышалась. Современные батареи не требуют вмешательства человека, потому их принято называть необслуживаемыми. Излишек газов, который образуется под крышкой, автоматически выходит наружу при помощи специальных клапанов.
Разбирая устройство автомобильного аккумулятора, нужно заглянуть под его крышку. Там мы увидим 6 банок, которые подключены последовательно в одну цепь. Сам корпус устойчив к воздействию серной кислоты, а производится он обычно из специального пластика или другого изолята. В каждую из банок помещаются как положительные, так и отрицательные электроды, а на каждый из них, в свою очередь, наносится активная обмазочная масса.
Электрическое замыкание аккумуляторной батареи машины не происходит из-за разделяющих элементов, сепараторов. Для производства проводящих ток электродов чаще всего используется свинец с определёнными добавками. Если соединить его с кальцием, это позволит понизить уровень саморазряда и необходимость частого долива дистиллята.
Решётки электродов также могут быть изготовлены по разнообразным технологиям. Главная их задача заключается в отводе тока для снижения внутреннего сопротивления изделия. В конструкцию решётки для придания ей большей прочности вставляют направляющие и опорную раму. Иногда их могут располагать вертикально или в шахматном порядке — это тоже делает конструкцию более прочной. Чтобы улучшить взаимодействие с веществом-электролитом, на решётки наносят активную обмазку. В случае с положительными пластинами – это диоксид свинца, в случае с отрицательными — свинец губчатый.

Подавляющее большинство современных автомобилей работает на батареях свинцово-кислотного типа, основу которых составляет жидкий электролит, помещённый под крышку корпуса. Однако за последние пару десятилетий широкое признание получили принципиально новые конструкции, избавленные от многих недостатков.
Кроме изделий с классическим жидким электролитом, на рынке можно встретить АКБ типа AGM или GEL. В них производитель также помещает электролит, но уже в связанном состоянии. Материал наподобие стекловолокна пропитывается электролитом и за счёт своей пористой структуры держит его как губка. В таком виде он и прилегает к пластинам. В другие типы аккумуляторов помещают гелеобразный электролит благодаря оксиду кремния, который добавляют в серную кислоту.
Принцип работы
Даже опытные автолюбители не всегда в полном объёме представляют себе принцип работы автомобильного аккумулятора. Основу составляет электрохимическая окислительная реакция свинца, которая происходит в растворе разбавленной водой серной кислоты. Когда происходит заряд, снижается количество диоксида свинца на пластине со знаком «минус». В это же самое время на положительной пластине количество свинца возрастает. При разряде аккумулятора осуществляются обратные процессы. Одновременно, когда АКБ автомобиля разряжается, возрастает объём воды в банках, а объём серной кислоты улетучивается. В большей степени это касалось батарей обслуживаемого типа.
Итак, принцип работы аккумулятора в машине можно свести к сложным химическим реакциям. Как только включается любой электропотребитель (стартер на запуске или другой прибор), батарея начинает утрачивать свою ёмкость. Диоксид свинца, помещённый на пластины со знаком «плюс», а также свинец обычный на отрицательных, вступают во взаимодействие с раствором серной кислоты. Как результат — появляются вода и сульфат свинца. Одновременно электролит становится менее плотным.

Когда мы подключаем аккумуляторную батарею своего автомобиля к зарядному устройству, начинается противоположная реакция. Накопленный сульфат свинца и дистиллированная вода обратно преобразовываются в серную кислоту и свинцовый диоксид. Чем дольше идёт заряд АКБ, тем большей становится плотность электролита. Одновременно происходит процесс сульфатации пластин.
Во время поездок на автомобиле происходит непрерывный, хотя и не быстрый, заряд аккумулятора, если, конечно, мы имеем дело с исправным генератором. То есть, восстанавливается его максимальная ёмкость, которую можно возобновить и принудительно, но для этого придётся снимать батарею и подключать её к зарядному устройству.
Немалое значение отводится температуре окружающего воздуха. Если она повышена, то мощность возрастает, но вместе с ней увеличиваются расход воды и разряд. Во время пониженной температуры все эти химические реакции замедляются, но вместе с ними уменьшаются ёмкость и значения пускового тока. В обычных условиях эксплуатации длительность службы АКБ не превышает 3–5 лет. Многое зависит от типа батареи и входящих в состав пластин добавок, а также от ухода за ней и климатических условий эксплуатации.
Чтобы алгоритм работы любой АКБ не нарушался, водитель должен уметь её обслуживать и соблюдать некоторые рекомендации для продления эксплуатационного срока службы. Они сводятся к следующим правилам:
- если оборудование относится к категории обслуживаемых, периодически проверяем уровень электролита в нём;
- клеммы и их наконечники должны быть сухими и чистыми, гарантировать хороший контакт;
- при окислении проводов или их наконечников их следует осторожно отсоединить, зачистить и проверить надёжность контакта;
- корпус батареи нужно держать в чистоте и сухости, убирать лишнюю пыль или следы масла.
Это основные советы для поддержания АКБ в своем автомобиле в исправном состоянии, что одновременно поможет продлить его эксплуатационный ресурс.
принцип действия аккумуляторной и обычной
Как работают настенные часы, пульт от телевизора или детская игрушка на радиоуправлении? Большинство людей, не задумываясь, ответят — «от батареек» и будут, в принципе, правы. Но вряд ли кто-то из них сможет рассказать, как именно портативный элемент питания утроен, каким образом он функционирует и без чего весь процесс передачи электрического тока от батарейки к конечному потребителю был бы невозможен. Давайте же восполним этот досадный пробел в знаниях.
Содержание статьи
Принцип работы батарейки
Для того чтобы понять принцип функционирования обычной «пальчиковой» батарейки, необходимо иметь общее представление о её устройстве. Итак, любая батарейка состоит из трёх основных элементов — анода, катода и электролита. При этом последний может иметь фактически любое агрегатное состояние: помещённые в соляной раствор катод и анод, в принципе, так же являются «батарейкой», только в непривычном для рядового обывателя виде.
Интересно! Так называемый «вольтов столб», изобретённый Алессандро Вольта, так же имел все необходимые для производства электротока элементы. Он состоял из уложенных друг на друга цинковых и медных пластин, между которыми в качестве «прослойки» помещалась смоченная в кислоте ткань.
Анод в подобных системах – это главный источник электронов, которые, как мы знаем из школьного курса физики, имеют отрицательный заряд. Отрицательно заряженные частицы притягиваются к положительным, а в качестве «плюса» в данном случае выступает поверхность катода.
Но для возникновения электротока этого мало, ведь электронам нужна ещё и своеобразная «магистраль» — среда, которая поддерживала бы взаимодействие катода и анода. Именно здесь «на сцене» появляется электролит – соль, щёлочь или кислота, способные проводить ток.
Разберём принцип действия на конкретном примере: имеется элемент питания, рассчитанный на 18 вольт. Напряжение между электродами в нём стабильно, пока он не включён в сеть. Как только появляется потребитель (к примеру, обычная лампочка), напряжение начинает постепенно снижаться, от «минусового» электрода к «плюсовому» начнёт течь ток, и в электролите произойдёт химическая реакция, направленная на поддержание разности потенциалов между электродами.
Справка. Чем больше энергии требуется потребителю, тем интенсивнее течёт реакция внутри элемента питания и тем быстрее он выйдет из строя.
Как работает аккумуляторная батарейка, её отличие от обычной
Итак, мы рассмотрели классические «пальчиковые» и «мизинчиковые» элементы питания и знаем, что срок службы большинства из них строго ограничен (что бы там ни говорили именитые производители). Но как же быть с так называемыми АКБ – элементами питания аккумуляторного типа, способными не только расходовать энергию в процессе реакции, но и накапливать её и сохранять в течение долгого времени?
Для того чтобы понять принцип работы АКБ, необходимо обратиться к химии. В качестве примера возьмём… Обычный костёр на углях. Как бы красиво и завораживающе ни выглядело пламя, любой химик, наблюдая его, знает, что данный процесс представляет собой всего лишь длительную реакцию окисления топлива. Горящий уголь взаимодействует с кислородом и в качестве результата такой реакции мы получаем:
- углекислый газ;
- свет;
- тепло.
И если последние два пункта способны согреть душу и тело, то вот как-либо использовать углекислый газ мы не можем, ведь это побочный продукт реакции, являющийся, по сути, её отходом. Реакция окисления прекращается тогда, когда заканчиваются исходные элементы: кислород и уголь. Остановка реакции в батарейке происходит точно так же, когда исходные вещества полностью себя исчерпывают и остаются только «отходы».
В АКБ же всё происходит немного не так. Дело в том, что реакция, протекающая в ней, относится к разряду обратимых, то есть при определённых условиях её можно «повернуть вспять», вернув все вещества в их исходное состояние. Именно возможность протекания обратимой реакции в аккумуляторе позволяет заряжать его.
В АКБ, подключенной к сети, реакция протекает в обратном направлении, и ток идёт от «плюса» к «минусу», а не наоборот. Как результат – продукт реакции образует исходные вещества, а хозяин АКБ получает доступную «восстановленную» энергию в портативном формате. Вот и всё!
Подпишитесь на наши Социальные сети
Хранение аккумуляторных батарей: подготовка, условия и правила
Иногда у водителей возникает необходимость поставить автомобиль на длительную стоянку, например, на зимний период или при отъезде. В таком случае стоит побеспокоиться о правильном хранении некоторых элементов и в особенности автомобильного аккумулятора. Часто автолюбители пренебрегают правилами правильного хранения АКБ из-за чего батарея приходит в негодность или теряет свою емкость.
Принцип работы и основные виды автомобильных аккумуляторов
Прежде чем перейти к условиям и правилам хранения разберемся с принципом работы свинцового аккумулятора, а также перечислим основные виды АКБ. Устройство состоит из шести отсеков (банок), в которых находится определенное количество свинцовых пластин. Они исполняют роль электродов. В емкости залит электролит – жидкость, которая состоит из 65% дистиллированной воды и 35% серной кислоты. Такие пропорции очень важны для правильной работы АКБ.
Электрический ток вырабатывается в результате химической реакции между свинцом и серной кислотой в жидкости. В результате получается сульфат свинца (соль). В процессе работы, когда АКБ питает потребителей и разряжается, сульфат свинца оседает на пластинах. Этот процесс называется сульфатацией. При зарядке АКБ процесс происходит в обратную сторону. Концентрация серной кислоты при этом повышается.

 Принцип работы АКБ
Принцип работы АКБВот почему нельзя допускать полной разрядки батареи до нуля. Соль «прикипает» к пластинам и обратный процесс уже не запустить. АКБ приходит в негодность или значительно теряет в емкости. Емкость и плотность электролита – важные понятия, которые измеряются специальными приборами.
Кратко рассмотрим основные виды аккумуляторов:
- Сурьмянистые. В данном типе кислотных батарей в свинцовых пластинах содержится более 5% сурьмы для повышения их прочности. Из-за слишком интенсивного процесса сульфатации приходится часто доливать дистиллированную воду. На данный момент такие батареи уже устарели и практически не ис
Типы батарей / источники питания: принципы работы и преимущества
Батареи являются наиболее распространенным источником питания для базовых портативных устройств и крупномасштабных промышленных приложений. Батарею можно определить как; это комбинация одной или нескольких электрохимических ячеек, которые способны преобразовывать накопленную химическую энергию в электрическую.


Работа батареи:
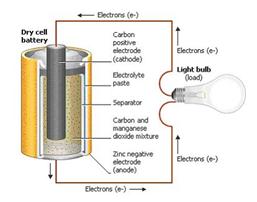
Батарея — это устройство, которое состоит из различных гальванических элементов.Каждый гальванический элемент состоит из двух полуэлементов, соединенных последовательно проводящим электролитом, содержащим анионы и катионы. Одна полуячейка включает электролит и электрод, к которому перемещаются анионы, то есть анод или отрицательный электрод; другая полуячейка включает электролит и электрод, к которому движутся катионы, то есть катод или положительный электрод.
В окислительно-восстановительной реакции, которая питает аккумулятор, происходит восстановление катионов на катоде, в то время как окисление происходит до анионов на аноде.Электроды не касаются друг друга, но электрически связаны электролитом. В основном полуэлементы имеют разные электролиты. Учитывая все обстоятельства, каждая полуячейка заключена в контейнер, а сепаратор, пористый для ионов, но не большая часть электролитов, предотвращает смешивание.
 Работа батареи
Работа батареиКаждая половина элемента имеет электродвижущую силу (ЭДС), определяемую ее способностью передавать электрический ток изнутри во внешнюю часть элемента. Чистая ЭДС ячейки — это разница между ЭДС ее полуячеек.Таким образом, если электроды имеют ЭДС, иными словами, чистая ЭДС представляет собой разность восстановительных потенциалов полуреакций.
Как ухаживать за аккумулятором?
Чтобы поддерживать аккумулятор в хорошем состоянии, необходимо выравнивание заряда аккумулятора. Из-за старения все элементы заряжаются по-разному, и некоторые элементы заряжаются очень быстро, а другие заряжаются постепенно. Выравнивание может быть выполнено путем небольшой перезарядки аккумулятора, чтобы позволить более слабым элементам также полностью зарядиться.Напряжение на клеммах полностью заряженной батареи составляет 12 В, автомобильная батарея показывает 13,8 В на клеммах, а 12-вольтная трубчатая батарея — 14,8 В. Автомобильный аккумулятор должен быть надежно закреплен в автомобиле, чтобы избежать тряски. Батарею инвертора следует по возможности поставить на деревянную доску.
2 типа батарей
1) Основные батареи:
Как видно из названия, эти батареи предназначены для одноразового использования. После того, как эти батареи используются, их нельзя перезарядить, так как устройства нельзя легко восстановить, и активные материалы могут не вернуться к своей первоначальной форме.Производители батарей не рекомендуют перезаряжать первичные элементы.


Некоторыми примерами одноразовых батареек являются обычные батарейки AA, AAA, которые мы используем в настенных часах, пультах дистанционного управления от телевизора и т. Д. Другое название этих батарей — одноразовые батарейки.

 Типы Батарея
Типы Батарея2) Вторичные батареи:
Вторичные батареи также называются аккумуляторными батареями. Эти батареи можно использовать и заряжать одновременно. Обычно они собираются из активных материалов, причем активный элемент находится в разряженном состоянии.Перезаряжаемые батареи заряжаются с помощью электрического тока, который обращает вспять химические реакции, происходящие во время разряда. Зарядные устройства — это устройства, обеспечивающие необходимый ток.
Некоторыми примерами таких аккумуляторных батарей являются батареи, используемые в мобильных телефонах, MP3-плеерах и т. Д. В таких устройствах, как слуховые аппараты и наручные часы, используются миниатюрные элементы, а в таких местах, как телефонные станции или компьютерные центры обработки данных, используются батареи большего размера.

 Вторичные батареи
Вторичные батареиТипы вторичных (перезаряжаемых) батарей:
SMF, свинцово-кислотные, Li и Nicd
SMF Батареи:
SMF — это герметичные необслуживаемые батареи , обеспечивающие надежность, постоянство и низкие эксплуатационные расходы мощность для приложений ИБП.Эти батареи могут подвергаться глубокому разряду и минимальному техническому обслуживанию в сельских районах и районах с дефицитом электроэнергии. Эти батареи доступны от 12 В.
В современном информативном мире нельзя упускать из виду требование, чтобы аккумуляторные системы были разработаны для восстановления важных квалифицированных данных и информации и запуска основных контрольно-измерительных приборов в течение желаемой продолжительности. Батареи необходимы для мгновенной подачи энергии. Ненадежные и некачественные батареи могут привести к потере данных и отключению оборудования, что может стоить компаниям значительных финансовых потерь.Следовательно, сегменты ИБП требуют использования надежной и проверенной аккумуляторной системы.

 SMF Батарея
SMF БатареяЛитиевая (Li) Батарея:
Все мы используем ее в портативных устройствах, таких как сотовый телефон, портативный компьютер или электроинструмент. Литиевая батарея стала одним из величайших достижений портативной энергетики за последнее десятилетие; Благодаря использованию литиевых батарей мы смогли перейти с черно-белых мобильных телефонов на цветные с дополнительными функциями, такими как GPS, оповещения по электронной почте и т. д.Это устройства с потенциалом высокой плотности энергии для более высоких мощностей. И относительно невысокий саморазряд аккумуляторов. Также специальные элементы могут обеспечивать очень высокий ток для таких приложений, как электроинструменты.

 Li Батарея
Li БатареяНикель-кадмиевая (Nicd) батарея:
Никель-кадмиевые батареи имеют то преимущество, что их можно перезаряжать много раз, они обладают относительно постоянным потенциалом во время разряда и имеют большую электрическую и физическую стойкость. В этой батарее используется оксид никеля для катода, соединение кадмия для анода и раствор гидроксида калия в качестве электролита.
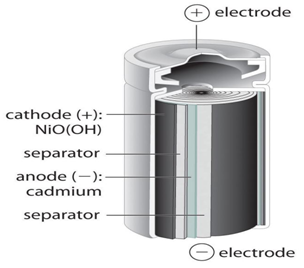

Когда аккумулятор заряжается, химический состав катода изменяется, и гидроксид никеля превращается в NIOOH. В аноде образование ионов кадмия происходит из гидроксида кадмия. Когда аккумулятор разряжен, кадмий реагирует с NiOOH, образуя обратно гидроксид никеля и гидроксид кадмия.
Cd + 2h3O + 2NiOOH -> 2Ni (OH) 2 + Cd (OH) 2
Свинцово-кислотная батарея:
Свинцово-кислотные батареи широко используются в автомобилях, инверторах, системах резервного питания и т. Д.В отличие от трубчатых и необслуживаемых батарей, свинцово-кислотные батареи требуют надлежащего ухода и обслуживания для продления срока их службы. Свинцово-кислотный аккумулятор состоит из ряда пластин, погруженных в раствор серной кислоты. Пластины имеют сетки, на которые крепится активный материал. Пластины делятся на положительные и отрицательные. Положительные пластины содержат чистый свинец в качестве активного материала, в то время как оксид свинца прикреплен к отрицательным пластинам.
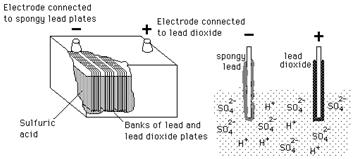
 Свинцово-кислотная батарея
Свинцово-кислотная батареяПолностью заряженная батарея может разрядить свой ток при подключении к нагрузке.В процессе разряда серная кислота соединяется с активными материалами на положительной и отрицательной пластинах, что приводит к образованию сульфата свинца. Вода — самый важный шаг в обслуживании свинцово-кислотной батареи. Периодичность подачи воды зависит от использования, способа зарядки и рабочей температуры. Во время процесса атомы водорода серной кислоты реагируют с кислородом с образованием воды.
Это приводит к высвобождению электронов из положительных пластин, которые будут приняты отрицательными пластинами.Это приводит к образованию электрического потенциала на батарее. Электролит в свинцово-кислотной батарее представляет собой смесь серной кислоты и воды с определенным удельным весом. Удельный вес — это вес кислотно-водной смеси по сравнению с равным объемом воды. Удельный вес чистой воды, не содержащей ионов, составляет 1.
Свинцово-кислотные батареи обеспечивают наилучшее соотношение мощности и энергии на киловатт-час; имеют самый длительный жизненный цикл и большое экологическое преимущество, поскольку они перерабатываются с чрезвычайно высокой скоростью.Никакая другая химия не может коснуться существующей инфраструктуры для сбора, транспортировки и переработки свинцово-кислотных аккумуляторов.
Наряду с этой статьей обсуждается литий-ионный аккумулятор, его достоинства и недостатки.
Работа литий-ионных аккумуляторов


Литий-ионные аккумуляторы сейчас популярны в большинстве портативных электронных устройств, таких как мобильные телефоны, ноутбуки, цифровые фотоаппараты и т. Д., Благодаря их длительной энергоэффективности. Это самые популярные аккумуляторные батареи с такими преимуществами, как лучшая плотность энергии, незначительные потери заряда и отсутствие эффекта памяти.Литий-ионный аккумулятор использует ионы лития в качестве носителей заряда, которые перемещаются от отрицательного электрода к положительному во время разряда и обратно при зарядке. Во время зарядки внешний ток от зарядного устройства вызывает перенапряжение, чем в аккумуляторе. Это заставляет ток проходить в обратном направлении от положительного электрода к отрицательному, где ионы лития внедряются в пористый электродный материал посредством процесса, называемого интеркаляцией. Литий-ионные ионы проходят через неводный электролит и разделительную диафрагму.Материал электрода — интеркалированное соединение лития.
Отрицательный электрод литий-ионной батареи состоит из углерода, а положительный электрод — из оксида металла. Чаще всего для отрицательного электрода используется графит, а для положительного электрода — оксид лития-кобальта, ион-фосфат лития или оксид лития-марганца. Литиевая соль в органическом растворителе используется в качестве электролита. Электролит обычно представляет собой смесь органических карбонатов, таких как этиленкарбонат или диэтилкарбонат, содержащих ионы лития.В электролите используются анионные соли, такие как гексафторфосфат лития, моногидрат гексафторарсената лития, перхлорат лития, гексафторборат лития и т. Д. В зависимости от используемой соли напряжение, емкость и срок службы батареи различаются. Чистый литий бурно реагирует с водой с образованием гидроксида лития и ионов водорода. Таким образом, в качестве электролита используется неводный органический растворитель. Электрохимическая роль заряда электродов между анодом и катодом зависит от направления протекания тока.

 Li Ion Battery Реакция
Li Ion Battery РеакцияВ литий-ионной батарее оба электрода могут принимать и выделять ионы лития. Во время процесса интеркаляции ионы лития перемещаются в электрод. Во время обратного процесса, называемого деинтеркаляцией, ионы лития возвращаются. Во время разряда положительные ионы лития извлекаются из отрицательных электродов и вставляются в положительный электрод. В процессе зарядки происходит обратное движение ионов лития.
Преимущества литий-ионных батарей:
Литий-ионные батареи превосходят никель-кадмиевые и другие вторичные батареи.Некоторые из преимуществ:
- Легкий вес по сравнению с другими батареями аналогичного размера
- Доступны в другой форме, включая плоскую
- Высокое напряжение разомкнутой цепи, которое увеличивает передачу мощности при низком токе
- Отсутствие эффекта памяти.
- Очень низкая скорость саморазряда 5-10% в месяц. Саморазряд составляет около 30% в NiCd и NiMh батареях.
- Экологичный аккумулятор без свободного металлического лития
Но наряду с преимуществами, как и у других аккумуляторов, литий-ионный аккумулятор также имеет некоторые недостатки.
Недостатки литий-ионного аккумулятора:
- Отложения внутри электролита со временем будут препятствовать прохождению заряда. Это увеличивает внутреннее сопротивление батареи, и способность элемента передавать ток постепенно уменьшается.
- Высокая зарядка и высокая температура могут привести к потере емкости.
- При перегреве литий-ионная аккумуляторная батарея может подвергнуться тепловому уходу и разрушению элемента.
- Глубокая разрядка может привести к короткому замыканию литий-ионного аккумулятора. Поэтому, чтобы предотвратить это, некоторые производители имеют внутреннюю схему отключения, которая отключает аккумулятор, когда его напряжение превышает безопасный уровень от 3 до 4.2 вольта. В этом случае, когда аккумулятор не используется в течение длительного времени, внутренняя схема будет потреблять энергию и разряжать аккумулятор ниже напряжения отключения. Так что для зарядки таких аккумуляторов обычные зарядные устройства не пригодятся.
Как работают батареи? | Живая наука
Батарейки везде. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на то, что они широко используются в повседневной жизни людей, батареям часто не уделяют должного внимания. Подумайте об этом: вы действительно знаете, как работает аккумулятор? Не могли бы вы объяснить это кому-нибудь другому?
Вот краткое изложение научных данных об источниках энергии для смартфонов, электромобилей, кардиостимуляторов и многого другого.[Тест: электрические и газовые автомобили]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора Sakti3, базирующейся в Мичигане. запуск аккумуляторных технологий.
В каждой батарее по два электрода. Оба изготовлены из токопроводящих материалов, но выполняют разные функции. Один электрод, известный как катод, подключается к положительному концу батареи и является местом, где электрический ток выходит (или электроны входят) в батарею во время разряда, когда батарея используется для питания чего-либо.Другой электрод, известный как анод, подключается к отрицательному полюсу батареи и является местом, где электрический ток входит (или электроны покидают) батарею во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, производя химические реакции, которые позволяют батарее генерировать электрический ток.[Взгляд изнутри на работу батарей (инфографика)]
Типичные батареи питаются за счет химической реакции. [См. Полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)Последняя часть батареи, разделитель, довольно проста. Роль сепаратора состоит в том, чтобы удерживать анод и катод отдельно друг от друга внутри батареи. По словам Састри, без разделителя два электрода соприкоснутся, что приведет к короткому замыканию и нарушит нормальную работу батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, как вы вставляете щелочные батарейки, такие как двойные AA, в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Сохраненная в батарее химическая энергия преобразуется в электрическую, которая выходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но на противоположном конце от того места, где он выходил изначально.
Все части батареи работают вместе, чтобы фонарик загорался. Электроды в батарее содержат атомы определенных проводящих материалов. Например, в щелочной батарее анод обычно состоит из цинка, а диоксид марганца действует как катод. Электролит между электродами и внутри них содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, протекающих в электродах, вместе известна как окислительно-восстановительные (окислительно-восстановительные) реакции.В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к освобождению электронов от атомов электрода, — сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, поскольку электроны (которые заряжены отрицательно) поглощаются.Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности попасть внутрь батареи, потому что разделитель не позволяет им сделать это.
Когда вы щелкаете выключателем фонарика, все меняется. У электронов теперь есть путь к катоду. Но сначала они должны пройти через основание лампы фонарика. Схема замыкается, когда электрический ток повторно входит в батарею через верхнюю часть батареи у катода.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, например, в фонарике, реакции, питающие батарею, в конечном итоге прекратятся, а это означает, что электроны, обеспечивающие батарею ее зарядом, больше не будут создавать электрический ток. Когда это происходит, аккумулятор разряжен или «мертв», — сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставили батарею производить энергию, не могут быть обращены вспять, объяснил Састри.Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, могут быть обращены вспять, подавая в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Некоторые из наиболее распространенных используемых сегодня вторичных батарей — это литий-ионные (литий-ионные) батареи, от которых питается большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе.Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и аккумуляторные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются в автомобилях и других транспортных средствах для запуска, освещения и зажигания.
По словам Састри, все эти аккумуляторные батареи работают по одному и тому же принципу: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, и анод и катод возвращаются в исходное состояние.[10 лучших подрывных технологий]
Battery lingo
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при любом обсуждении батарей:
Напряжение : Когда дело доходит до батарей, напряжение — также известное как номинальное напряжение ячейки — описывает величину электрической силы или давления, при которой свободные электроны — переходите от положительного полюса батареи к отрицательному, — объяснил Састри.В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (с большей электрической силой). Батареи в фонарике обычно имеют напряжение 1,5 В. Однако, если в фонарике используются две батареи последовательно, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные батареи, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольт. Но обычно в автомобильном аккумуляторе последовательно соединено шесть таких элементов, поэтому вы, вероятно, слышали, что такие аккумуляторы называются 12-вольтовыми батареями.
Литий-кобальто-оксидные батареи — наиболее распространенный тип литий-ионных аккумуляторов в бытовой электронике — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер или ампер — это мера электрического тока или количества электронов, которые проходят через цепь в течение определенного периода времени.
Емкость : Емкость, или емкость элемента, измеряется в ампер-часах, то есть количество часов, в течение которых батарея может подавать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райса. Кафедра электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и будет считаться разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей важна плотность мощности, потому что она показывает, насколько быстро автомобиль может разогнаться от 0 до 60 миль в час (97 км / ч).Инженеры постоянно пытаются найти способы уменьшить размеры батарей без снижения их удельной мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна отдавать батарея, деленное на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые имеют большое влияние на пользователей, например, сколько времени вам нужно пройти перед зарядкой мобильного телефона или как далеко вы можете проехать на электромобиле, прежде чем остановиться, чтобы подключить его.
Follow Elizabeth Palermo @ techEpalermo .Следуйте за Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
,Аккумулятор | История и принцип работы батарей
В современную эпоху электрическая энергия обычно преобразуется из механической энергии, солнечной энергии, химической энергии и т. Д. Батарея — это устройство, преобразующее химическую энергию в электрическую. Первая батарея была разработана Алессандро Вольта в 1800 году. В 1836 году британский химик Джон Фредерик Даниэлл разработал элемент Даниэля как улучшенную версию гальванического элемента.С того времени и по сегодняшний день аккумулятор был самым популярным источником электричества во многих повседневных применениях.
В повседневной жизни мы обычно используем два типа аккумуляторов, один из которых можно использовать один раз, прежде чем он полностью разрядится. Другой тип аккумулятора — перезаряжаемый, что означает, что его можно использовать несколько раз, заряжая его извне. Первая называется первичной батареей, а вторая — вторичной.
Можно найти аккумуляторов разных размеров.Батарея может быть размером с пуговицу на рубашке или может быть настолько большой по размеру, что для установки аккумуляторной батареи потребуется целая комната. Батарея такого размера может использоваться везде, от маленьких наручных часов до большого корабля.

Символ батареи
Мы часто видим этот символ на многих схемах электрических и электронных сетей. Это наиболее часто используемый символ батареи. Линии большего размера представляют собой положительный вывод элементов, а линии меньшего размера представляют собой отрицательный полюс элементов, подключенных к батарее.
Нас часто путают термины «аккумулятор» и «аккумулятор». Обычно мы называем батарею одиночным электрохимическим элементом. Но буквально батарея это не значит. Батарея означает ряд электрохимических ячеек, соединенных вместе для обеспечения определенного уровня напряжения и электрического тока. Хотя может быть и одноячеечная батарея, буквально батарея и элемент разные.
История батареи

Парфянская батарея
В 1936 году в середине лета при строительстве новой железнодорожной линии недалеко от города Багдад в Ираке была обнаружена древняя гробница.Возраст реликвий, найденных в гробнице, составляет около 2000 лет. Среди этих реликвий были глиняные кувшины или сосуды, запечатанные сверху смолой. Железный стержень, окруженный цилиндрической трубкой, сделанной из обернутого медного листа, выступал из этой герметичной вершины. Когда эти горшки были наполнены кислой жидкостью, они создавали разность потенциалов около 2 вольт между железом и медью. Предположительно, в этих глиняных сосудах использовались аккумуляторные батареи возрастом 2000 лет.
Эксперимент Луиджи Гальвани с лягушачьими лапками
В 1786 году итальянский анатом и физиолог Луиджи Гальвани был удивлен, увидев, что, когда он коснулся ноги мертвой лягушки двумя разными металлами, мышцы ног сжались.Он не мог понять истинную причину этого, иначе он был бы известен как первый изобретатель элемента батареи. Он подумал, что реакция могла быть вызвана каким-то свойством тканей.

Гальваническая свая
После этого Алессандро Вольта понял, что такое же явление можно создать, используя картон, пропитанный соленой водой, вместо лягушачьей лапки. Он зажал между ними медный и цинковый диск с куском картона, смоченным в соленой воде, и обнаружил разность потенциалов между медью и цинком.После этого в 1800 году он разработал первую гальваническую батарею, состоящую из чередующихся медных и цинковых дисков с кусками картона, пропитанными рассолом между ними. Эта система может производить измеримый ток. Гальваническая батарея Алессандро Вольта считалась первым «мокрым аккумуляторным элементом». Так началась история батареи .

Daniell Cell
Основная проблема вольтова сваи заключалась в том, что она не могла подавать электрический ток в течение длительного времени.Эта проблема была решена британским изобретателем Джоном Ф. Даниэлем в 1836 году. Он изобрел более развитую версию аккумуляторной ячейки, которая известна как ячейка Даниэля. Здесь, в этой ячейке, один цинковый стержень погружен в сульфат цинка в одном контейнере, а один медный стержень погружен в сульфат меди (II) в другом контейнере. Растворы этих двух контейнеров соединены U-образным солевым мостиком. Элемент Даниэля мог производить 1,1 В, и этот тип батареи прослужил намного дольше, чем батарея Вольта.
В 1839 году топливный элемент был разработан сэром Уильямом Робертом Гроувом, первооткрывателем и человеком науки. Он смешал водород и кислород в растворе электролита и создал электричество и воду. Топливный элемент не дает достаточно электричества, но он полезен.
Бунзен (1842 г.) и Гроув (1839 г.) усовершенствовали аккумулятор, в котором для подачи электричества использовались жидкие электроды.

Свинцово-кислотный аккумулятор
В 1859 году Гастон Планте; впервые разработал свинцово-кислотный аккумулятор.Это была первая форма перезаряжаемой вторичной батареи. Свинцово-кислотные аккумуляторные батареи все еще используются во многих промышленных целях. Он по-прежнему наиболее популярен в качестве автомобильного аккумулятора.
В 1866 году батарею снова разработал французский инженер Жорж Лекланш. Это была угольно-цинковая аккумуляторная батарея с жидким электролитом, известная как элемент Лекланша. Измельченный диоксид марганца, смешанный с небольшим количеством углерода, образует положительный электрод, а цинковый стержень используется в качестве отрицательного электрода. В качестве жидкого электролита используется раствор хлорида аммония.Спустя несколько лет Жорж Лекланш сам улучшил свою конструкцию, заменив жидкий раствор хлорида аммония хлоридом аммония. Это было изобретение первой сухой камеры.
В 1901 году Томас Альва Эдисон открыл щелочной аккумулятор. В базовой ячейке Томаса Эдисона в качестве материала анода использовалось железо (-) и оксид никеля в качестве материала катода (+). Это лишь часть бесконечной истории батареи .
Поэтапное развитие в истории батарей
| Разработчик / Изобретатель | Страна | Год | Изобретение |
|---|---|---|---|
| Луиджи Гальвани | Италия | 1786 | Электроэнергия для животных |
| Алессандро Вольта | Италия | 1800 | Гальваническая свая |
| Джон Ф.Даниэль | Великобритания | 1836 | Ячейка Даниэля |
| Сэр Уильям Роберт Гроув | Великобритания | 1839 | Топливный элемент |
| Роберт Бунзен | Немецкий | 1842 | использовали жидкие электроды для подачи электроэнергии |
| Гастон Планте | Франция | 1859 | Свинцово-кислотная батарея |
| Жорж Лекланш | Франция | 1866 | Ячейка Leclanche |
| Томас Альва Эдисон | США | 1901 | Аккумулятор щелочи |
Принцип работы батареи
Чтобы правильно понять основной принцип батареи , во-первых, мы должны иметь некоторую базовую концепцию сродства электролитов и электронов.Фактически, когда два разнородных металла или металлических соединения погружают в электролит, между этими металлами или металлическими соединениями возникает разность потенциалов.
Обнаружено, что при добавлении в воду определенных соединений они растворяются и образуют отрицательные и положительные ионы. Этот тип соединения называется электролитом. Популярными примерами электролитов являются почти все виды солей, кислот, оснований и т. Д.
Энергия, выделяемая при приеме электрона нейтральным атомом, известна как сродство к электрону.Поскольку атомная структура для разных материалов различна, сродство к электрону разных материалов будет отличаться. Если два разных вида металлов или металлических соединений погрузить в один и тот же раствор электролита, один из них получит электроны, а другой — высвободит электроны. Какой металл (или металлическое соединение) получит электроны, а какой их потеряет, зависит от сродства к электрону этих металлов или металлических соединений. Металл с низким сродством к электрону будет получать электроны от отрицательных ионов раствора электролита.С другой стороны, металл с высоким сродством к электрону высвобождает электроны, и эти электроны выходят в раствор электролита и добавляются к положительным ионам раствора. Таким образом, один из этих металлов или соединений приобретает электроны, а другой теряет электроны. В результате между этими двумя металлами будет разница в концентрации электронов. Эта разница в концентрации электронов вызывает разность электрических потенциалов между металлами. Эта разность электрических потенциалов или ЭДС может использоваться в качестве источника напряжения в любой электронике или электрической цепи.Это общий и основной принцип батареи .
Все элементы батареи основаны только на этом основном принципе. Давайте обсудим по порядку. Как мы уже говорили ранее, Алессандро Вольта разработал первый аккумуляторный элемент, и этот элемент широко известен как простой гальванический элемент. Такой тип простой ячейки можно создать очень легко. Возьмите одну емкость и заполните ее разбавленной серной кислотой в качестве электролита. Теперь погрузите цинк и один медный стержень в раствор и подключите их снаружи с помощью электрической нагрузки.Теперь ваш простой гальванический элемент готов. Ток начнет течь через внешнюю нагрузку.
Цинк в разбавленной серной кислоте отдает электроны, как показано ниже:

Эти ионы Zn + + переходят в электролит, и их концентрация очень высока вблизи цинкового электрода. В результате вышеуказанной реакции окисления цинковый электрод остается заряженным отрицательно и, следовательно, действует как катод. Разбавленная серная кислота и вода диссоциируют на ионы гидроксония, как указано ниже:

Из-за высокой концентрации ионов Zn + + около катода ионы H 3 O + отталкиваются к медному электроду и разряжаются, удаляя электроны из атомов меди.На аноде происходит следующая реакция:

В результате реакции восстановления, происходящей на медном электроде, медь остается положительно заряженной и, следовательно, действует как анод.
Батарейный элемент Daniell: Элемент Daniell состоит из медного сосуда, содержащего раствор сульфата меди. Сам медный сосуд действует как положительный электрод. В медный сосуд помещают пористую емкость с разбавленной серной кислотой. Амальгамированный цинковый стержень, погруженный в серную кислоту, действует как отрицательный электрод.
Когда контур замкнут, разбавленная серная кислота в пористом резервуаре вступает в реакцию с цинком с выделением газообразного водорода. Реакция протекает следующим образом:

Образование ZnSO 4 в пористой емкости не влияет на работу ячейки, пока не осаждаются кристаллы ZnSO 4 .
Газообразный водород проходит через пористую емкость и реагирует с раствором CuSO 4 , как показано ниже:

Образованная таким образом медь оседает на медном сосуде.,Схема и принцип работы зарядного устройства для мобильных аккумуляторов
Схема зарядного устройства для мобильных аккумуляторов — это устройство, которое может автоматически заряжать аккумулятор мобильного телефона при низком уровне заряда. В настоящее время мобильные телефоны стали неотъемлемой частью жизни каждого человека и, следовательно, требуют частой зарядки аккумулятора из-за более длительного использования.
Зарядные устройства для аккумуляторов бывают простыми, непрерывными, с таймером, интеллектуальными универсальными зарядными устройствами-анализаторами, быстрыми, импульсными, индуктивными, USB-зарядными устройствами, зарядными устройствами на солнечных батареях и зарядными устройствами с подвижным приводом.Эти зарядные устройства также различаются в зависимости от приложений, таких как зарядное устройство для мобильных телефонов, зарядное устройство для транспортных средств, зарядные устройства для аккумуляторов электромобилей и зарядные станции.
Методы зарядки подразделяются на две категории: метод быстрой зарядки и метод медленной зарядки. Быстрая зарядка — это система, которая используется для зарядки аккумулятора примерно за два часа или меньше, а медленная зарядка — это система, используемая для зарядки аккумулятора в течение ночи. Медленная зарядка выгодна, поскольку не требует какой-либо схемы обнаружения заряда.Кроме того, это дешево. Единственным недостатком этой системы зарядки является то, что для зарядки аккумулятора требуется максимальное время.
Зарядное устройство с автоматическим отключением батареи
Этот проект направлен на автоматическое отключение батареи от сети, когда батарея полностью заряжена. Эта система также может использоваться для зарядки частично разряженных элементов. Схема проста и состоит из преобразователя переменного тока в постоянный, драйверов реле и зарядных станций.
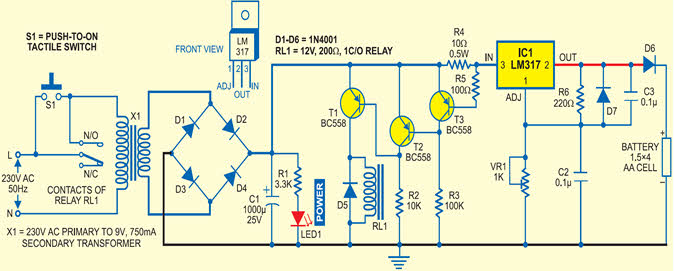
 Схема зарядного устройства для мобильных аккумуляторов
Схема зарядного устройства для мобильных аккумуляторовОписание схемы
В секции преобразователя переменного тока в постоянный трансформатор понижает доступный источник переменного тока до 9 В переменного тока при 75 мА, который выпрямляется с помощью двухполупериодного выпрямителя, а затем фильтруется с помощью конденсатор.Зарядное напряжение 12 В постоянного тока обеспечивается регулятором, и при нажатии переключателя S1 зарядное устройство начинает работать, а светодиод включения питания светится, указывая на то, что зарядное устройство «включено».
Секция драйвера реле состоит из транзисторов PNP для включения электромагнитного реле. Это реле подключено к коллектору первого транзистора, и оно управляется вторым транзистором PNP, который, в свою очередь, управляется транзистором PNP.


В секции зарядки микросхема регулятора смещена примерно на 7.35V. Для регулировки напряжения смещения используется предустановка VR1. Диод D6 подключен между выходом микросхемы, и для зарядки аккумулятора используется ограничивающее выходное напряжение аккумулятора до 6,7 В.
При нажатии переключателя происходит защелка реле и начинается зарядка аккумулятора. Когда напряжение на ячейку превышает 1,3 В, падение напряжения начинает уменьшаться на R4. Когда напряжение падает ниже 650 мВ, транзистор T3 отключается и переходит на транзистор T2 и, в свою очередь, отключает транзистор T3.В результате реле RL1 обесточивается, чтобы отключить зарядное устройство, и красный светодиод LED1 гаснет.
Зарядное напряжение в зависимости от никель-кадмиевого элемента может быть определено с помощью технических характеристик, предоставленных производителем. Зарядное напряжение установлено на 7,35 В для четырех ячеек по 1,5 В. В настоящее время на рынке доступны элементы емкостью 700 мАч, которые можно заряжать от 70 мА в течение десяти часов. Напряжение холостого хода около 1,3В.
Точка напряжения отключения определяется путем полной зарядки четырех ячеек (при 70 мА в течение четырнадцати часов) и добавления падения напряжения на диоде (до 0.65 В) после измерения напряжения и соответственно смещения LM317.
В дополнение к вышеупомянутой простой схеме, реализация этой схемы в реальном времени на основе проектов солнечной энергетики обсуждается ниже.
Контроллер заряда солнечной энергии
Основная цель этого проекта контроллера заряда солнечной энергии — заряжать аккумулятор с помощью солнечных панелей. В этом проекте рассматривается механизм контроля заряда, который также обеспечивает защиту аккумулятора от перезаряда, глубокого разряда и пониженного напряжения.В этой системе с помощью фотоэлектрических элементов солнечная энергия преобразуется в электрическую.
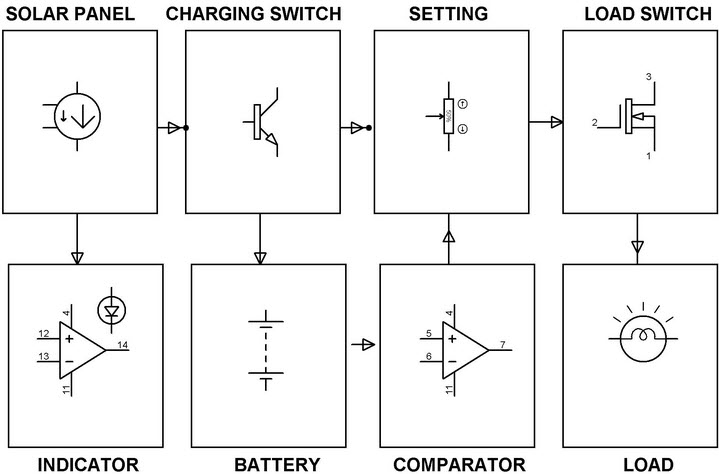
 Контроллер заряда солнечной энергии
Контроллер заряда солнечной энергииЭтот проект включает в себя такие аппаратные компоненты, как солнечная панель, операционные усилители, MOSFET, диоды, светодиоды, потенциометр и аккумулятор. Солнечные панели используются для преобразования энергии солнечного света в электрическую. Эта энергия накапливается в аккумуляторе в дневное время и используется в ночное время. Набор OP-AMPS используется в качестве компараторов для непрерывного контроля напряжения панели и тока в проводе.
Светодиоды используются в качестве индикаторов и горят зеленым цветом, показывая, что аккумулятор полностью заряжен. Точно так же, если аккумулятор недостаточно заряжен или перегружен, они светятся красным светом. Контроллер заряда использует MOSFET — силовой полупроводниковый переключатель для отключения нагрузки, когда батарея разряжена или находится в состоянии перегрузки. Транзистор используется для передачи солнечной энергии в фиктивную нагрузку, когда батарея полностью заряжена, и защищает батарею от чрезмерного заряда.
Контроллер заряда на основе фотоэлектрических элементов MPPT на базе микроконтроллера
Этот проект направлен на разработку контроллера заряда с отслеживанием точки максимальной мощности на основе микроконтроллера.
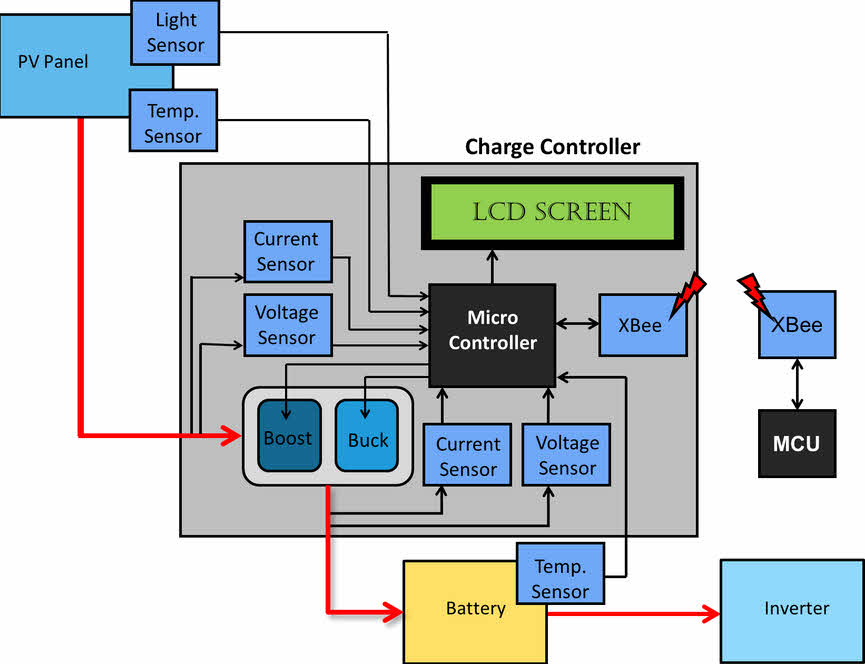
 Фотоэлектрический контроллер заряда MPPT
Фотоэлектрический контроллер заряда MPPTОсновными компонентами, используемыми в этом проекте, являются солнечная панель, аккумулятор, инвертор, беспроводной приемопередатчик, ЖК-дисплей, датчик тока и датчик температуры. Электроэнергия от солнечных панелей подается на контроллер заряда, который затем выдается в батарею и используется для хранения энергии. Выход батареи подключен к инвертору, который предоставляет пользователю выходы для доступа к накопленной энергии.
Солнечная панель, аккумулятор и инвертор покупаются отдельно, а контроллер заряда MPPT разработан и изготовлен солнечными рыцарями.ЖК-экран предназначен для отображения заряда аккумулятора и других предупреждающих сообщений. Выходное напряжение изменяется с помощью широтно-импульсной модуляции от микроконтроллера к драйверам MOSFET. Способ отслеживания точки максимальной мощности с использованием реализации алгоритма MPPT в контроллере гарантирует, что аккумулятор заряжается на максимальной мощности от солнечной панели.
Так можно сделать зарядное устройство для мобильных телефонов. Два упомянутых здесь примера могут облегчить вам процесс. Более того, если у вас есть какие-либо сомнения и вам нужна помощь в реализации проектов в реальном времени и схем промышленных зарядных устройств, вы можете оставить комментарий в разделе комментариев ниже.
Фото:
- Схема зарядного устройства для мобильных аккумуляторов от ggpht
- Фотоэлектрический контроллер заряда MPPT от eecs
