Какую кислоту заливают в аккумулятор
Большинство водителей никогда в жизни не задумывались, какую кислоту добавляют в аккумулятор авто и зачастую высказывают неправильные догадки. Одни скажут, что там вода, другие назовут соляную кислоту, поэтому мы расставим все точки над «и». В аккумуляторах применяется смесь серной кислоты и дист. воды. Знакомьтесь, это электролит.
На практике встречаются устройства, где в роли электролита выступает щелочь (никель-кадмиевые аккумуляторы). Также есть несколько гелевых устройств, но по факту гель – это та же самая кислота, находящаяся в другом состоянии или пропитывающий стекловолоконные частицы.
Она применяется в промышленном изготовлении АКБ для авто. Обычно, электролит — это 35% серной кислоты и 65% дист. воды. Заливать любую другую воду категорически запрещается, поскольку она содержит соли, которые существенно сократят срок работы АКБ.
Концентрированная серная кислота производится в 2 стадии. В первой её концентрацию доводят до 65-70%, а во второй – до 98%. Это необходимо для того, чтобы увеличить срок хранения кислоты. Вероятно даже повышение концентрации до 99%, но из-за потерь SO3 значение все равно будет снижено до 98 процентов.
Как сделать электролит в домашних условиях?
Рекомендуем купить его в магазине, но его можно сделать и своими руками.
Нам потребуются:
- Дистиллированная вода;
- Серная кислота;
- Емкость из стекла, керамики или свинца, устойчивая к кислотам;
- Эбонитовая палочка.
Чтобы сделать электролит надо залить воду в специальную емкость и добавить туда серную кислоту в пропорции 3:1. Тщательно перемешать смесь эбонитовой палочкой. Вещество плотно накрыть и оставить на 1 день до выпадения осадка.
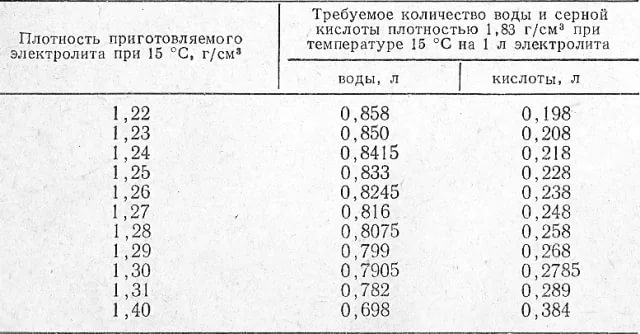 Таблица для расчета приготовляемого электролита
Таблица для расчета приготовляемого электролитаНеобходимо сказать, что превышения в допустимой концентрации электролита может привести к самым неприятным последствиям. От чрезмерно концентрированного вещества пластины аккумулятора очень быстро «разъест», что в кратчайшие сроки вызовет выход аккумулятора из рабочего состояния.
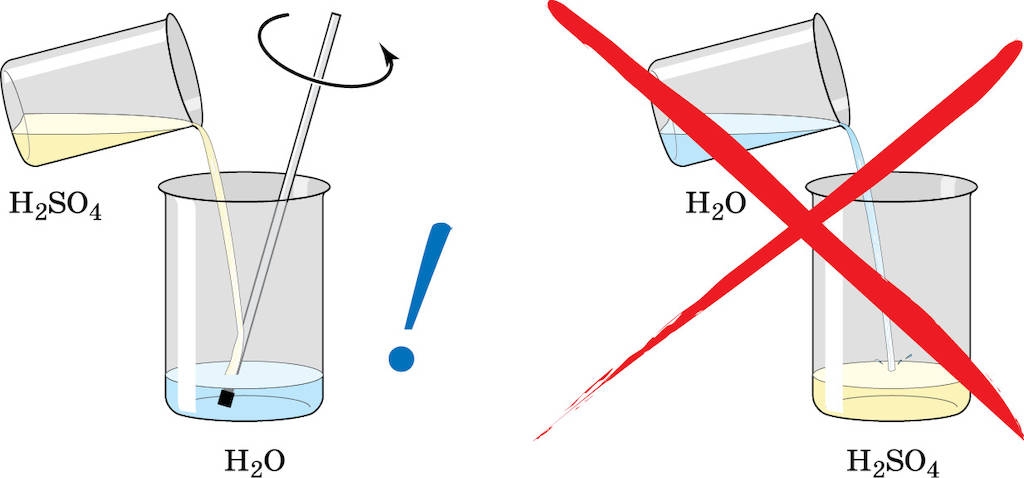 В дист вода добавляем кислоту, а не наоборот
В дист вода добавляем кислоту, а не наоборотА вот слишком низкий уровень плотности вещества может очень быстро вызывать сульфатацию. Наверняка вы знаете, что это такое. Нет? Это процесс оседания кристаллических осадков на пластинах, в результате чего аккумулятор теряет свои свойства и просто оказывается неспособным держать заряд долгое время.
Зачем нужен электролит?
Суть работы АКБ базируется на реакциях, проходящих только при помощи этого вещества. Батарея состоит из плюсовых и минусовых пластинок, погружаемых в кислотный раствор. Эти пластины оснащены токоотводными решетками, сделанными из свинца.
Как проконтролировать состояние электролита?
Держать под контролем состояние электролита нужно. Для контроля сгодится пластмассовый корпус от обычной пластиковой ручки. Открываем пробки и погружаем его к пластинам, после чего зажимаем сверху и вынуть. Идеальный уровень – 10-12 мм. Если надо, дольем электролит.
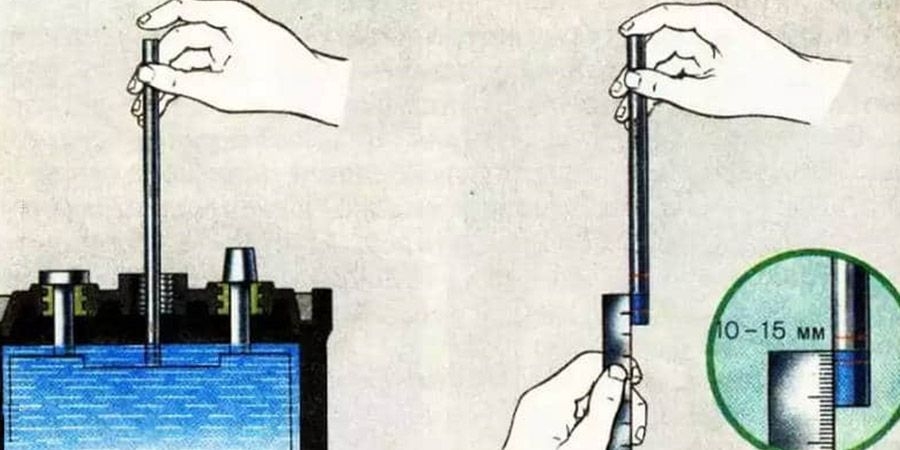 Измерение уровня электролита в АКБ
Измерение уровня электролита в АКБОчень важно следить за временем года и параметрами раствора в соответствии с ним. Можно существенно продлить жизнь батареи, если использовать растворы с разными параметрами в разное время. К примеру, слишком концентрированное вещество в летнее время деструктивно воздействует на АКБ. Высокая плотность увеличивает энергопотери, а серный ангидрид может полностью разрушить электроды устройства.
Срок эксплуатации электролита
У такого электролита нет срока эксплуатации. Данный критерий может быть определен только по способности выполнения своих функций на 100%. Среди факторов, которые могут повлиять на жизненный цикл электролита, важнейшими являются:
- Плотность;
- Температуру работы аккумулятора;
- Заряд.
Если все показатели в норме, то и электролит не будет тревожить Вас годами.
Как увеличить плотность вещества?
Увеличить плотность можно при повышении температуры и гидролиза. Также важно постоянно добавлять дистиллят для поддержания показателей на нормальном уровне. Если же концентрация кислоты ниже 1,275 грамм на сантиметр кубический, её нужно поднять.
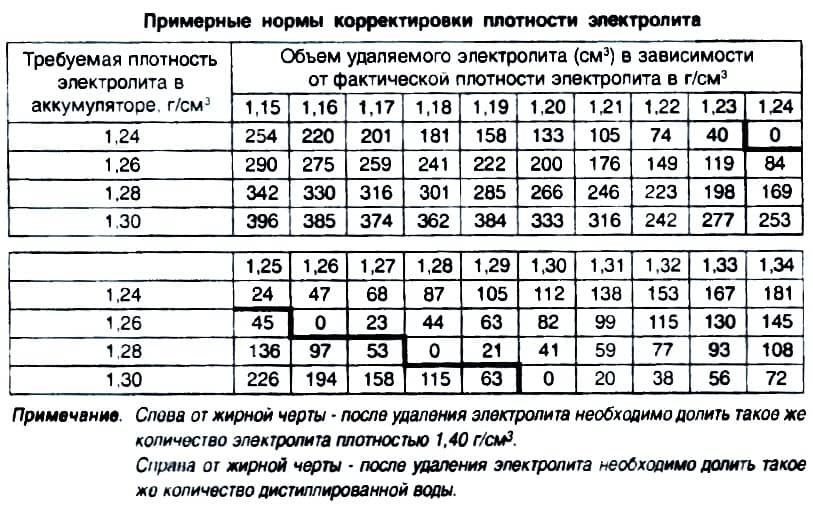
Повысить такой уровень можно 2-мя способами: сменой содержимого или доливом концентрированной кислоты.
Если разбавлять жидкость, то необходимо совершить определенные действия для всех банок:
- Откачать максимум электролита при помощи шприца;
- Внести в банку половину от его объема;
- Подать нагрузку с низкой мощностью для смешивания жидкости.
- Если изменений в уровне нет, добавляем во вторую половину электролит и получаем идеальную плотность.
Кислота – вредная субстанция для кожи. Использование резиновых перчаток, фартука и защитных очков при работе с этим веществом категорически обязательно!
Как заливать и доливать кислоту?
Электролит заливается при помощи трубки до 15 мм над пластинками батареи. Затем оставляем аккумулятор на 2 часа для остывания и заряжаем током в 10 раз меньшим от объема АКБ.
Ключевые характеристики надо проверять пару раз в году с помощью особого прибора и не пропускать проверки.
При смешивании дистводы с кислотой, важно добавлять именно кислоту в воду, так как в обратном случае есть вероятность активации бурной реакции вещества с тепловыделением, доведением её до состояния кипения.
Внимательно соблюдайте все вышеперечисленные рекомендации и АКБ будет служить очень долгое время!
Сдать старый АКБ за деньги вы сможете в нашей фирме, тарифы на приём акумуляторов на этой странице.
mtyre.ru
Какая кислота в аккумуляторе автомобиля применяется в качестве электролита?

Владельцы автомобилей часто задаются вопросом о том, какая кислота в аккумуляторе автомобиля, от которой зависит срок его службы. Производители этой продукции в основном заливают серную кислоту, представляющую кислотно-водный раствор определенной плотности и концентрации. Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Содержание статьи
Состав электролита
Электролит, или серная кислота используется современной промышленностью для производства источников тока:
- в батареях;
- аккумуляторах;
- электрических конденсаторах.
В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% H
Контроль плотности
Плотность в автомобильном свинцово-кислотном аккумуляторе измеряют в гр/см³, и она должна быть пропорциональна концентрации раствора с обратной зависимостью температур жидкости. Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества.

Электролит для аккумуляторов можно приобрести в магазинах, либо сделать своими руками и научиться регулировать плотность, своевременно измерять и ухаживать за устройством для продления срока службы.
Для приготовления потребуются следующие компоненты:
- Серная кислота.
- Вода дистиллированная.
- Эбонитовая баночка для размешивания.
Для приготовления в емкость заливается дистиллированная вода, затем серная кислота, и палочкой параллельно помешивается получаемая смесь. Процедуру проводят последовательно, так как при обратном варианте можно получить ожоги. Если места эксплуатации автотранспорта климат умеренный, то следует придерживаться такой пропорции веществ: на 1 л воды — 0,36 л кислоты. Для теплого климата на 1 л воды следует заливать кислоту в объеме 0,33 л. Полученное вещество накрывается и оставляется на сутки до образования осадков и остывания. При замене электролита в аккумуляторе надевают резиновые перчатки и очки для защиты глаз.
Напомним, что при обратном проведении заливки, в частности, первой воды, возможна реакция гидратации и образования тепла в кислоте. Вероятно, что вода закипит и спровоцирует разбрызгивание.
Проверять плотность аккумулятора необходимо раз в три месяца. Для этого пользуются ареометром.
Составляющий компонент строения АКБ
Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький. Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.

Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Нейтрализация электролита
Если аккумулятор вышел полностью из строя, его требуется утилизировать грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее.
Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий. Это важно с экономической и экологической точек зрения. Если проводить неорганизованную нейтрализацию, можно нанести значительный вред окружающей среде.
В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта. Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды.
При регулярной проверке аккумулятора, в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин.
auto-gl.ru
какая кислота залита в аккумуляторе машины?
аккумуляторная
Раствор серной кислоты
Электролит из серной кислоты-Н2SO4
h3SO4 Серная кислота
раствор соляной кислоты
Жидкость в аккумуляторе состоит из серной кислоты, разбавленной дистиллированной водой. Часть этой воды может испаряться или распадаться на водород и кислород во время зарядки аккумулятора. Серная кислота аккумуляторная ГОСТ 667-73 Химическая формула: h3SO4 Описание: Серная кислота — бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты) . В технике под серной кислотой подразумевают любые соединения h3SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них h3SO4 или SO3 Серная кислота — одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы) . Применение: Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов. В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты — чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора — чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т. е. плотность, приобретенная после первого полного заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%. Технические характеристики: Серная кислота ГОСТ 667-73 Высший сорт Первый сорт Массовая доля моногидрата (h3SO4), % 92-94 92-94 Массовая доля железа (Fe), % 0,005 0,01 Массовая доля остатка после прокаливания, %, не более 0,02 0,03 Массовая доля оксидов азота (N2O4), %, не более 0,00003 0,00001 Массовая доля мышьяка (As), %, не более 0,00005 0,00008 Массовая доля хлористых соединений (Cl), %, не более 0,0002 0,0003 Массовая доля марганца (Mn), %, не более 0,00005 0,0001 Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более 0,01 0,01 Массовая доля меди (Cu), %, не более 0,0005 0,0005 Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более 4,5 7 Прозрачность Должна выдерживать испытание по п. 3.13
какая разница -прожигает всё напрочь
серная кислотишка
Аккамуляторы Разные Бывают даже радиоактивные!!!! И эту радиоактивность можно погасить только с помощью Воздержания Мужчины!!!!
touch.otvet.mail.ru
Кислотные аккумуляторы: конструкция, характеристики
Аккумулятор — источник питания, в котором при разряде энергия химической реакции преобразовывается в электрическую, а при заряде — наоборот. Главное отличие от обычной батареи – это возможность восстановления энергии методом повторной зарядки. Для заряда нужно подключить постоянный ток в направлении, обратном разряду.
Кислотные аккумуляторы были изобретены в 19 веке, но до сих пор являются самыми востребованными в мире благодаря невысокой стоимости и высокой степени эффективности. Устройство состоит из корпуса, двух разнополярных электродов, помещенных в электролит – раствор кислоты, от этого получено название – кислотные батареи (АКБ — Аккумуляторные Кислотные Батареи). По материалу, из которого изготовлены электроды, их еще называют свинцово-кислотные.

Как работают?
Основой работы аккумулятора является электрохимический процесс взаимодействия свинца и диоксида свинца в водном растворе серной кислоты. При включении нагрузки на электроды происходит химическая реакция диоксида свинца с серной кислотой H2SO4, а также реакция окисления свинца до сульфата свинца. В процессе разряда на катоде («-») идет восстановление диоксида свинца, на аноде («+») — окисление свинца. Во время зарядки происходят обратные химические реакции и электролиз воды с выделением кислорода на аноде, водорода на катоде.
Реакции взаимодействия, протекающие в аккумуляторе, можно описать двумя формулами:
- PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O – разряд.
- 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 — заряд.
При разрядке идет процесс образования сульфата свинца в активных массах анода и катода, расходование серной кислоты H2SO4 и снижение плотности электролита. Во время зарядки происходят обратные реакции, идет образование серной кислоты, повышается плотность электролита. Окончание процесса заряда характеризуется завершением преобразования веществ на электродах, прекращением изменения электролита. Если продолжать зарядку, то возникает нежелательная реакция разложения воды (электролиз), идет выделение кислородных и водородных пузырьков в электролите, происходит иллюзия закипания. Если это произошло, необходимо добавить в аккумулятор дистиллированной воды для восстановления ее в электролите.
Конструкция
Кислотные батареи уже более ста лет не меняются по своему основному внутреннему устройству.
В конструкцию аккумуляторных батарей входят:
- Электроды – в виде плоских решеток из свинца, в ячейки запрессован порошок диоксид свинца (PbO2) на аноде, порошок металлического свинца (Pb) — на катоде.
- Сепаратор — пористый диэлектрик, разделяет между собой электроды, препятствуя замыканию.
- Электролит — разбавленная водой (дистиллированной) серная кислота H2SO4, в нее помещены электроды и сепаратор. Максимальная электропроводность достигается при температуре 20оС, концентрации серной кислоты – 35 %, что означает плотность электролита 1,26 г/см³. Внутренне сопротивление при этом минимально, потери внутри устройства существенно малы. В местах с низкотемпературным климатом возможно повышение плотности раствора до 1,29 г/см³ – 1,31 г/см³. Увеличение концентрации кислотного раствора препятствует замерзанию электролита, образованию льда внутри корпуса, который может повредить электроды и разорвать аккумулятор.
Основные характеристики, параметры
- Емкость (номинальная) — количество электрической энергии, которое могут дать кислотные батареи, измерение происходит в момент разряда, при нагрузке маленьким током потребления, единицы измерения— А*ч.
- Стартерный ток – показывает способность АКБ отдавать большие токи при температуре — 18оС на протяжении половины минуты.
- Емкость(резервная) — показывает временной промежуток, на протяжении которого кислотные батареи отдают ток 25 А до величины напряжения 10,5 В.
- Нижнее значение напряжения разряженной АКБ — 1,75 — 1,8 V.
- Температурный рабочий диапазон — – 40ос — + 40оС.
Разновидности
По режиму работы кислотные батареи можно разделить на три группы:
- Циклический — принцип работы происходит по циклу – полный разряд — полный заряд, периодически отключается от источника питания. Считается наиболее жестким режимом, количество циклов стопроцентной разрядки ограничено.
- Буферный — широко используемый режим, щадящий для АКБ, при нем не допускается полного разряда, характерно постоянное подключение к источнику питания.
- Смешанный — комбинация буферного и циклических режимов, но большая часть времени работы проходит в буферном.
Самые распространенные кислотные батареи, представленные на рынке, можно разделить на виды:
| Вид | Обслуживание | Описание | Вольтаж, V |
| Lead-Acid | Обслуживаемые | Автомобильные АКБ, бывают: малосурьмянистые, сурьмянистые, кислотно-кальциевые, гибридные. | 612 |
| AGM VRLA | Не требуют обслуживания | Сепараторы изготовлены из стекловолокна, циклический и буферный режим работы. | 24612 |
| VRLA | Не требуют обслуживания | Герметичный корпус, бывают кальциевые, не выделяют газов, используются в буферном режиме. | 24612 |
| GEL VLRA | Не требуют обслуживания | В качестве электролита — селикагель, что продлевает срок службы АКБ, буферный режим эксплуатации. | 24612243648 |
| OPzV | Не требуют обслуживания | Электроды трубчатой конструкции, устойчивы к полному разряду, срок службы — около 22 лет. | 2 |
Применение
- Автотранспорт — кислотные батареи используются как стартерные батареи.
- Компьютерная техника — источники бесперебойного питания (ИБП) позволяют сохранить информацию в случае аварийного отключения электричества.
- Промышленное производство — кислотные батареи используются как источники резервного питания.
Зарядка и общие рекомендации
- Зарядку необходимо проводить при температуре 20оС.
- Ток заряда не должен превышать 10 % номинального значения емкости АКБ.
- Для использования в транспортных средствах кислотные батареи при низких температурах, лучше применять с системой внутреннего электроподогрева, т. к. емкость устройства теряется на 1% при снижении температуры на 1оС.
- Не рекомендуется хранить кислотные батареи при температуре выше 30оС, либо разряженными, предварительно АКБ должны быть полностью заряжены.
- Хранение зимой лучше организовать на холоде, т. к. процесс саморазряда будет минимален, и на плюсовую клемму необходимо предварительно нанести солидол.
- Перед использованием, кислотные батареи нужно занести в помещение с температурой 20оС на 8-10 часов для приведения в рабочее состояние.
Batareykaa.ru
batareykaa.ru
Какая кислота в аккумуляторе автомобиля и какова ее плотность
Владельцы автомобилей часто задаются вопросом о том, какая кислота в аккумуляторе автомобиля, от которой зависит срок его службы. Производители этой продукции в основном заливают серную кислоту, представляющую кислотно-водный раствор определенной плотности и концентрации. Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Состав электролита
Электролит, или серная кислота используется современной промышленностью для производства источников тока:
- в батареях,
- аккумуляторах,
- электрических конденсаторах.
В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% h3SO4. При ее отсутствии устройство не пригодно к работе. Особого внимания также заслуживает плотность жидкости, которую следует проверять и при необходимости увеличивать.
Контроль плотности
Плотность в автомобильном свинцово-кислотном аккумуляторе измеряют в гр/см³, и она должна быть пропорциональна концентрации раствора с обратной зависимостью температур жидкости. Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества.

Электролит для аккумуляторов можно приобрести в магазинах, либо сделать своими руками и научиться регулировать плотность, своевременно измерять и ухаживать за устройством для продления срока службы.
Для приготовления потребуются следующие компоненты:
- Серная кислота.
- Вода дистиллированная.
- Емкость из стекла, свинца, керамики, устойчивая к воздействию химического вещества.
- Эбонитовая баночка для размешивания.
Для приготовления в емкость заливается дистиллированная вода, затем серная кислота, и палочкой параллельно помешивается получаемая смесь. Процедуру проводят последовательно, так как при обратном варианте можно получить ожоги. Если места эксплуатации автотранспорта климат умеренный, то следует придерживаться такой пропорции веществ: на 1 л воды — 0,36 л кислоты. Для теплого климата на 1 л воды следует заливать кислоту в объеме 0,33 л. Полученное вещество накрывается и оставляется на сутки до образования осадков и остывания. При замене электролита в аккумуляторе надевают резиновые перчатки и очки для защиты глаз.
Напомним, что при обратном проведении заливки, в частности, первой воды, возможна реакция гидратации и образования тепла в кислоте. Вероятно, что вода закипит и спровоцирует разбрызгивание.
Проверять плотность аккумулятора необходимо раз в три месяца. Для этого пользуются ареометром.
Составляющий компонент строения АКБ
Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький. Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.

Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Нейтрализация электролита
Если аккумулятор вышел полностью из строя, его требуется утилизировать грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее.
Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий. Это важно с экономической и экологической точек зрения. Если проводить неорганизованную нейтрализацию, можно нанести значительный вред окружающей среде.
В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта. Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды.
При регулярной проверке аккумулятора, в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин.
 Загрузка…
Загрузка…xn—-ntbhhmr6g.xn--p1ai
Концентрация и плотность серной кислоты. Зависимость плотности серной кислоты от концентрации в аккумуляторе автомобиля
Разбавленная и концентрированная серная кислота — это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4— ;
HSO4— = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель — в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 =ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.

Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
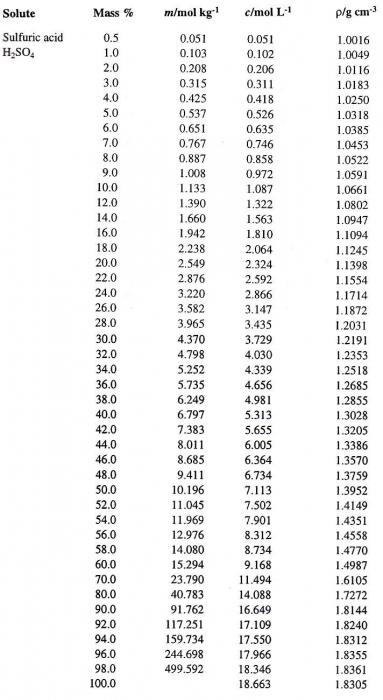
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
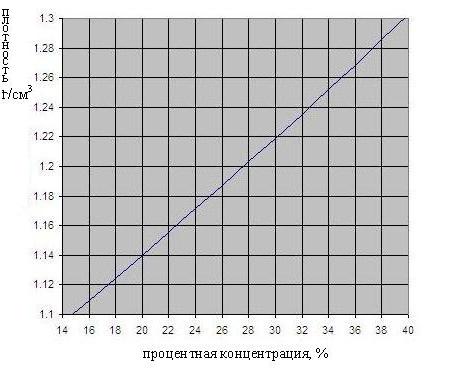
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное — вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) — 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная — 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум — 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты — именно 104,5 %.
- Высокопроцентный олеум — 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная — 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала — диоксида свинца (PbO2), а отрицательные — из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
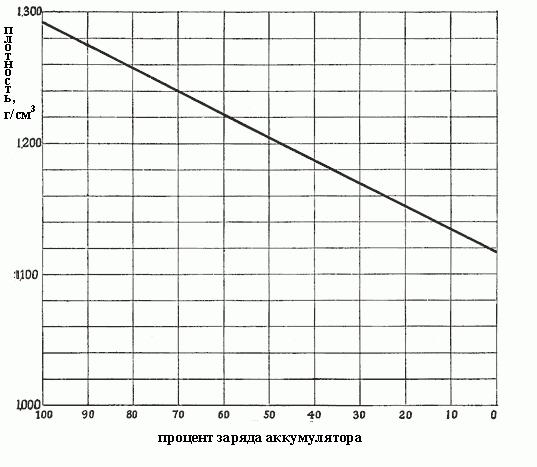
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
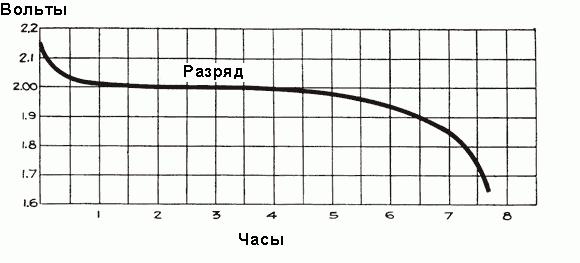
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
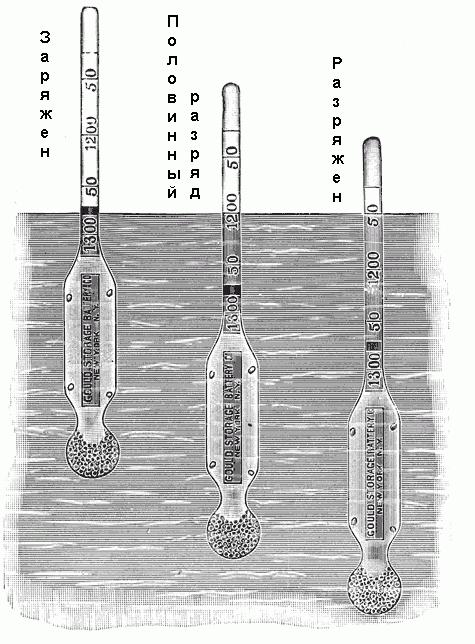 Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.
Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.fb.ru
