ЭЛЕКТРОЛИТЫ | Энциклопедия Кругосвет
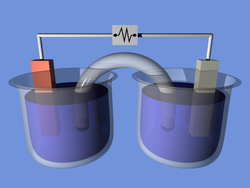
Содержание статьиЭЛЕКТРОЛИТЫ, вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также (что встречается значительно чаще) растворы солей, кислот или оснований в полярных растворителях, например в воде. Известны и твердые электролиты. Чтобы пропустить электрический ток через раствор электролита, в него опускают две металлические или угольные пластины – электроды – и соединяют их с полюсами источника постоянного тока. Положительный электрод называют анодом, отрицательный – катодом. Прохождение тока через электролит сопровождается химическими реакциями на электродах. Так, на катоде, погруженном в расплав соли или оксида либо в раствор соли, обычно осаждается металл, входящий в состав электролита. На катоде, погруженном в водный раствор кислоты, основания либо соли щелочного или щелочноземельного металла, выделяется газообразный водород. На аноде, изготовленном из инертного материала, например платины или угля, в водном растворе выделяется газообразный кислород, а в концентрированных водных растворах хлоридов или в расплавленных хлоридах – хлор. Цинковые, медные или кадмиевые аноды под действием электрического тока сами постепенно растворяются; газ в этом случае не образуется.
ЭЛЕКТРОЛИЗ
Законы Фарадея.
Электролизом называют химические процессы, протекающие под действием электрического тока на электродах, погруженных в электролит. Количество образовавшегося вещества связано с количеством электричества, пропущенного через электролит (сила тока ґ время), законами Фарадея: 1) количество вещества, образовавшегося на электроде при пропускании через электролит постоянного электрического тока, прямо пропорционально количеству пропущенного электричества, т.е. силе тока и времени электролиза; 2) для разных электродных процессов при одинаковом количестве электричества, пропущенного через электролит, массы образовавшихся веществ пропорциональны их химическим эквивалентам. (Эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях, а эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с 1 экв. водорода или любого другого вещества.
Законы Фарадея справедливы как для растворов, так и для расплавов и применимы к обоим электродам. Количество электричества, необходимое для образования 1 экв. любого вещества, одинаково для всех веществ; оно равно 96 485 Кл и называется числом Фарадея или постоянной Фарадея (фундаментальная физическая константа). Эта закономерность широко применяется на практике. Исходя из количества затраченного электричества, можно рассчитать массу или толщину металлического покрытия, образующегося при гальваностегии, и наоборот, задав толщину покрытия, можно оценить, какое количество электричества для этого потребуется. Законы Фарадея лежат в основе работы вольтметра и приборов, предназначенных для измерения силы постоянного тока.
Ионы.
В 1833 М.Фарадей предположил, что ток через электролит переносят электрически заряженные частицы – ионы. Положительно заряженные ионы (например, ионы металлов и водорода), движущиеся через электролит по направлению к катоду, были названы катионами, а отрицательно заряженные, перемещающиеся к аноду, – анионами. Предполагалось, что на электродах ионы теряют заряд, при этом на катоде из катионов образуются атомы металла или водорода, а на аноде из анионов – галогены или кислород.
Эти представления – с незначительными изменениями – считаются справедливыми и сегодня. Положительным ионом (катионом) называют атом или группу атомов, утративших один или несколько электронов, а отрицательным ионом (анионом) – атом или группу атомов с одним или более избыточным электроном. На катоде катионы электролита приобретают недостающие электроны и нейтрализуют свой положительный заряд. Аналогично анионы отдают избыточные электроны, достигая анода. Если материал анода реакционноспособен, он может сам служить источником электронов, поскольку его атомы отдают электроны легче, чем анионы. Образующиеся катионы переходят при этом в раствор.
Поскольку для осаждения или нейтрализации 1 экв. любого вещества требуется одно и то же количество электричества, очевидно, что заряд, переносимый ионами, содержащимися в 1 экв., одинаков для всех веществ. Число эквивалентов в одном моле ионов равно валентности иона, поэтому число единичных зарядов (электронов), переносимых ионом, можно отождествить с его валентностью. Таким образом, у одновалентного катиона (например, Na
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
Теория Аррениуса.
Предположив, что электрический ток в электролитах переносят ионы, Фарадей ничего не сказал об их происхождении. Некоторые соображения по этому поводу были высказаны немецким физиком Р.Клаузиусом в 1857, а первое наиболее полное описание процесса образования ионов принадлежит шведскому физикохимику С.Аррениусу (1883–1897). Аррениус предположил, что соли, кислоты и основания при растворении в подходящем растворителе (например, в воде) распадаются (диссоциируют) на ионы. Например, хлорид натрия NaCl диссоциирует на ионы натрия Na+ и хлора Cl–. Электрический ток в самом процессе диссоциации никак не участвует, он лишь направляет ионы к соответствующим электродам. Теория электролитической диссоциации не только объясняет образование ионов в растворе, но и проливает свет на многие ранее непонятные явления. Так, в 1887 нидерландский физикохимик Я.Вант-Гофф обнаружил, что температура замерзания растворов электролитов значительно ниже, а температура кипения намного выше, чем рассчитанные исходя из их молекулярных масс (
Константа диссоциации.
Согласно Аррениусу, степень диссоциации, т.е. доля молекул, распавшихся на ионы, возрастает по мере разбавления раствора. Предположив, что скорости перемещения ионов через электролит не зависят от концентрации раствора, и измерив электропроводность, Аррениус рассчитал степень диссоциации нескольких электролитов при разных концентрациях. В.Оствальд в 1888 использовал этот метод для расчета концентрации свободных ионов и недиссоциированных молекул в растворе, а отсюда – константы равновесия (константы диссоциации) реакции диссоциации. Обратимая диссоциация электролита CA на ионы C C+ + A–, а константа диссоциации равна K = [C+][A–]/[CA] (величины в квадратных скобках – концентрации). Последнее соотношение удовлетворительно описывает поведение только растворов слабых электролитов – слабых кислот и оснований. Сильные электролиты, т.е. водные растворы сильных кислот, оснований и большинства солей, ведут себя иначе; оказалось, что фундаментальный постулат Аррениуса о постоянстве скоростей перемещения ионов и независимости их от концентрации неприменим к сильным электролитам.
C+ + A–, а константа диссоциации равна K = [C+][A–]/[CA] (величины в квадратных скобках – концентрации). Последнее соотношение удовлетворительно описывает поведение только растворов слабых электролитов – слабых кислот и оснований. Сильные электролиты, т.е. водные растворы сильных кислот, оснований и большинства солей, ведут себя иначе; оказалось, что фундаментальный постулат Аррениуса о постоянстве скоростей перемещения ионов и независимости их от концентрации неприменим к сильным электролитам.
ТЕОРИЯ МЕЖИОННОГО ВЗАИМОДЕЙСТВИЯ
Согласно современным представлениям, основанным на теории валентности и данных по рентгеноструктурному анализу кристаллов, большинство солей ионизировано уже в твердом состоянии; при этом положительные и отрицательные ионы удерживаются вместе электростатическими силами. Когда соль растворяется (например, в воде), ионы притягивают к себе молекулы растворителя – сольватируются (или гидратируются, если растворитель – вода). Выделяющейся в процессе сольватации энергии достаточно для преодоления электростатических сил притяжения ионов, так что ионы в растворе отделяются друг от друга, т.е. происходит электролитическая диссоциация. Сильные электролиты, в частности галогениды и нитраты щелочных и щелочноземельных металлов, полностью ионизированы в растворе при всех приемлемых концентрациях.
Противоположно заряженные ионы в растворе притягиваются друг к другу, причем степень притяжения возрастает с увеличением концентрации, поскольку расстояние между ионами уменьшается. Диссоциация, особенно при высоких концентрациях, никогда не бывает полной. Здесь нужно остановиться на различии между диссоциацией и ионизацией. Сильные электролиты (например, соль) в растворе полностью ионизированы фактически при всех концентрациях, но степень их диссоциации зависит от концентрации и становится достаточно высокой только в очень разбавленных растворах. Слабые электролиты, напротив, ионизированы лишь частично, и степень ионизации у них очень мало отличается от степени диссоциации; это и подтверждают измерения электропроводности.
Теория Дебая – Хюккеля.
Описанные выше представления составляют основу теории межионного взаимодействия электролитов. Вкратце суть ее состоит в следующем: электростатическое притяжение между ионами существует во всех электролитах, но в слабых электролитах, где число ионов относительно мало и поэтому они находятся далеко друг от друга, оно несущественно. Таким образом, концепция межионного взаимодействия относится главным образом к сильным электролитам. В количественном виде эту концепцию представили П.Дебай и Э.Хюккель в 1923, и она называется теорией Дебая – Хюккеля. Основная ее идея состоит в том, что вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку. Тормозящее действие ионной атмосферы на передвижение ионов проявляется таким образом, что все свойства, зависящие от концентрации ионов (такие, как электрическая проводимость, осмотическое давление и т.д.), отвечают заниженной степени диссоциации – кажущейся степени диссоциации. Для оценки состояния ионов в растворе пользуются понятием активности иона – его условной концентрации, соответственно которой он действует при химических реакциях: a = fC, где a – активность иона, C – его концентрация, f – коэффициент активности. Значение f f близок к единице, это говорит о слабом межионном взаимодействии. В очень разбавленных растворах действие межионных сил почти не проявляется. Применяя различные математические методы для описания свойств ионной атмосферы, во многом удалось объяснить поведение разбавленных растворов сильных электролитов. Поведение же их концентрированных растворов требует дальнейших исследований.
Электролиты
Проводниками электрического тока являются не только металлы и полупроводники. Электрический ток проводят растворы многих веществ в воде. Чистая вода не проводит электрический ток, то есть, в ней нет свободных носителей электрических зарядов. Не проводят электрический ток и кристаллы поваренной соли (хлорида натрия). Но если растворить соль в воде, раствор будет хорошим проводником электрического тока. Растворы солей, кислот и оснований, которые способны проводить электрический ток называются электролитами.
 Прохождение электрического тока через электролиты обязательно сопровождается выделением вещества в твёрдом или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы.
Прохождение электрического тока через электролиты обязательно сопровождается выделением вещества в твёрдом или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы.
По степени диссоциации (способности распадаться на ионы) электролиты можно разделить на сильные и слабые. Степень диссоциации сильных электролитов в растворах равна единице: они полностью диссоциируют, не зависимо от концентрации раствора (щёлочи, соли, некоторые кислоты). Степень диссоциации слабых электролитов в растворах меньше единицы: они диссоциируют не полностью. И с ростом концентрации раствора степень диссоциации уменьшается (вода, ряд кислот и оснований).
Четкой границы между этими двумя группами нет: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
Закон электролиза. Электрохимический эквивалент вещества
Электролизом называют физико-химический процесс, протекающий на электродах, погруженных в электролит, под действием электрического тока: на электродах выделяются составные части растворённых веществ или других веществ, которые являются результатом вторичных реакций.
В проводящих жидкостях упорядоченное движение ионов происходит в электрическом поле, созданном электродами – проводниками, которые соединены с полюсами источника электрической энергии. При электролизе положительный электрод называется анодом, а отрицательный – катодом. Отрицательные ионы – анионы – движутся к аноду, положительные ионы – катионы – к катоду. На аноде отрицательные ионы отдают лишние электроны (окислительная реакция). На катоде положительные ионы получают недостающие электроны (восстановительная реакция).
М. Фарадей на основе экспериментов с различными электролитами установил, что при электролизе масса m выделившегося вещества пропорциональна прошедшему через электролит заряду ∆q или силе тока I и времени ∆t прохождения тока:
m = k∆q = kI∆t
Данное уравнение называется законом электролиза, коэффициент k, зависящий от выделяющегося вещества, называется электрохимическим эквивалентом вещества.
Проводимость жидких электролитов объясняется тем, что при растворении в воде нейтральные молекулы солей, кислот и оснований распадаются на отрицательные и положительные ионы. В электрическом поле ионы приходят в движение и создают электрический ток.

Существуют не только жидкие, но и твёрдые электролиты. Примером твёрдого электролита может служить стекло. В составе стекла имеются положительные и отрицательные ионы. В твёрдом состоянии стекло не проводит электрический ток, так как ионы не могут двигаться в твёрдом теле. При нагревании стекла ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником.
Явление электролиза применяется на практике для получения многих металлов из раствора солей. С помощью электролиза для защиты от окисления или для украшения производится покрытие различных предметов и деталей машин тонкими слоями таких металлов, как хром, никель, серебро, золото.
Остались вопросы? Не знаете, что такое электролиты?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Электролиз — Википедия
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t}, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея[править | править код]
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=MzeNAIΔt{\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m=MzFIΔt{\displaystyle m={\frac {M}{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=MFz{\displaystyle k={\frac {M}{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Расплавы[править | править код]
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы[править | править код]
Активные металлы[править | править код]
Менее активные металлы и неактивные металлы[править | править код]
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
| |||
Что такое электролиты и для чего они нужны.
Во время физической нагрузки мышцы вырабатывают энергию. Однако, далеко не вся она тратится на выполнение работы: немалая часть выделяется в виде тепла, а значит, организму требуется своевременное охлаждение, которое происходит за счет испарения пота.Все знают, что при повышенном потоотделении организм теряет жидкость, запасы которой нужно своевременно восполнять. Однако, помимо воды, организм теряет еще и электролиты. Что это такое? Зачем они нужны? К чему может привести их недостаток?
Электролиты – это соли, которые распадаются в водных растворах на частицы с электрическим зарядом – ионы. Минеральные соли, присутствующие в водных растворах внутри и вне клеток, перемещаются в этой электропроводящей форме в качестве положительно заряженных катионов или отрицательно заряженных анионов. Наиболее важные катионы: Na, K, Ca, Mg, Fe, Cu, Co, Zn, Mn. Наиболее важные анионы: хлорид, гидроокись углерода, фосфат, сульфат, йодид.
Электролиты выполняют множество важных функций: поддержание осмотического давления в клетках, поддержание электропроводимости межклеточных жидкостей, поддержание кислотно-щелочного баланса, проведение нейростимулов к синапсам, сокращения мышц. Низкие электролитные уровни приводят к потере работоспособности из-за обезвоживания организма, синдрома «скованных мышц», накопления в мышцах молочной кислоты.
Но выпить подсоленной воды или съесть что-нибудь солененькое будет недостаточно: обычная пищевая соль – это хлорид натрия, и недостаток других электролитов она восполнить не поможет. К тому же, недостаток натрия развивается редко: в еде его более, чем достаточно. Но с потом теряются и другие элементы, например, калий.
Натрий и калий – вещества-антагонисты. В процессе жизнедеятельности клеточная мембрана постоянно выкачивает наружу, в кровь, ионы натрия и поглощает ионы калия, так что создается большая разница в концентрации этих ионов внутри и снаружи. Правда, за счет диффузии они пытаются «восстановить справедливость», так что этот механизм (он называется натрий-калиевый насос) работает непрерывно. Он нужен для поддержания электрической активности в нервных и мышечных клетках, для активного транспорта некоторых веществ, например сахаров и аминокислот. Высокие концентрации калия требуются также для белкового синтеза. При недостатке калия все эти механизмы начинают хуже работать, и, в добавок, из-за высокой концентрации натрия, который без калия нельзя удалить, в клетку начинает поступать избыток воды. Появляются отеки и… обезвоживание. Ведь вода оказывается «заперта» в клетках, а кровь густеет, сердцу становится тяжело работать, появляются нарушения сердечного ритма, ухудшается снабжение всех органов кислородом и питательными веществами. Этот тип обезвоживания продолжает развиваться даже при неограниченном потреблении пресной воды!
Негативно сказывается недостаток калия и на нервной системе: ухудшается электрическая проводимость нервных клеток, падает внимание, замедляется реакция, появляется синдром «скованных мышц».
Еще один важный элемент – магний. Одна из самых важных функций магния – участие в проведении нервных импульсов, но не любых, а только тормозящих. При недостатке магния возбуждающие сигналы проходят, а тормозящие – нет, им не хватает «транспорта». Результатом такого дисбаланса становятся судороги (мышца получила команду напрячься, а команду расслабиться – нет), бессонница, повышенная тревожность.
Своевременное восполнение дефицита электролитов не менее важно, чем восполнение запасов жидкости. Так что, при интенсивных тренировках очень важно следить за тем, чтобы рацион питания был правильно сбалансирован и восполнял потребности организма в микроэлементах, а не только уделять внимание подсчитыванию калорий. Если собираетесь сочетать диету с физическими нагрузками, без совета врача-диетолога вам не обойтись! В качестве «скорой помощи» можно использовать спортивные напитки, которые содержат основные необходимые электролиты.
электролит — это… Что такое электролит?
электролит — электролит … Орфографический словарь-справочник
ЭЛЕКТРОЛИТ — (греч.). Жидкое тело, разлагаемое при помощи электрического (гальванического) тока. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭЛЕКТРОЛИТ Жидкость, подверженная разложению посредством гальванического тока.… … Словарь иностранных слов русского языка
электролит — а, м. électrolyte m. < électro + гр. lytos разлагаемый. спец. Химическое вещество (в расплаве или растворе), способное разлагаться на составные части при прохождении через него электрического тока. Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
электролит — Раствор, в котором при прохождении через него электрического тока происходит разложение вещества, которое приводит к появлению электрического тока. Электролит является основой аккумуляторов и батарей. [Гипертекстовый энциклопедический словарь по… … Справочник технического переводчика
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, раствор или расплав солей, способный проводить электрический ток и используемый для ЭЛЕКТРОЛИЗА (в ходе которого он разлагается). Ток в электролитах проводится заряженными частицами ИОНАМИ, а не электронами. Например, в свинцово… … Научно-технический энциклопедический словарь
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, электролита, муж. (от слова электрический и греч. lytos растворенный) (физ.). Раствор какого нибудь вещества, способного разлагаться на составные части при электролизе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
электролит — сущ., кол во синонимов: 1 • католит (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролит — Электролитами называют вещества, растворы и сплавыкоторых с другими веществами электролитически проводят гальваническийток. Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭЛЕКТРОЛИТ — вещество, водный раствор или расплав которого проводит электрический ток (см.), образующимися в результате электролитической (см.). Этим Э., называемые также (см.) второго рода, отличаются от металлов (проводников первого рода), в которых перенос … Большая политехническая энциклопедия
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
