Алканы — Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan.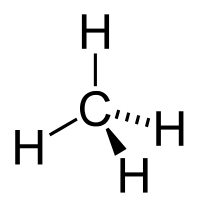 |
 |
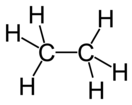
| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг
Рациональная[править | править код]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
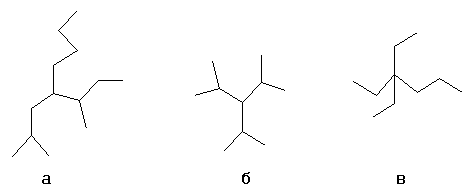
- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
- б: триизопропилметан
Систематическая ИЮПАК[править | править код]
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Например:
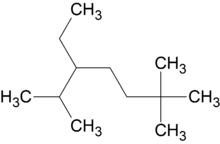 2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C13H28 — жидкостями, а начиная с C14H30 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C
- Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см³ | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при T | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,638 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 378,3 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 399,7 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
ИК-спектроскопия[править | править код]
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия[править | править код]
Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения[править | править код]
Галогенирование[править | править код]
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
- Ch5+Cl2→Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2→Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2→CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}}
- CHCl3+Cl2→CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}}
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
- Cl:Cl→hνCl·+·Cl{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}
2) Рост цепи
- Ch4-Ch3-Ch4+Cl·→Ch4-CH˙-Ch4+HCl{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}
- Ch4-CH˙-Ch4+Cl:Cl→Ch4-CHCl-Ch4+Cl·{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}
3) Обрыв цепи
- Ch4-CH˙-Ch4+Cl·→Ch4-CHCl-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование[править | править код]
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
- Ch4-Ch3-Ch3-Ch4→O2;SO2;hνCh4-Ch3-Ch3-Ch3-SO2OH{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}
Сульфохлорирование (реакция Рида)[править | править код]
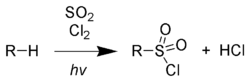 При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
- RH+Cl⋅→R⋅+HCl{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
- R⋅+SO2→RSO2⋅{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
- RSO2⋅+Cl2→RSO2Cl+Cl⋅{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Легче всего сульфохлорируются углеводы линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование[править | править код]
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
- RH+HNO3→RNO2+h3O{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления[править | править код]
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- RH+O2→R⋅+HOO⋅{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}
- R⋅+O2→ROO⋅{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}
- ROO⋅+RH→ROOH+R⋅{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- Ch5+2O2→CO2+2h3O+ΔQ{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
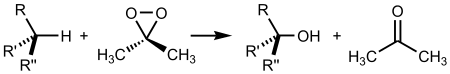
Реакция окисления алканов диметилдиоксираном:
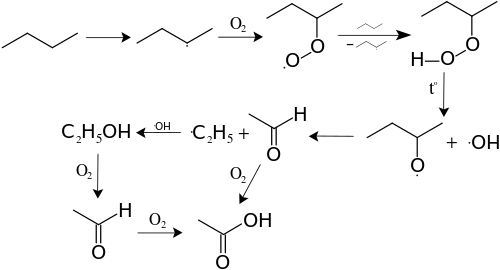
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов[править | править код]
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Ch5→ot>1000oCC+2h3{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
- C2H6→2C+3h3{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
- 2Ch5→ot>1500oCC2h3+3h3{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов.
- Ch4-Ch3:Ch4→1500∘CCh4-Ch3·+·Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{:}}CH_{3}{\xrightarrow {1500^{\circ }C}}CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{3}}}}
1) Рекомбинация
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch3-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch3-Ch4→Ch4-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch4→Ch4-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{3}}}}
2) Диспропорционирование
- Ch4·+·Ch3-Ch4→Ch5+Ch3=Ch3{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{4}+CH_{2}{\text{=}}CH_{2}}}}
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch4+Ch3=
Этан — Википедия
| Этан | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | Этан | ||
| Хим. формула | C2H6 | ||
| Рац. формула | H3CCH3 | ||
| Состояние | газ | ||
| Молярная масса | 30,07 г/моль | ||
| Плотность | 1,2601 кг/м³ в стандартных условиях по ГОСТ 2939—63; при н. у. (0С) 0,001342 г/см³ | ||
| Температура | |||
| • плавления | −182,8 °C | ||
| • кипения | −88,6 °C | ||
| • вспышки | 152 °C | ||
| • воспламенения | 152 °C | ||
| • самовоспламенения | 472 °C | ||
| Мол. теплоёмк. | 52,65 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -84,67 кДж/моль | ||
| Давление пара | 2,379 МПа (0°С) | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 42 (вода, 20°С) | ||
| Рег. номер CAS | 74-84-0 | ||
| PubChem | 6324 | ||
| Рег. номер EINECS | 200-814-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | Kh4800000 | ||
| ChEBI | 42266 | ||
| Номер ООН | 1035 | ||
| ChemSpider | 6084 | ||
| Токсичность | Малотоксичен. Обладает слабым наркотическим действием | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | P210, P377, P381, P410+P403 | ||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |   | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
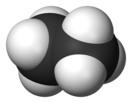
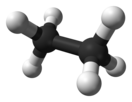
Эта́н (лат. ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. Газ без цвета и запаха. В промышленности этан получают из природного газа и нефти и расходуют преимущественно для производства этилена.
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −183,23 °C, температура кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °C — 2,379 МПа. Растворимость в воде — 4,7 мл в 100 мл (при 20 °C), в этаноле — 46 мл в 100 мл (при 0 °C), хорошо растворяется в углеводородах. Точка вспышки у этана равна –187,8 °C, температура самовоспламенения — 595 °C. Этан образует с воздухом взрывоопасные смеси при содержании 5–15 об. % (при 20 °C). Октановое число —120,3[2][3][4].
 Параметры молекулы этана
Конформеры этана
Параметры молекулы этана
Конформеры этанаМолекула этана имеет тетраэдрическое строение: атомы углерода являются sp3-гибридными. Связь C–C образована перекрыванием sp3-гибридных орбиталей, а связь C–H — перекрыванием sp3-гибридной орбитали углерода и s-орбитали водорода. Длина связи C–C равна 1,54 Å, а длина связи C–H равна 1,095 Å[5].
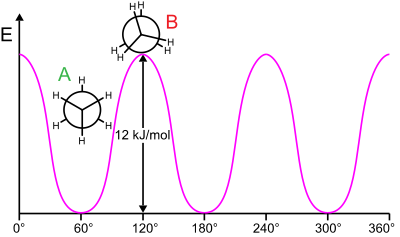
Поскольку С–С-связь в этане одинарная, вокруг неё возможно свободное вращение метильных групп. При вращении возникают различные пространственные формы молекулы этана, которые называются конформациями. Конформации принято изображать в виде перспективного изображения (такие изображения иногда называют «лесопильными козлами») либо в виде проекций Ньюмена[5].
Число конформаций для этана бесконечно, однако принято рассматривать две крайние конформации:
- заслонённую, в которой атомы водорода максимально сближены в пространстве;
- и заторможенную, в которой атомы водорода максимально удалены[5].
Заслонённая конформация имеет наибольшую энергию из всех конформаций, а заторможенная — наименьшую, то есть является наиболее энергетически выгодной и, следовательно, более устойчивой. Разница энергии между этими конформациями равна 2,9 ккал/моль. Считается, что это число отражает торсионное напряжение в менее выгодной заслонённой конформации. Если разделить эту энергию на три взаимодействия между парами атомов водорода, то энергия торсионного взаимодействия двух атомов водорода составит примерно 1 ккал/моль[5].
По значению 2,9 ккал/моль из уравнения Гиббса можно вычислить константу равновесия между двумя конформациями этана. При температуре 25 °С значительно преобладает заторможенная конформация: 99 % молекул этана находятся в этой конформации и лишь 1 % — в заслонённой[5].
Энергии крайних и промежуточных конформаций принято представлять в виде циклических графиков, где по оси абсцисс отложен торсионный угол, а по оси ординат — энергия.
В промышленности[править | править код]
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена[6]. Также этан получают при гидрокрекинге углеводородов и ожижении углей[7].
В лабораторных условиях[править | править код]
В 1848 году Кольбе и Франкленд впервые синтетически получили этан, обработав пропионитрил металлическим калием. В 1849 году они получили этот газ электролизом ацетата калия и действием цинка и воды на иодэтан[8].
В лаборатории этан можно получить несколькими способами:
- 2Ch4I+2Na→Ch4Ch4+2NaI{\displaystyle {\mathsf {2CH_{3}I+2Na\rightarrow CH_{3}CH_{3}+2NaI}}}
- Ch4COO−−e−→Ch4COO⋅→Ch4⋅+CO2{\displaystyle {\mathsf {CH_{3}COO^{-}-e^{-}\rightarrow CH_{3}COO\cdot \rightarrow CH_{3}\cdot +CO_{2}}}}
- 2Ch4⋅→Ch4Ch4{\displaystyle {\mathsf {2CH_{3}\cdot \rightarrow CH_{3}CH_{3}}}}
- Ch4Ch3COONa+NaOH→Ch4Ch4+Na2CO3{\displaystyle {\mathsf {CH_{3}CH_{2}COONa+NaOH\rightarrow CH_{3}CH_{3}+Na_{2}CO_{3}}}}
- Ch4Ch3Br+Mg→Ch4Ch3MgBr{\displaystyle {\mathsf {CH_{3}CH_{2}Br+Mg\rightarrow CH_{3}CH_{2}MgBr}}}
- Ch4Ch3MgBr+h3O→Ch4Ch4+MgOHBr{\displaystyle {\mathsf {CH_{3}CH_{2}MgBr+H_{2}O\rightarrow CH_{3}CH_{3}+MgOHBr}}}
- Ch3Ch3+h3→Ch4Ch4{\displaystyle {\mathsf {CH_{2}CH_{2}+H_{2}\rightarrow CH_{3}CH_{3}}}}
- HC≡CH+2h3→Ch4Ch4{\displaystyle {\mathsf {HC\equiv CH+2H_{2}\rightarrow CH_{3}CH_{3}}}}
Этан вступает в типичные реакции алканов, прежде всего реакции замещения, проходящие по свободнорадикальному механизму. Среди химических свойства этана можно выделить:
Основное использование этана в промышленности — получение этилена методом парового крекинга. Именно из этилена далее получают важные промышленные продукты, однако в целях экономии разрабатываются методы превращения в них самого этана. Однако ни один из проектов пока не прошёл пилотную стадию. Проблемы в этой области связаны с низкой селективностью реакций. Одним из перспективных направлений является синтез винилхлорида напрямую из этана. Также применяется превращение этана в уксусную кислоту. Термическим хлорированием этана в различных условиях получают хлорэтан, 1,1-дихлорэтан и 1,1,1-трихлорэтан[7].
Этан обладает слабым наркотическим действием (ослаблено за счёт низкой растворимости в жидкостях организма). Класс опасности — четвёртый[9]. В концентрациях 2-5 об. % он вызывает одышку, в умеренных концентрациях — головные боли, сонливость, головокружение, повышенное слюноотделение, рвоту и потерю сознания из-за недостатка кислорода. В высоких концентрациях этан может вызвать сердечную аритмию, остановку сердца и остановку дыхания. При постоянном контакте может возникнуть дерматит. Сообщается, что при 15-19 об. % этан вызывает повышение чувствительности миокарда к катехоламинам[10].
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[11].
- ↑ Ethane (неопр.). Sigma-Aldrich. Дата обращения 6 апреля 2019.
- ↑ Ullmann, 2014, p. 3–5.
- ↑ 1 2 3 Химическая энциклопедия.
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е. — Химия, 1978. — С. 199.
- ↑ 1 2 3 4 5 Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия : в 4 т.. — 5-е изд. — БИНОМ. Лаборатория знаний, 2014. — Т. 1. — С. 321—326. — ISBN 978-5-9963-1535-2.
- ↑ Химическая энциклопедия, 1998.
- ↑ 1 2 Ullmann, 2014, p. 13.
- ↑ ЭСБЕ.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03
- ↑ Ullmann, 2014, p. 61.
- ↑ Mousis O., Schmitt B. Sequestration of Ethane in the Cryovolcanic Subsurface of Titan (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 2008. — April (vol. 677). — DOI:10.1086/587141.
- Братков А. А. Этан // Химическая энциклопедия: в 5 т. / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 491. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Schmidt R., Griesbaum K., Behr A., Biedenkapp D., Voges H.-W., Garbe D., Paetz C., Collin G., Mayer D., Höke H. Hydrocarbons (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2014. — DOI:10.1002/14356007.a13_227.pub3.
- The chemistry of alkanes and cycloalkanes / Ed. Saul Patai and Zvi Rappoport. — John Wiley & Sons, 1992. — ISBN 0-471-92498-9.
- Тутурин Н. Н. Этан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
метан этан пропан что дальше??мне нужна таблица…всеми этими веществами,формулы…скиньте ссылку плиз?
Ищи гомологический ряд метана. в ГУУГЛе
<a rel=»nofollow» href=»http://ru.wikipedia.org/wiki/алканы» target=»_blank»>http://ru.wikipedia.org/wiki/алканы</a>
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
Окисление бутанов метана — Справочник химика 21
Каталитическое окисление в жидкой фазе имеет то преимущество перед газофазным процессом, что позволяет более точно регулировать состав конечных продуктов [60]. Та1 , при окислепии н-бутана в жидкой фазе образуется в первую очередь уксусная кислота при полном отсутствии формальдегида. При окислепии же пропана в газовой фазе, напротив, образуются главным образом пропионовый альдегид, пропиловый спирт, ацетон, уксусный альдегид, уксусная кислота, формальдегид, метиловый спирт, окись пропилена, окись этилена. При окислении н-гексана теоретически можно получить около 60 различных продуктов окисления, не считая вторичных продуктов, образующихся за счет дальнейших реакций кислородсодержащих компонентов. Метан и этан не только содержатся в значительно больших количествах в природном газе, чем пропан или бутан, но они представляют интерес и для применения в качестве исходного сырья, так как нри окислении дают продукты более простого состава. Именно сложный состав продуктов газофазного окисления был причиной того, что внедрение этого процесса в промышленную практику сильно задержалось. [c.151]Метод каталитического обезвреживания газообразных отходов заключается в проведении окислительно-восстановительных процессов при температуре 75—500°С на поверхности катализаторов. В качестве носителей металлов, используемых как катализаторы (платина, палладий, осмий, медь, никель, кобальт, цинк, хром, ванадий, марганец), применяются асбест, керамика, силикагель, пемза, оксид алюминия и др. На эффективность процесса оказывает влияние начальная концентрация обезвреживаемого соединения, степень запыленности газов, температура, время контакта и качество катализатора. Наиболее целесообразное использование метода— при обезвреживании газов с концентрацией соединений не более 10—50 г/м . На низкотемпературных катализаторах при избытке кислорода и температуре 200—300°С окисление ряда низко-кипящих органических соединений (метан, этан, пропилен, этилен, ацетилен, бутан и др.) протекает нацело до СО2, N2 и Н2О. В то же время обезвреживание высококипящих или высокомолекулярных органических соединений данным методом осуществить невозможно из-за неполного окисления и забивки этими соединениями поверхности катализатора. Так же невозможно применение катализаторов для обезвреживания элементорганических соединений из-за отравления катализатора НС1, НР, 502 и др. Метод используется для очистки газов от N0 -f N02 с применением в качестве восстановителей метана, водорода, аммиака, угарного газа. Срок службы катализаторов 1—3 года. Несмотря на большие преимущества перед другими способами очистки газов метод каталитического обезвреживания имеет ограниченное применение [5.52, 5 54 5.62] [c.500]
Окисление легких алканов. В промышленности окисляют главным образом метан, пропан и бутан. С корость окисления возрастает от метана к бутану. Трудность регулирования процесса связана с тем, что продукты окисления (спирты, альдегиды и кетоны) окисляются легче, чем исходное сырье. [c.273]
Как правило, метан и его гомологи реагируют с кислородом в газовой фазе при температуре от 250° и выше, образуя наиболее устойчивые из всех возможных продуктов окисления, а именно спирты, альдегиды или кетоны, кислоты и окиси. В случае высших углеводородов всегда происходит разрыв углеродной цепи, и часто кислородсодержащие соединения с тем же числом атомов углерода, что и исходный углеводород, составляют небольшую долю общего количества полезных продуктов окисления. Из всех углеводородов наиболее трудно окисляется метан. При последовательном переходе от метана к бутану легкость окисления увеличивается. Давление благоприятствует увеличению выхода и несколько ограничивает степень окисления. Перед началом реакции обычно наблюдается индукционный период. Твердые катализаторы и присутствие водяного пара не оказывают большого влияния на течение процесса. В этом отношении следует отметить аналогию с парофазным нитрованием (гл. 6), причем важно подчеркнуть, что нитрование азотной кислотой всегда сопровождается окислением, протекающим в значительной степени. [c.69]
Окисление пропана и бутана имеет и другие преимущества но сравнению с окислением метана и этана. Во-первых, пропан и бутан окисляются при более низких температурах. Во-вторых, пропан и бутан легче отделяются от других газообразных продуктов окисления, чем метан и этан, что исключительно важно, так как обычно окисление проводят при избытке углеводорода, который необходимо возвращать в процесс. В-третьих, при получении чистых исходных газов пропан и бутан легче отделять от метана и этана, а также друг от друга, чем метан от этана. [c.306]
Относительная реакционная способность типичных водородных атомов понижается от третичных к вторичным и первичным. При 300° скорости их окисления относятся как 10 2 1. Поэтому изобутан окисляется очень легко. Метан и этан, содержащие только первичные водородные атомы, чрезвычайно устойчивы к окислению. Пронан и бутан, имеющие первичные и вторичные водородные атомы, занимают среднее положение. В настоящее время еще не известен промышленный способ окисления метана в метиловый спирт пли формальдегид. [c.150]
Наиболее трудно из газообразных парафиновых углеводородов окисляется метан. При переходе от метана к бутану скорость окисления возрастает. Метан и его гомологи реагируют с кислородом в газовой фазе при температуре выше 250°С. Теоретически из метана можно получить метанол, формальдегид и муравьиную кислоту (не считая окислов углерода) [c.171]
Из газообразных парафиновых углеводородов наиболее трудно окисляется метан, а при переходе от метана к бутану скорость окисления возрастает. Метан (как и его гомологи) реагирует с кислородом в газовой фазе при температуре выше 250 °С. Теоретически из метана можно получить метиловый спирт, формальдегид и муравьиную кислоту [c.110]
Широко исследовано применение для окисления алканов окислителей на основе переходных металлов. Обзоры по механизмам реакции с использованием в качестве окислителей марганца(VII), хрома(VI), ванадия (V), кобальта(III), марганца (III), церия (IV) и свинца (IV) опубликованы Стюартом [138] и Вибергом [139]. Окисление насыщенных углеводородов неорганическими окислителями идет в довольно жестких условиях поскольку первоначальные продукты реакции обычно более склонны к окислению, чем сами алканы, образуются значительные количества продуктов вторичного окисления. Трудно, например, окислить метиленовую группу во вторичную спиртовую группу без дальнейшего окисления в кетонную группировку в некоторых случаях

 (
(